吡嘧司特钾
一、新药名称
正式品名:吡嘧司特钾
英文名:Pemirolast Potassium
中文化学名:9-甲基-3-(1H-四氮唑-5-基)-4H-吡啶并[1,2a]嘧啶-4-酮钾
英文化学名:9-Methyl-3-(1H-Tetrazol-5-yl)-4H-Pyrido[1,2a] pyrimidin-4-one Potassium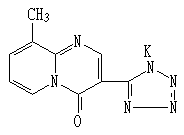 化学结构式:
化学结构式:
分子式:C10H7N6OK
, 百拇医药
分子量:266.30
二、命名依据
参照药典会编订的“药名词汇”,将“Pemirolast”译为“吡嘧司特”,本品为钾盐,故本品正式品名应为“吡嘧司特钾”。三、选题目的与依据
本品为新型肥大细胞膜稳定剂,是由布迈-施贵宝和Tokyo Tanabe制药公司共同研制开发的一个能够抑制抗原引起的变态反应介质释放的药物。
在人肺组织、人外周白细胞,大鼠腹膜渗出细胞、大鼠肺组织和豚鼠组织细胞中,本品能剂量依赖性地抑制抗原-抗体反应引起的组胺、白三烯类物质(D4,B4,过敏性慢反应物质)、前列腺素D3、血栓素B2,B细胞激活因子等的释放。
, 百拇医药
在大鼠和豚鼠,本品能剂量依赖性地抑制被动皮肤过敏反应(PCA)和实验性哮喘。本品强效地抑制细胞外Ca2+内流及细胞内Ca2+的释放,这在通过抑制肌醇磷酯代谢的化学介质的释放中起重要作用。
本品也抑制花生四烯酸的释放,而且由于本品抑制磷酸二酯酶似可增加cAMP的作用 。
在体外,本品可抑制免疫蛋白IgE介导的腹膜浆细胞(peritoneal exudate cell,PEC)中组胺的释放,其IC50为5.1mg/ml。这一作用不受肾上腺素药物或β-受体阻滞药的影响。而且若在滴加抗原的同时加入本品,可获得最大抑制率;如提前加注,则随加注的时间的延长,药效会逐渐降低。
本品用量为0.1mmol/L时,可抑制抗原引起的人淋巴细胞或肺组织细胞中化学介质如组胺和慢反应物质(SRS-A)的释放,最大抑制剂量分别为10mmol/L和1mmol/L,相应的最大抑制率为50.5%和74.0%。
, http://www.100md.com
在体实验研究表明:实验动物经口服或注射给予吡嘧司特钾,能明显抑制免疫蛋白IgE或IgA抗体引起的被动皮肤过敏反应。该药具有快速减敏作用,但与色甘酸二钠之间无交叉快速减敏作用。药物的疗效存在着种属差异,豚鼠的用量明显高于大鼠用量。与色甘酸二钠和曲尼司特相比,本品的药效更强。
给致敏动物静注本品1-5mg或经口给药10-100mg后,可抑制吸入抗原导致的哮喘,且药效具剂量依赖性;注射剂量为0.3mg/kg时,还可抑制PAF引起的支气管收缩。
值得指出的是:本品只对I型变态反应有效,而对啮齿类动物的II-IV型变态反应无效。是一种特异的I型变态反应抑制剂。
实验犬口服本品0.2,1.0和5.0mg/kg后,血浆药物峰浓度随给药量的增加而升高,消除半衰期则随剂量的加大而延长。在0.20mg/kg时,t1/2为0.73h,静注给药和经口给药的AUC值分别为0.416和0.307μg/ml。血浆蛋白结合率为66%,大鼠经口或静注给药6小时后,尿中排泄率分别为75%和57%。
, 百拇医药
健康受试者单剂量口服本品后1-2小时内达血浆峰值,4-5小时内自体内消除,血浆结合率96%。有四种代谢物经尿排泄。
健康成人在两餐之间口服本品单剂量2.5、5、10、20和40mg后呈剂量依赖性地被吸收。给药后1-1.7小时血浆达峰值浓度,半衰期为4-5小时.
健康成人服用本品10mg一日2次(早、午餐后服)连续三天,药物最低血浆浓度从第2天起达稳态,在人肺组织中维持在有效浓度附近。健康成人在两餐之间口服本品单剂量2.5、10mg和40mg,24小时后尿排泄药量达83.5-87.7%。
口服本品10mg一日3次(餐后)共七天,第八天后药物的尿排泄率与口服本品单剂量后的尿排泄率相似,表明本品无蓄积作用。尿代谢主要为葡糖醛酸共轭化合物。
本品可用于防治过敏性鼻炎,且无明显的不良反应;同时含0.1%本品的滴眼液可治疗过敏性结膜炎;本品亦可治疗特异性皮炎。
, 百拇医药
本品的上市剂型为5、10mg的片剂、5mg干糖浆以及0.1%的滴眼液。四、国内外有关本品的研究,使用和生产情况综述
本品最早是由美国布迈-施贵宝公司和日本Tokyo Tanabe制药公司共同研制开发成功的,1991年首先在日本上市,随后在美国、欧洲等十多个国家上市。我公司于1999年开始研制本品,开发剂型为10mg片剂和10mg胶囊,现已完成了临床前的研究工作,按二类新药的要求向药监局申报。
临床研究方面:20位支气管哮喘病人服用本品片剂10mg,每日2次,每次一片,连续24周。从第8周起即可观察到病情的明显改善。无其他副作用,亦无与该药有关的其它临床可见的不良反应。研究结束时,20位患者中7位显效,3位有效,4位部分缓解,无效者6位。
在另一次临床试验中,31位患者服用本品20mg/d,连续12-24周。显效率为29.0%,有效率为54.8%,呈轻度改善以上者占71.0%。
, http://www.100md.com
临床研究还发现,本品对50岁以上、病程超过5-10年的哮喘者由尤为有效。且用药后,药效出现的延迟时间长。表明该药长期服用方有效。
在对112名支气管哮喘患者进行的多中心双盲研究中,本品不良反应发生率为3.6%,小于对照药tranilast(12.4%),其中恶心,0.9%;头痛,0.9%;皮疹,0.9%;血小板轻度升高,0.9%。
令人感兴趣的是,本品对预防血管成形术后再狭窄也有很好的效果。104位患心肌缺血性心脏病、接受经皮经腔冠状动脉成形术(PTCA)治疗的患者,自术前一周每日给予20mg吡嘧司特钾,持续用药至术后4月,再狭窄发生率显著低于对照组,由于再狭窄引发的心绞痛发生率显著低于对照组,由于再狭窄必须再次进行PTCA手术的比例也显著低于对照组。五、国内外有关本品的专利及行政保护检索情况
本品是由美国施贵宝公司研制开发的,1993年在中国申请了制备方法的专利,专利号为CN1080289,该专利1996年撤销。该品化合物没有在中国申请专利也没有申请行政保护,所以不涉及专利及行政保护的问题。, http://www.100md.com
正式品名:吡嘧司特钾
英文名:Pemirolast Potassium
中文化学名:9-甲基-3-(1H-四氮唑-5-基)-4H-吡啶并[1,2a]嘧啶-4-酮钾
英文化学名:9-Methyl-3-(1H-Tetrazol-5-yl)-4H-Pyrido[1,2a] pyrimidin-4-one Potassium
 化学结构式:
化学结构式:分子式:C10H7N6OK
, 百拇医药
分子量:266.30
二、命名依据
参照药典会编订的“药名词汇”,将“Pemirolast”译为“吡嘧司特”,本品为钾盐,故本品正式品名应为“吡嘧司特钾”。三、选题目的与依据
本品为新型肥大细胞膜稳定剂,是由布迈-施贵宝和Tokyo Tanabe制药公司共同研制开发的一个能够抑制抗原引起的变态反应介质释放的药物。
在人肺组织、人外周白细胞,大鼠腹膜渗出细胞、大鼠肺组织和豚鼠组织细胞中,本品能剂量依赖性地抑制抗原-抗体反应引起的组胺、白三烯类物质(D4,B4,过敏性慢反应物质)、前列腺素D3、血栓素B2,B细胞激活因子等的释放。
, 百拇医药
在大鼠和豚鼠,本品能剂量依赖性地抑制被动皮肤过敏反应(PCA)和实验性哮喘。本品强效地抑制细胞外Ca2+内流及细胞内Ca2+的释放,这在通过抑制肌醇磷酯代谢的化学介质的释放中起重要作用。
本品也抑制花生四烯酸的释放,而且由于本品抑制磷酸二酯酶似可增加cAMP的作用 。
在体外,本品可抑制免疫蛋白IgE介导的腹膜浆细胞(peritoneal exudate cell,PEC)中组胺的释放,其IC50为5.1mg/ml。这一作用不受肾上腺素药物或β-受体阻滞药的影响。而且若在滴加抗原的同时加入本品,可获得最大抑制率;如提前加注,则随加注的时间的延长,药效会逐渐降低。
本品用量为0.1mmol/L时,可抑制抗原引起的人淋巴细胞或肺组织细胞中化学介质如组胺和慢反应物质(SRS-A)的释放,最大抑制剂量分别为10mmol/L和1mmol/L,相应的最大抑制率为50.5%和74.0%。
, http://www.100md.com
在体实验研究表明:实验动物经口服或注射给予吡嘧司特钾,能明显抑制免疫蛋白IgE或IgA抗体引起的被动皮肤过敏反应。该药具有快速减敏作用,但与色甘酸二钠之间无交叉快速减敏作用。药物的疗效存在着种属差异,豚鼠的用量明显高于大鼠用量。与色甘酸二钠和曲尼司特相比,本品的药效更强。
给致敏动物静注本品1-5mg或经口给药10-100mg后,可抑制吸入抗原导致的哮喘,且药效具剂量依赖性;注射剂量为0.3mg/kg时,还可抑制PAF引起的支气管收缩。
值得指出的是:本品只对I型变态反应有效,而对啮齿类动物的II-IV型变态反应无效。是一种特异的I型变态反应抑制剂。
实验犬口服本品0.2,1.0和5.0mg/kg后,血浆药物峰浓度随给药量的增加而升高,消除半衰期则随剂量的加大而延长。在0.20mg/kg时,t1/2为0.73h,静注给药和经口给药的AUC值分别为0.416和0.307μg/ml。血浆蛋白结合率为66%,大鼠经口或静注给药6小时后,尿中排泄率分别为75%和57%。
, 百拇医药
健康受试者单剂量口服本品后1-2小时内达血浆峰值,4-5小时内自体内消除,血浆结合率96%。有四种代谢物经尿排泄。
健康成人在两餐之间口服本品单剂量2.5、5、10、20和40mg后呈剂量依赖性地被吸收。给药后1-1.7小时血浆达峰值浓度,半衰期为4-5小时.
健康成人服用本品10mg一日2次(早、午餐后服)连续三天,药物最低血浆浓度从第2天起达稳态,在人肺组织中维持在有效浓度附近。健康成人在两餐之间口服本品单剂量2.5、10mg和40mg,24小时后尿排泄药量达83.5-87.7%。
口服本品10mg一日3次(餐后)共七天,第八天后药物的尿排泄率与口服本品单剂量后的尿排泄率相似,表明本品无蓄积作用。尿代谢主要为葡糖醛酸共轭化合物。
本品可用于防治过敏性鼻炎,且无明显的不良反应;同时含0.1%本品的滴眼液可治疗过敏性结膜炎;本品亦可治疗特异性皮炎。
, 百拇医药
本品的上市剂型为5、10mg的片剂、5mg干糖浆以及0.1%的滴眼液。四、国内外有关本品的研究,使用和生产情况综述
本品最早是由美国布迈-施贵宝公司和日本Tokyo Tanabe制药公司共同研制开发成功的,1991年首先在日本上市,随后在美国、欧洲等十多个国家上市。我公司于1999年开始研制本品,开发剂型为10mg片剂和10mg胶囊,现已完成了临床前的研究工作,按二类新药的要求向药监局申报。
临床研究方面:20位支气管哮喘病人服用本品片剂10mg,每日2次,每次一片,连续24周。从第8周起即可观察到病情的明显改善。无其他副作用,亦无与该药有关的其它临床可见的不良反应。研究结束时,20位患者中7位显效,3位有效,4位部分缓解,无效者6位。
在另一次临床试验中,31位患者服用本品20mg/d,连续12-24周。显效率为29.0%,有效率为54.8%,呈轻度改善以上者占71.0%。
, http://www.100md.com
临床研究还发现,本品对50岁以上、病程超过5-10年的哮喘者由尤为有效。且用药后,药效出现的延迟时间长。表明该药长期服用方有效。
在对112名支气管哮喘患者进行的多中心双盲研究中,本品不良反应发生率为3.6%,小于对照药tranilast(12.4%),其中恶心,0.9%;头痛,0.9%;皮疹,0.9%;血小板轻度升高,0.9%。
令人感兴趣的是,本品对预防血管成形术后再狭窄也有很好的效果。104位患心肌缺血性心脏病、接受经皮经腔冠状动脉成形术(PTCA)治疗的患者,自术前一周每日给予20mg吡嘧司特钾,持续用药至术后4月,再狭窄发生率显著低于对照组,由于再狭窄引发的心绞痛发生率显著低于对照组,由于再狭窄必须再次进行PTCA手术的比例也显著低于对照组。五、国内外有关本品的专利及行政保护检索情况
本品是由美国施贵宝公司研制开发的,1993年在中国申请了制备方法的专利,专利号为CN1080289,该专利1996年撤销。该品化合物没有在中国申请专利也没有申请行政保护,所以不涉及专利及行政保护的问题。, http://www.100md.com