第二节 病毒的增殖
病毒体在细胞外是处于静止状态,基本上与无生命的物质相似,当病毒进入活细胞后便发挥其生物活性。由于病毒缺少完整的酶系统,不具有合成自身成份的原料和能量,也没有核糖体,因此决定了它的专性寄生性,必须侵入易感的宿主细胞,依靠宿主细胞的酶系统、原料和能量复制病毒的核酸,借助宿主细胞的核糖体翻译病毒的蛋白质。病毒这种增殖的方式叫做“复制(Replication)”。病毒复制的过程分为吸附、穿入、脱壳、生物合成及装配释放五个步骤,又称复制周期(Replication cycle)。
一、吸附
吸附(Adsorption)是指病毒附着于敏感细胞的表面,它是感染的起始期。特异性吸附是非常重要的,根据这一点可确定许多病毒的宿主范围,不吸附就不能引起感染。细胞与病毒相互作用最初是偶然碰撞和静电作用,这是可逆的联结。脊髓灰质炎病毒的细胞表面受体是免疫球蛋白超家族,在非灵长类细胞上没有发现此受体,而猴肾细胞、 Hela细胞和人二倍体纤维母细胞上有它的受体,故脊髓来质炎病毒能感染人体鼻、咽、肠和脊髓前角细胞,引起脊髓灰质炎(小儿麻痹)。水磨石病毒的细胞表面受体是含唾液酸(N-乙酰神经氨酸)的糖蛋白,它与流感病毒表面的血凝素剌突(受体连结蛋白)有特殊的亲和力,如用神经氨酸酶破坏该受体,则流感病毒不再吸附这种细胞。此外,HIV受体为CD4;鼻病毒的受体为细胞粘附分子-1(1CAM-1);EB病毒的受体为补体受体-2(CR-2)。病毒吸附也受离子强度、pH、温度等环境条件的影响。研究病毒的吸附过程对了解受体组成、功能、致病机理以及探讨抗病毒治疗有重要意义。
二、穿入
穿入(Penetration)是指病毒核酸或感染性核衣壳穿过细胞进入胞浆,开始病毒感染的细胞内期。主要有三种方式:(1)融合 (Fusion),在细胞膜表面病毒囊膜与细胞膜融合,病毒的核衣壳进入胞浆。副粘病毒以融合方式进入,如麻疹病毒、腮腺炎病毒囊膜上有融合蛋白,带有一段疏水氨基酸,介导细胞膜与病毒囊膜的融合。(2)胞饮 (Viropexis),由于细胞膜内陷整个病毒被吞饮入胞内形成囊泡。胞饮是病毒穿入的常见方式,也是哺乳动物细胞本身具有一种摄取各种营养物质和激素的方式。当病毒与受体结合后,在细胞膜的特殊区域与病毒病毒一起内陷形成膜性囊泡,此时病毒在胞浆中仍被胞膜覆盖。某些囊膜病毒,如流感病毒借助病毒的血凝素(HA)完成脂膜间的融合,囊泡内低Ph环境使HA蛋白的三维结构发生变化,从而介导病毒囊膜与囊泡膜的融合,病毒核衣壳进入胞浆。(3)直接进入,某些无囊膜病毒,如脊髓灰质炎病毒与受体接角后,衣壳蛋白的多肽构形发生变化并对蛋白水解酶敏感,病毒核酸可直接穿越细胞膜到细胞浆中,而大部分蛋白衣壳仍留在胞膜外,这种进入的方式较为少见。
三、脱壳
穿入和脱壳是边续的过程,失去病毒体的完整性被称为“脱壳 (Uncoating)”。人脱壳到出现新的感染病毒之间叫“隐蔽期”。经胞饮进入细胞的病毒,衣壳可被吞噬体中的溶酶体酶降解而去除。有的病毒,如脊髓灰质炎病毒,在吸附穿入细胞的过程中病毒的RNA释放到胞浆中。而痘苗病毒当其复杂的核心结构进入胞浆中后,随之病毒体多聚酶活化,合成病毒脱壳所需要的酶,完成脱壳。
四、生物合成
DNA病毒的RNA病毒在复制的生化方面有区别,但复制的结果都是合成核酸分子和蛋白质衣壳,然后装配成新的有感染性的病毒。一个复制周期大约需6~8小时。
(一)双股DNA病毒的复制
多数DNA病毒为双股DNA。
双股DNA病毒,如单纯疹病毒和腺病毒在宿主细胞核内的RNA聚合酶作用下,从病毒DNA上转录病毒mRNA,然后转移到胞浆核糖体上,指导合成蛋白质。而痘苗病毒本身含有RNA聚合酶,它可在胞浆中转录mRNA。mRNA有二种:早期m RNA,主要合成复制病毒DNA所需的酶,如依赖DNA的DNA聚合酶,脱氧胸腺嘧啶激酶等,称为早期蛋白;晚期mRNA ,在病毒DNA复制之后出现,主要指导合成病毒的结构蛋白,称为晚期蛋白。
子代病毒DNA的合成是以亲代DNA为模板,按核酸半保留形式复制子代双股DNA。DNA复制出现在结构蛋白合成之前。
(二)单股RNA病毒的复制
RNA病毒核酸多为单股,病毒全部遗传信息均含在RNA中。根据病毒核酸的极性,将RNA病毒分为二组:病毒RNA的硷基序列与mRNA完全相同者,称为正链RNA病毒。这种病毒RNA可直接起病毒mRNA的作用,附着到宿主细胞核糖体上,翻译出病毒蛋白。从正链RNA病毒颗粒中提取出RNA,并注入适宜的细胞时证明有感染性;病毒RNA硷基序列与mRNA互补者,称为负链RNA病毒。负链RNA病毒的颗粒中含有依赖RNA的RNA多聚酶,可催化合成互补链,成为病毒mRNA,翻译病毒蛋白。从负链RNA病毒颗粒中提取出的RNA,因提取过程损坏了这种酶,从而无感染性。
1.正链RNA病毒的复制 以脊髓灰质炎病毒为例,侵入的RNA直接附着于宿主细胞核糖体上,翻译出大分子蛋白,并迅速被蛋白水解酶降解为结构蛋白和非结构蛋白,如依赖RNA的RNA聚合酶。在这种酶的作用下,以亲代RNA为模板形成一双链结构,称“复制型(Replicative form)”。再从互补的负链复制出多股子代正链RNA,这种由一条完整的负链和正在生长中的多股正链组成的结构,秒“复制中间体(Replicative intermediate) ”。新的子代RNA分子在复制环中有三种功能:(1)为进一步合成复制型起模板作用;(2)继续起mRNA作用;(3)构成感染性病毒RNA。
2.负链RNA病毒的复制 流感病毒、副流感病毒、狂犬病毒和腮腺炎病毒等有囊膜病毒属于这一范畴。病毒体中含有RNA的RNA聚合酶,从侵入链转录出mRNA,翻译出病毒结构蛋白和酶,同时又可做为模板,在依赖RNA的RNA聚合酶作用下合成子代负链RNA。
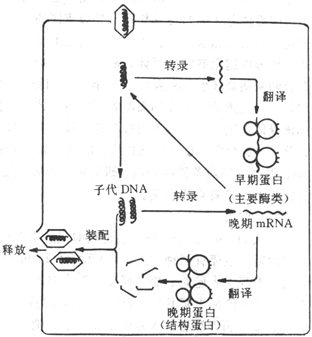
图21-4 DNA病毒复制的主要步骤
(三)逆转录病毒的复制
逆转录病毒(Retrovirus)又称RNA肿瘤病毒 (Oncornavirus) ,病毒体含有单股正链RNA、依赖RNA的DNA多聚酶(逆转录酶)和 tRNA。其复制过程分二个阶段:第一阶段,病毒核时进入胞浆后,以RNA为模板,在依赖RNA的DNA多聚酶和tRNA引物的作用下,合成负链DNA(即RNA:DNA),正链RNA被降解,进而以负链DNA为模板形成双股DNA(即DNA:DNA),转入细胞核内,整合成宿主DNA中,成为前病毒。第二阶段,前病毒DNA转录出病毒mRNA,翻译出病毒蛋白质。同样从前病毒DNA转录出病毒RNA,在胞浆内装配,以出芽方式释放。被感染的细胞仍持续分裂将前病毒传递至子代细胞。
(四)病毒蛋白的合成与修饰
病毒mRNA在宿主细胞聚核糖体上翻译合成病毒结构蛋白和非结构蛋白,结构蛋白是病毒结构的组成成分,非结构蛋白虽然不是病毒的结构成分,但是在病毒复制中具有重要功能,大多是一些催化、调节病毒复制的酶类和调控蛋白。
通常动物病毒mRNA仅翻译一条连续的完整的病毒多肽链,这种mRNA叫做单顺反子mRNA (Monocistronic mRNA) 。分段基因级病毒,如流感病毒,核酸分为8个节段,每一节段转录一条mRNA,翻译一种病毒蛋白。有的病毒,如脊髓灰质炎病毒,病毒RNA本身做为,mRNA,首先翻译出一大分子蛋白,然后在特殊位点被细胞或病毒蛋白水解酶裂解为许多小分子病毒蛋白,包括结构蛋白和非结构蛋白。也有的病毒,如披膜病毒,基因组上有多处转录起始和终止码,分别转录出单顺反子mRNA并合成各自的病毒蛋白。DNA的转录发生在细胞核内,转录产物经剪切拼接,并在3'端聚腺苷酸化,5'端加上甲基化帽,转送入胞浆,合成病毒蛋白。
某些病毒蛋白合成后需要修饰,如磷酸化、糖基化等。由病毒和细胞的蛋白激酶完成磷酸化,这是活化或灭活某些蛋白的一种方式。病毒糖蛋白是在胞浆中与膜相连的核糖体上合成,经粗面内质网、平滑内质网、高尔基氏体到达细胞膜,在此过程中被糖基化。
五、装配与释放
新合成的病毒核酸和病毒结构蛋白在感染细胞内组合成病毒颗粒的过程称为装配(Assembly),而从细胞内转移到细胞外的过程为释放(Release)。大多数DNA病毒,在核内复制DNA,在胞浆内合成蛋白质,转入核内装配成熟。而痘苗病毒其全部成份及装配均在胞浆内完成。RNA病毒多在胞浆内复制核酸及合成蛋白。感染后6个小时,一个细胞可产生多达10,000个病毒颗粒。
病毒装配成熟后释放的方式有:(1)宿主细胞裂解,病毒释放到周围环境中,见于无囊膜病毒,如腺病毒、脊髓灰质炎病毒等;(2)以出芽的方式释放,见于有囊膜病毒,如疱疹病毒在核膜上获得囊膜,流感病毒在细胞膜上获得囊膜而成熟,然后以出芽方式释放出成熟病毒。也可通过细胞间桥或细胞融合邻近的细胞。

图21-5 正链RNA病毒复制的主要步骤
病毒的增殖不只是产生有感染性的子代,绝大多数动物病毒在大量感染的情况下,经多次增殖会产生缺损干扰颗粒(Defective interfering particles),它是能干扰亲代病毒复制的缺损病毒,其核酸有部分缺损或被宿主DNA片段替换。缺损干扰颗粒的基本特性是:(1)本身不能繁殖;(2)有辅助病毒存在时方能增殖;(3)干扰同种病毒而不干扰异种病毒的增殖;(4)在感染细胞内与亲代病毒竞争性增殖。由于缺损干扰颗粒的产生,使同种感染性病毒数量减少,在导致病毒的持续性感染中具有一定的作用,但疫苗中含有大量缺损干扰颗粒会影响活疫苗的免疫效果。

图21-6 负链RNA病毒复制的主要步骤
校对时间:99-11-24 11:40 何娟迎
, http://www.100md.com