第二节 中毒机理
神经性毒剂对机体的作用主要有三个方面:一是选择性抑制胆碱酯酶活性,使乙酰胆碱(Ach)在体内蓄积,引起胆碱能神经系统功能紊乱;二是毒剂作用于胆碱能受体;三是毒剂对非胆碱能神经系统的作用。
一、对胆碱酯酶的抑制作用
胆碱酯酶根据其水解基质的专一性和速度不同分真性胆碱酯酶和假性胆碱酯酶,前者又称乙酰胆碱酯酶(AchE),后者包括丁酰胆碱酯酶(BuchE)和丙酰胆碱酯酶(PrchE)。
真性胆碱酯酶与胆碱能神经的生理功能极为密切。它主要存在于神经细胞、神经肌肉接头、红细胞及电鱼的电器官等部位。其生理功能是,当神经冲动到达胆碱能神经末梢时,突触小泡内的Ach外排至突触间隙,作用于突触后膜的胆碱能受体,引起下一级神经元或效应器的激发。在正常生理条件下,Ach完成传递冲动作用后,随即被突触后膜上的AchE在数毫秒内水解,生成乙酸和胆碱。此一水解过程分两步进行:即与Ach形成乙酰酶,然后乙酰酶脱乙酰基,酶恢复原有活性。
乙酰胆碱酯酶的活性状态是维持神经系统正常功能的重要条件,当AchE活性受到抑制时,就会导致一系列的神经功能紊乱。
(一)神经性毒剂对AchE的抑制机理
神经性毒剂特别是V类毒剂,对AchE的抑制作用与酶催化水解Ach的过程非常相似,神经性毒剂分子中含有亲电子的正磷原子(Pδ+),它与Ach分子中的正碳原子(Cδ+)同样具有亲电子性质。但神经性毒剂的亲电子能力此Ach强,这是因为毒剂分子中,P=O和P-F键上的O、F原子相对电负性比P原子大得多(相对电负性P=2.1,O=3.5,F=4.0,C&S=2.5)。因此,相对电负性大的O、F原子吸收电子成为负极,使P成为低电子密度的正极,即P原子带有较多的正电荷和更强的亲电子能力。所以神经性毒剂对AchE有更大的亲和力和抑制力。
神经性毒剂抑制AchE的过程如图12-2所示,G类毒剂的离开基团是短链的酸性基团F或-CN,无胆碱类似结构。因此,G类毒剂与AchE的结合不涉及负性部位。由毒剂分子中亲电子的正磷原子与被活化的丝氨酸羟基氧原子以共价键相结合,同时酯解部位的酸基提供一个质子(H+)给离开基团-F或-CN,并使之脱落,从而形成稳定的膦酰酶(phosphorylated enzyme),此一过程称酶的膦酰化(phosphorylation),见图12-2A。

图12-2 神经性毒剂与AchE作用示意图
V类毒剂抑制AchE的过程与酶对Ach的作用非常相似。V类毒剂的离开的基团近似于Ach中的胆碱部分,依靠疏水性吸附和(或)静电引力与负性部位结合,毒剂的磷酰基与酯解部位结合,在羧基和碱基协同作用下,P-S键断裂,Pδ+与丝氨酸Oδ+形成共价键,产生稳定的膦酰酶(图12-2B)。
G类和V类神经毒与AchE结合形成的膦酰酶非常稳定,一般无自发水解作用。故称此类毒剂为不可逆性胆碱酯酶抑制剂。
另一类药物,如氨基甲酸酯类化合物的新斯的明、吡啶斯的明、毒扁豆碱等为可逆性胆碱酯酶抑制剂,分子结构中均含一氨基甲酰基和一季铵氮(毒扁豆碱为叔胺)。与酶作用时,首先氨基甲酸酯中的季铵氮阳离子头定位于酶的负性部位,氨基甲酰基则与酯解部位中的丝氨酸羟基氧结合,酯键断裂后形成氨基甲酰酶(carbamylated enzyme)。此一过程称酶的氨基甲酰化(carbamylation)。酶氨基甲酰化后即阻止乙酰化酶的形成,因此它也能使AchE失去水解Ach的能力,从而呈现一定的毒性作用。不过氨基甲酰酶可以自发水解,脱去氨基甲酰基后,酶即自行恢复。因此,当体内一部分AchE氨基甲酰化后,酶即被“保护”起来,从而避免神经性毒剂对它的攻击。这就是氨基甲酸酯类药物用着酶保护剂的基本原理。
综上所述,膦酰酶、氨基甲酰酶和乙酰酶三种酰化酶自动恢复酶活性的速度完全不同。膦酰酶是酰化酶中自动恢复活性最慢的一种,氨基甲酰酶次之,乙酰酶最快。这三种酰化酶自发半活性恢复期(t1/2)分别为:数小时至数天;数分钟;数毫秒。
由此可见,神经性毒剂严重中毒时,依靠酶活性的自动恢复很难解救严重中毒的病人。
(二)膦酰酶的转归
神经性毒剂与AchE形成的膦酰酶并非是完全不可逆的,也不是反应的终止。随着时间和条件的改变,膦酰酶可以继续发生质和量的变化。这些变化有:酶活性的自动恢复;酶老化和在重活化的剂的作用下发生重活化(图12-3)。
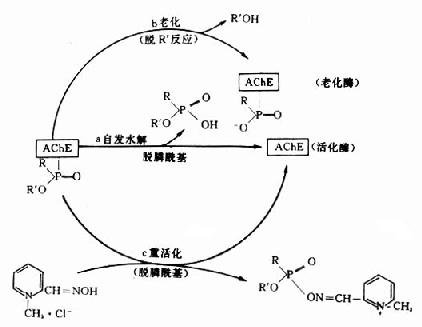
图12-3 膦酰酶的转归
1.自动恢复酶活性:酶活性的自动恢复是由弱亲核试剂水分子的阴离子OH-与膦酰酶中膦酰基的Pδ+发生亲核反应,使酶与膦酰基间的共价键断裂,从而使膦酰基从酶分子上水解下来(图12-3a)。根据毒剂结构不同,各种神经性毒剂与酶形成的膦酰酶,其自动恢复速率有很大差别。有的恢复较快(如VX),有的恢复较慢(如GB),有的几乎不能恢复(如GD)。
2.膦酰酶老化:膦酰酶经一定时间后,烷氧基上的烷基(R')发生脱落,即脱落烷基反应(deakylation)。脱落R'后的膦酰酶就失去了重活化的能力。中毒酶从能被重活化的状态转变为不能被重活化的状态,这一过程叫酶“老化”(aging)。老化的实质是中毒酶负性部位带质子的酸(H+)和膦酰氧形成氨键,促使烷氧键(R'-O)断裂,于是烷基(R')脱落(图12-3b)。
不同中毒酶的老化速度取决于毒剂的种类。梭曼中毒酶老化速度最快,而且几乎无自动恢复现象;VX中毒酶不仅自动恢复快,老化也很慢(表12-4),这主要与毒剂的烷氧基结构有关(烷氧基的α及β碳原子无取代基,不易老化,如VX中毒酶;被甲基取代后则易老化,如沙林中毒酶;甲基数愈多,老化愈快,如梭曼中毒酶)。
表12-4 神经性毒剂中毒酶的自动恢复和老化速度*
| )与带负电的肟基具有相互排斥作用,进一步影响肟基与P原子的结合。
梭曼的烷氧基较大,能遮盖酶的负性部位,造成空间障碍。在使用酶重活化剂时,硕大的烷氧基能阻碍重活化剂与酶的负性部位结合,这也是梭曼中毒酶难以重活化和重活化剂对梭曼中毒疗效较差的原因之一。 3.膦酰酶重活化:应用重活化的剂使膦酰基从酶的结合部脱落下来,恢复酶活性已得到实际应用。目前常用的重活化剂多为肟类化合物(oximes),如氯磷定、双复磷、甲磺磷定、双磷定等。其分子结构中均含有肟基和季铵氮,它们能大大加速脱膦酰基反应的速度,加速酶的活性恢复(图12-3c、图12-4)。反应原理是:
图12-4 氯磷定对中毒酶重活化示意图 (1)首先,肟类药物(如氯磷定)分子中季铵氮借静电引力结合在酶的负性部位,从而使整个分子固定在最有利于向Pδ+原子攻击的位置图(12-4a)。 (2)氯磷定与毒剂残基形成中间复合物图(12-4b)。 (3)负性肟基(=NO-)对中毒酶的Pδ+原子进行亲核性攻击,形成膦酰肟并离开酶的活性表面,于是酶恢复为原来状态。(图12-4c)。 应当知道,同一种重活化剂对不同中毒酶的重活化作用强度不同的,不同的重活化剂对同一中毒酶重活化作用的相对强度也不一样。例如氯磷定对沙林中毒酶的重活化率高于对塔崩中毒酶的重活化率;双复磷对塔崩中毒酶的重活化效果优于氯磷定。 综上所述,神经性毒剂能使AchE失去水解Ach的能力。在突触部位,AchE的抑制,引起突触后Ach的蓄积和对受体的持续作用是导致胆碱能神经系统功能紊乱的重要原因。动物实验和临床中毒病人中均已证明有机磷毒剂中毒时,血液和脑组织中Ach含量均有升高,而且AchE抑制程度、Ach含量增加与中毒剂量有着平行关系。重活化剂可使酶的活性重新恢复,但在实际应用时要注意不同中毒酶的老化速度和对不同毒剂中毒采用不同的重活化剂,参见表12-5。 表12-5 几种肟类重活化剂的抗毒效果比效
|
