第四十四章 药物制剂的称定性
一、概述
药物制剂的稳定性问题可以归纳为以下三方面。
(一)化学方面药物与药物之间或药物与溶剂。附加剂,形剂、容器、外界物质(空气、光线、水分等)杂质(夹杂在药物或附加剂等之中的金属离子、中间体、副产物等)产生化学反应反而导致药剂的分解。
(二)物理学方面例如乳剂的乳析、分裂、混悬剂中颗粒的结块或粗化,某些散剂的共熔,芳香水剂中挥发性油挥发逸散、片剂在贮藏中崩解性能的改变,浸出制剂的发等使药剂的原有质量变差甚至不合,医药使用要求。一般而言,物理方面的不稳定性部问题仅是药物的物理性质改变,但药物的化学结构不变。
(三)生物学方面由于微生物的滋长,引起药剂发霉、腐败或分解。由于上述原因,往往引起下列一种或向种后果:①产生有毒物质。一旦发现这种情况,药剂就应停止使用;②使药剂疗效减低或副作用增加。这种情况比较多见;③病人使用不变,如混悬剂中的药物沉淀成硬饼状,使用时不仅不便而且可能造成每次剂量不准确;④有时虽然药物分解的理极少,药剂的药疗效,含量、毒性等可能改变不显著,但因为产生较深的颜色或少量的微细沉淀(例如注射液),因而不能供药用。本章主要讨论药物水溶液的由于化学变化不稳定性及其克服的方法。,对化学动力在药物制剂稳定性试验中的应用,也作了初步介绍。有些无机药物水溶液的稳定性也很差(如漂白粉、碘化、过氧化氢等),但反应比较简单,常用的制剂也不多,所以本章中不予叙述。
二、化学动力学概述
药物一定的速度进行分解是药物化学本性的反映,分解反应的速度决定于反应物的浓度,湿度、PH、催化剂等条件。用化学动力学的方法可以测定药物分解的速度,预测药物的有效期和了解影响反应的因素,从而可采取有效措施,防止或减缓药物的分解,制备安全有效,稳定性好的制剂。现将与药物稳定性有关的化学动力学基本概念。简要地加以介绍。
(1)反应速度反应速度用单位时间内反应物浓度的减少或生成物浓度的增加来表示。假设开始反应物的浓度a(克分子/升)经历了t时间以后反应了x(克分子/升),则反应速度可用下式表示:-d(a-x)/dt或dx/dt。
(2)反应级数反应级数阐明反应速度与反应物的联系,它是由实验求出的数值。学完全了解化学反应的机理,也可以求出反应级数。对于大多数药物,即使它们的反应过程或机理十分复杂,但可以用零级、一级、伪一级、二级反应等来处理。
(3)半衰期化学反应的速度也可以用半衰期来表示。半衰期(t1/2)是药物分解一半所需进间,通常定于反应物开始浓度和反应速度常数(表44-1)。
表44-1反应速度方程式和半衰期方程
| 级数 |
反应速度方程式(积分式) |
半衰期方程式 |
| 零 |
X=kt |
t1/2=a/2k |
| 1 |
Log(a/(a-x)=kt/2.303 |
t1/2=0.695/k |
| 2 |
X/a(a-x)=kt |
t1/2=1/ak |
| (当反应物A和B的初浓度相等时) |
上表中,a=药物的初浓度t=反应的时间x=时间内药物耗支的浓度k=反应速度常数
三、影响化学反应速度的其它因素
除前节所讲的浓度以外,还有其它因素可以影响化学反应的速度,例如温度、催化剂,水份、光线等。
(一)湿度根据平常粗糙的说法,对于多数反应,湿度每升高10℃,反应速度增加2-3倍。虽然这对某些药物来说可能是相当准确的,但不能普遍适用,因为有些反应在10℃范围的变化却很迅速,以致用一般分析方法无测定。绝大多数反应速度随温度的升高而增加,这个基本概念很是重要,例如注射液在加热灭菌或在热带地区制备或贮藏制剂,或用加热方法促使固体药物溶解等过程中,都必须充分考虑到湿度对药物稳定性的影响。对热很敏感的药物某些生物制剂(例如胰岛素、增压素;催产素等注射剂及血清、疫苗等)和抗菌素等,更应避免加热,通常应贮藏于冰箱中。也有个别药物,湿度降低,分解速度增加。例如15℃以下甲醛的聚合反应速度比室温时增加。
(二)水份水常是化学反应式的必要媒介,在多数反应,没有水,反应的就不会进行。有些化学稳定性差的固体药物例如如阿匹林、青霉素G钾(钠)盐、氯化乙酰胆碱、硫酸亚铁等,颗粒表面吸附了水份以后,虽然仍是疏散的粉末,但在固体表面形成了肉眼不易觉察的液膜,分解反应就在这液膜中进行。
(三)特殊酸-碱催化与一般酸-碱催化很多药物的分解反应可被H功OH催休的反应称为特殊酸碱催化.除了H功OH以外,某些药物的分解也可广义的酸碱,即属于Bronsted-Lowry酸碱理论的一切酸或碱所催化,此称为一般酸碱催化。常用的缓冲盐如醋酸盐。枸橡橼酸盐、硼酸盐均属Bronsted-Lowry理论的酸或碱,可催化某些药物分解,例如磷酸、磷酸盐对青霉素G盐、醋酸、枸橼酸盐、HPO对氯霉催化分解,要肯定一个药物是否被所用的缓冲所催化,首先应保持离子强度不变而改变缓冲盐的浓度(但缓冲盐的比例应不变,以免引起PH值改变)不同浓度的缓冲盐如对药物分解有,则可以为此分解反应可被一般酸碱催化,为了减少这种催化作用的影响,缓冲盐应保持在尽可能低的浓度。
(四)光线光和热一样,可以提供产生化学反应所必须的活化能。要使分子活化,必须有适当频率和足够能量原辐射线被吸收。辐射能量单位称光子,光子的能量相当于一个量子。光子的能量与吸收到的辐射能的频率成正比波长成反比,所以光线的波长愈短,则每克分子药物吸收到的能量就愈大。药物制剂的光化分解通常是由于吸收了太阳光中的紫光和紫外光引起。某些药物的氧化一还原,环重排或环改变,联合、水解等反应,在特殊波长的沈线作用下都可能发生或加速,例如亚硝酸戊酯的水解。吗啡,可待因、奎宁氧化、挥发油的聚合。光化反应与湿度无关,但当一个分子吸收了一个量子的辐射能以后,就和其它分子碰撞,系统中的湿度因而升高。这样原先是一个光化反应接续着的是热反应表44-2。
表44-2各种小长光线的能量
| 波长 |
颜色区域 |
能量(千焦/克分子) |
| 700 |
红 |
171.6 |
| 600 |
黄一橙 |
200.9 |
| 500 |
蓝一绿 |
238.6 |
| 400 |
紫 |
297.2 |
| 300 |
紫外 |
357.7 |
药物对光线是否敏感,主要与药物的化学结构有关,酚类药物(例如苯酚、肾上腺素、吗嘻等)和分子中有双键的药物(例如维生素A、D、维生素B12、中酸、利血平等)对光线都很敏感。含卤的药物如碘化、碘仿、氯仿、三氯乙烯等,在光线的影响下,也易分为质。光反应比分解应要复杂得多,国为光的强度、波长、容器的种类及其形状,大小和厚薄、样吕和光线的距离等条件,都可以显著影响光化反庆的速度。光化反应往往伴随反应。一旦热反应进行时,即使光照停止,反应仍可继续下去。光化反应可能是零级、一级或二级反应。由于光化反应的复杂性,药物称定性在这方面的研究一般只是定性的。维生素B在P3.5-6.5的溶液中,在光的下可生成羟基B12及氰化物,这是可逆反庆。羟基B12的活性低于B12并易于进一步分解为无生理活性的物质:
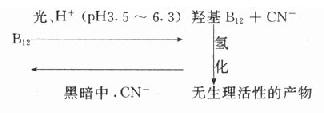
B12的中性溶液,在散射阳光照射下(强度约为100流明/平方米或3000流明/平方米)分解反太不显著。直接曝晒于8000流明/平方米的阳光下,B12每半小时损失效价约10%。光线的波长为600-700nm时,维生素B12不产生分解反应。为了减少光线对药物稳定性的影响,应采用棕色玻璃瓶包装,瓶壁应有一定厚度。壁薄的棕色瓶效果较差。对光敏感的注,在到时候生产和贮藏过程中都应避光。
(五)离子强度离子强度对药物分解,可用下式说明:

(六)辐射电离辐射是药物制剂特别是对热敏感的药物制剂灭菌的一种方法,但辐射可以药物的分解将抗菌素药物如硫酸多粘菌素、硫链霉素生物碱药物如硫酸阿托品、甾族药物如黄体、磺胺类药物,生化制剂如黄体酮、碘胺类药物,生化制剂如胰岛素,肝素、均60Co作γ射线的辐射源,在2.5兆拉德(Mrad)(灭菌制剂)以及25兆拉德照射下,结果和药物分解的量互不相同。
四、制剂中药物的化学分解与稳定方法
药物在制剂中的化学分解有氧化,水解异构化、脱羧、裂环或环重排,聚合等分解途径,其中以氧化和水解最为常见。
(一)水解反应引起的药物稳定性水解反应可分为离子型水解和分子型水解两大类,离了型水解是强酸一弱碱型盐或强碱一弱酸盐等具有离子键的药物与水的瞬时反应速度一般比较缓慢,在H+或OH-催化下,反庆加速并趋于完全。分子型水引起分子结构的断裂,可使药物失效或减效。例如(用通式表示)
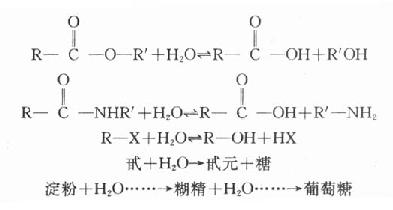
1.酯类药物的分解;很多含有酯的药物,在溶液中容易被水解生成有机羧酸和醇的混俣物。这种水解主要是碳原子和氧原子之间即酰一氧键之间的共价键的。虽然个别酯类(主要是低分子量的伯醇酯类药物)在单纯的水中也能产生明显的水解,但大多数酯类药物需要H、OH或方义的酯一碱或某种酶(例如水解酶)的催化下才能加速其反庆,使反太进行完全。酯的酸或碱催化水解的动力学方程式通式:
d[酯]/dt=-k[酯][H+]
d[酯]/dt=-k[酯]O[H-]
故为二级反应。但如[H-]或[OH+]>>[酯],或用缓冲盐保持[H-]或[OH+]于几乎不变,则:d[酯]/dt=-k[酯][酯]故为伪一级反应。酯的水解常为一级或伪一级动力学反庆但有时是二级反应。琥珀酰氯化胆碱较氯化乙酰胆碱稳定,注射液(PH3-5)可以98-1000,30分钟灭菌粉剂安瓿为宜。琥珀酰氯化胆碱溶液在PH3.7左右时最为稳定,在P0.9-8.5不解反应是一级反应,反应速度常数可用嗵式K=1.36×10”exp(-17230/RT)计算。本品水解酸一碱催化,例如醋酸盐缓冲液(600,离子强度=0.2,PH=4.69,3.98)分解为二级反应,反应速度数为5×10(升
/克分子小时)。故该注射液不应含有缓冲剂;。羧酸酯(R-C-OR)的水解程度与R的结构关系很大,R基愈大或碳上的烷基或其他基团占据的间愈大,则阻碍H或OH对酯寒攻的作用愈大,故该酯尖药物愈不易被水解所以溴本辛、普鲁本辛就比较稳定,但要制成可以以久使用的水溶液还是困难的,制成片剂时水分也应注意,普鲁本辛片剂的水份如果超过3%,贮藏一年以后咕吨酸的含量将超过药典规定(>2%)。
2.酰胺类药物的水解本类药物比相应的酯类药物可稳定,例如盐普鲁卡因胺比盐酸普鲁卡因要稳定。但有些酰胺药物,由于结构上的特殊原因。也比较容易被水解。现举常见的几种药物为例子以说明:①青霉素类药物:青霉素类药物分屯结构中的B内酰胺环是四节环,内部存在张力,在H、OH影响下易于裂环而失效。例如青霉素G钾,水溶液室温贮藏7天,效从下降80%左右,因此只能制成灭粉针安瓿。根据实验青霉素G钾在PH6.5时最稳定。用枸椽酸盐缓冲液(PH6.5)制成的溶液至多也只能用三天。PH2,24℃时的半衰期仅18.5分钟,故不可口服。②巴比妥类钠:巴比妥类是六节不的酰胺类药物,不易水.在溶解度小,通常用钠盐作注射液可被空气中的CO2作巴比妥类分子结构中的亚酰基酸的性比碳酸还弱,故其钠墁溶液可空气中的CO2作用生成巴比肝的沉淀,故灭菌粉针宜用无CO2的注射用水溶解。钠盐水溶液(灌注于安瓿中,无CO2)在加温(灭菌时的湿度)或室温贮藏一个朋,约有22%分解。用60%的丙的二醇为溶剂电的注射泫则甚为稳定,至少可用一年。③氯霉素:氯霉素的化学性质比较,干燥粉末闭密保存二年,其抗菌效力几乎不变。溶液(水中溶解度:1:400)煮沸五小时,效价几首无显著变化。在显著碱性(PH>8)时或酸性时水解较。氯霉在PH=6时最稳定.盐,枸橼酸及其缓冲液可促使氯霉素水解(一般酸一碱催化)。本品滴眼液通常用硼酸一硼酸钠缓冲液(PH约7),室温使用期为三个朋,贮藏于2-8中为17个月。氯霉素在PH17的上缓冲液的分解服从一级反应。国内药厂生产氯霉素滴眼液采用增加设料量的方法,但使用仍不到一年。硼砂可增加氯霉素的溶解度(可能是硼与氯霉素分子中两个羟基形成了络合盐),过去常认为硼砂可增加氯霉素的稳定性,其实不然。
3.延缓药物水解速度的方法①调节PH:以上许多实例说明药物的水解速度与溶液的PH直接有关。在较低的PH值范围内,以H-催化为主,在较高PH范围时以OH+论为主,在中间的PH范围,水解反庆能与PH无关或由H-或OH共同催化。为了肯定P具体药物水解的可以测定几个P药物的水解情况,用反应速度常数K的对数对PH作图,从贡线的最低点(转折点)可求出该药物最稳定时的PH值。实验可在料高的湿度(恒温)下进行,以但在较短的时间内取得结果。这样得到转折点以温时得到的有些不同但通常不大,可以用酸或碱缓冲溶液被所用的缓冲盐所催化(一般酸一碱催化),则级盐应保值最低的浓度。②选用适当的溶剂:用介电常数较低的溶剂如乙醇、甘油,丙二醇、聚乙烯二醇、N,N一甲基乙酰等部分或全瓿代替水作为溶剂,可使药物的水解速度降低。但是对于个别药物却是例外,如环乙酸(C-yclamicacid)在水溶液中水解慢,在乙醇液中却显著变快。氯霉素在50%二醇溶液的水解速度也稍有增加。因此对具体药物应通过实验才能得出符合的结论。③制成维溶性盐或酯:一般而言,溶液中溶解的那部分药物才水解反应。将容易水解的药物制成难溶性的酯类衍生物,其稳定性将显著增加。水溶性愈低往往愈稳定。例如青素G钾盐、在水中溶解的而破坏已如前述,只是普鲁卡因青霉素G(水中溶解度为1:250)就7较稳定,其混悬液中鐾光并低于20处贮藏,可以保持效价至少18个月。三乙酰竹桃霉素(Friacetyloleandomycinum)。红霉素硬脂酸酯等维溶性药物,不仅化学稳定性优于母体药物,而且无味、耐胃酸;口服后比母体药物更好。④形成络合物:加入一种化合物,使它与药物形成水中可溶并且对药物有保护作用的络合物,这络合物所以对药物有保护作用可能有空间障碍和极性效庆二种原因。⑤加入表面活性剂:在脂或酰类药物[溶液中加入适当表面活性剂,有时可以增加某些药物的稳定性,例如苯佐卡因含5%月桂酥醇硫酸钠(阴离子型表面活性剂)的溶液,可使苯佐卡因的半衰期半增中18倍,这可能是月桂醇酸钠与苯佐卡因形成胶团,苯佐卡因藏在胶团内部,减少了OH-对苯佐卡因分子中酯键的攻击。⑥改变药物的分子结构在脂类药物(R-COOR)和酰类药物(R-COOR)的a一碳原了上引入其它基团或侧链或增加R或R’碳逻的长度以增加空间效应可极性效应,可以有效地降低这些药物水解速度。⑦制成固体制剂:将药物制成固体制剂稳定性可以大大提高。⑧控制温度:湿度升高,水解反应速度随之增加。
(二)由于氧化所引起的药物不稳定氧化反应是药物分解失效的重要原因之一。维生素C、吗啡、肾上腺一素、盐酸硫胺等,都是熟知的例子。
1.容易氧化的药物药物氧化分解的结果,使药物失效、颜色变深、颜色变深、形成沉[淀或产生有毒物质(如新胂凡纳明暴露于空气中,易氧化变质,毒性显著增加而不能供药用)。有些注射剂其中药物虽仅极少一部分氧化,但颜色变深,以致可能成为废品。药物的氧化过程比水解不要复杂,往往不易用明反应式完整的表达。本节列举的某些药物的氧化反庆,可能是水解过程中主要的反应。①酚类药物:分子结构中具有酚羟基的药物如肾上腺素、多巴胺、吗啡、水吗啡、水杨酸钠等,在氯金属离子、光线、湿度等的下,均易氧化变质。酚类药物被氧化,大多因为酚羟基变成醌式结构顺而呈黄棕等色。维生素C的分子结构不存在酚羟基,但有醇结构,很易氧化生成一系列有色的无效物质。维生素C的氧化分解已有过广泛、深入的研究,资料累积很大,但它的自氧化反太机理还是很不清楚。在无空气的情况下,维生素C降解后生成糠醛和二氧化碳。糠醛很易氧化,聚合生成有色物质,此可能是本品晶体表面存在黄色的一个原因。空氯中的氧可氧化维生素C为去氢维生素C,中还原剂存在下,后者仍可转变为维生素C。去氢维生素C很不稳定,迅速生成2,3一二酮基古罗酸(钠)等分解物,溶液由于黄色以变为橙红色、维生素C溶液中如果没有金属离子,只在在PH9以上时才不较明显的氧化反应产生,但如有铜离子在,即使PH=6.5,氧化反应极为迅速。铜对维生素C是极强的氧化催化剂,只要2×10-4M/L的浓度,就能使维生素C一价阴离子的氧化反应速度增大10000倍。铁、铝等离子也可使维生素C分解。维生素C溶液最稳定的PH值为5.4。需加焦亚硫酸钠用抗氧剂。溶液通过二氧化碳比通氮好。氯化钠、丙二醇、甘油、蔗糖、螯合剂对维生素C都有稳定作用。②芳胺类药物:如磺胺类钠盐、盐酸普鲁卡因胺、对氨基水杨酸钠等芳午药物,也比较容易氧化。与酚类药物一样,多数芳胺类药物的氧化反应过程都异常杂,很多还不够明了。③其他类型药物:吡唑酮类药物例如氨基比林、安乃近的水溶液,也比较容易氧化,生成黄色。一般认为是吡唑酮环上的不饱和键被氧化。噻类药物如盐酸异丙嗪。盐酸氯丙嗪等,在光、金属离子、氧等作用下,极易氧化变色,注射注0常用焦亚硫钠,维生素C、EDTA-Na2等为稳定剂,以减缓氧化。含有不饱和宾药物,能常也很易氧化例如维生素A、维生素D、油脂,在光线、氧、水份、金属防子以及微生物等影响下,都能产生氧化拓应而分解。挥发油中含有的成分萜烯、蒎烯、氧化后有醛、酮形成,所以有特殊味。萜烯和蒎烯等氧化后尚可聚合生成树脂状物。盐酸硫胺可被空气中的氧氧化生成无效的充色素,但不用亚硫酸为抗氧剂。因后者可使盐胺安全断裂、失效。
2.影响物质氧化速度的因素①有机药物不饱和程度:双键较钦的药物通常均容易氧化。②游离脂肪酸:有机羧酸或醇类药物比它们相应的酯容易产生自氧化反应。③与金属离子:金属特别是二价以上的金属离子Cu++、Fe++、Pb++、Ni++等),可以促进反的,是药物分解的催化剂。④易氧化的药物的物理状态:通常固体脂肪要比液体脂肪不易发生自氧化反应。这可能是氧在固化脂肪中不易扩散的缘故。⑤氧的含量:大多数药物的氧化分解是懈含游离基的自氧化反应。有时仅需痕量的氧就可以引起这种反应。一旦反应进行,氧的含量便不重要了。⑥湿度:一般而言,湿度增加,氧化反应的速度加速。但湿度增加时氧在水中的溶解度减低。
3.延缓药物氧化分解的方法①除去氧气;②加入抗氧剂;③调节PH值。
(三)由于其他反应引起的不稳定性
1.异构化异构化分为光异构化和几何构化二种,前者又分为消旋化和差向异构化。①光学异构化:甲、外消旋化:具有光学活性的药物在溶液中受H+、OH-或其他催化剂及温度等的影响下转变成它的对映体的过程,这个反应过程一直进行到生成等量的二种对映体为止,因此最后得到1/2量的左旋体和1/2量的右旋体混合物,结果这个药物溶液的旋光度等于零。级大多数药物的左旋体的生理活性大于右旋体(泛酸钙和乙胺乙醇例外0,但右旋体往往也有一定的生理活性,故外消旋药物的生理活性一般超过纯粹左旋体的一半多一些。外消旋反应的与否道德决定于不对称碳原子上的联着的基因,不对称碳原子联接有度香或具有苄醇的结构,则外消旋反应较易进行。因此左旋明上腺素和左旋莨蓉碱都容易外消旋化。外消旋反应与OH-、H+等的催化剂、温度、光线等有关。外消旋反庆的学研究,在方法上与水解反庆相似。一般外消旋反应是按一级反就进行的。乙.差向异构化;某些具有多个不对我碳原子的药,其中一个不对儿碳原子上的基因发生立体异构化,称为差向异构化。差向异构化反应达到平衡时,二个差向异构体的是一不盯等,故其光学活性不等于零,这点与外消旋化不同。②几何异构:含有双健的有机药物,顺式几何异柢体与反式向何异构体的生量活性往往是不相同的。维生素A分子中有五个共轭的双键,理论上有16个几何异构体,各异构体的生理活性互有不同,其中以全反式的异构体为最高。在PH较低的水中,可生成Retro维生素A及支水维生素A,前者的生理活性仅为反式维生素A的12%后者则无生理活性。维生素A棕榈酸脂与其他维生素制成的复合维生素混悬剂(助悬剂为吐温-80,PH=5.3),经过一年左右的贮藏以后,除了因氧化而分解外,还有10-―顺式和10,15二顺式二种异构体生成,这两种异构体的生理活性很弱。
2.由于聚合作用而产生的药物变质,二个以上相同的药物分聚合而使药物变质的实例不多,比较熟知的是甲醛溶液中加入可10%-15%甲醇可以减缓其聚合。药物本身由于聚合作用而出现沉淀,变色等现象比较常见。例如葡萄糖注射液热压灭后不少量5-羟甲基呋喃甲醛形成,后者聚合生成有颜色的聚合物,因而使注射液微湿黄色。
3.由于脱反应而引起的分解,由于药物分子结构中的羧基脱裂而引起药物分解的情况,有时可能遇到。对氨基不杨酸钠注射液因为对氮基水杨酸分解,脱去羧基生成间氨基苯酚而易使颜色变深。对氨基水杨酸钠的脱羧反应与溶液的PH很有在系,偏碱性时比稳定,PH6.3开始明显产生脱羧,PH2.7时达最高峰。本品20%溶液三个月,约有2.5因脱羧而分解。1150、30分钟则有15%分解,故本品以制成来菌粉末安瓿为宜。
4.吸收二氧化碳引起的药物分解有些碱性药物,可因吸收空气中的CO2作用失去相应的碳酸盐而改变药物原来的性质。如丙环乙(Propylhexedrinum)是一种有挥发性的液体按类药物,制成吸入剂吸入鼻腔以收缩局部血管,丙环乙胺能吸收空气中的CO2生成碳酸盐而减弱其的挥发性,从而影响其疗效。巴比妥类钠盐溶液遇CO2可能生成巴比妥类沉淀。
5.药物之间互相作用将两种或两种以上药物配合使用,如果不了解药物的理化、药理等方面的性质,不明白药物在临床上的使用要求而盲目的混合使用,往往不但不能达到医疗上的预期目的,而且有时还可能产生不良后果甚至危及患者生命。
五、稳定性试验的方法
为了了解处方是否恰当,制造工艺是否合理,制剂否稳定,或为了药剂的使用期,可以应用化学动力学的原理,进行稳定性试验。在实验时,除了要考察的因素以外,可影响实验准确性的其他因素都应维持不变,否则各种因素掺杂一起,就难以得出确切的结论。在进行药物制剂稳定性试验以前,应选择能区别反应物或分解产物的含量都可以,但是通常选用测定药物的方法,困为分解产物区别反应物或分解产物的含量都可以,但是通过常选用测定药物的方法,因为分解产物常常比较复杂,有时分解产物可能立即再次分解,因而不宜准确测定。含量分析方法应该简便、专一、灵敏度高,现代广泛肛用仪器分析法。
(一)留样观察法。
(二)用化学动力学方法研究药物的稳定性一加速试验性。
(三)药物粉末、片剂、固体药物与辅料的混合物的稳定性试验。
(丁兆梦)
, 百拇医药