第四节 胆红素代谢与黄疸
一、胆红素的来源、生成与运输
(一)胆红素的来源与生成
用14C标记的甘氨酸的示踪试验及其他实验研究的结果表明,胆红素的来源不外以下几种:①大部分胆红素是由衰老红细胞破坏、降解而来,由衰老红细胞中血红蛋白的辅基血红素降解而产生的胆红素的量约占人体胆红素总量的75%;②小部分胆红素来自组织(特别是肝细胞)中非血红蛋白的血红素蛋白质(如细胞色素P450、细胞色素b5、过氧化氢酶等)的血红素辅基的分解;③极小部分胆红素是由造血过程中,骨髓内作为造血原料的血红蛋白或血红素,在未成为成熟细胞成分之前有少量分解,即无效造血所产生的胆红素。
胆红素的生成过程包括:①衰老的红细胞在单核吞噬细胞系统被破坏,首先除去珠蛋白而分离出血红素;②血红素在单核吞噬细胞内微粒体的血红素加氧酶的作用下,将血红素卟啉环氧化断裂,释放出CO和铁,并形成胆绿素,血红素加氧酶存在于肝、脾、骨髓或巨噬细胞等单核吞噬细胞系统细胞中,在微粒体内属混合功能氧化酶,反应需要分子氧参加,并需要NADPH、NADPH-细胞色素P450还原酶共同存在;③胆绿素在胆绿素还原酶催化下生成胆红素Ⅸa,胆绿素还原酶存在于单核吞噬细胞系统细胞内的可溶性部分,以NADPH为辅酶。
在体内从血红素形成胆绿素,继而还原为胆红素,并进一步被结合、排泄,这样复杂的过程总共只需1-2min。胆红素生成过程如图10-1所示。
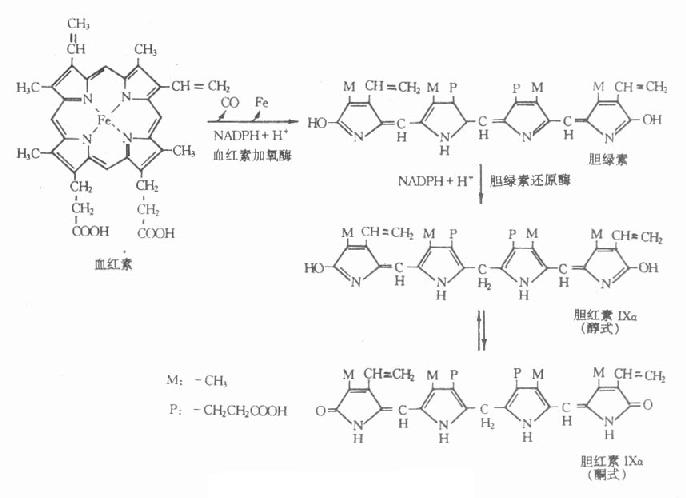
图10-1 胆红素生成过程
(二)胆红素在血液中的运输
在单核吞噬细胞中生成的胆红素可进入血液循环,在血浆内主要以胆红素-白蛋白复合体的形式存在和运输。除白蛋白外,α1-球蛋白也可与胆红素结合。一般说白蛋白与胆红素的结合是可逆的。当血浆胆红素浓度正常时,1分子白蛋白通常结合1分子胆红素,而当血浆胆红素增多时则可结合2分子胆红素。正常成人每100ml血浆中的白蛋白结合胆红素的能力约为20-25mg,所以正常情况下白蛋白结合胆红素的潜力很大。由于胆红素与白蛋白较紧密地结合成复合体,一方面改变了胆红素的脂溶性,另一方面又限制了它自由通过各种生物膜的能力,不致有大量游离胆红素进入组织细胞而产生毒性作用。据报道有一部分胆红素与白蛋白共价结合,可能是白蛋白分子中赖氨酸残基的ε-氨基与胆红素一个丙酸基的羧基形成酰胺键,在血中停滞时间长,称为δ-胆红素。δ-胆红素在肝细胞损伤及胆汁郁滞等高结合胆红素性黄疸时出现,与重氮试剂呈直接反应,可用离子交换柱层析法检测。目前认为δ-胆红素检测的临床意义是:①δ-胆红素与急性黄疸性肝炎的恢复期密切相关,恢复期总胆红素下降,尤其结合胆红素明显降低,而δ-胆红素的相对百分比却显著增高,最后达总胆红素的80%-90%以上,这种表现可作为对急性黄疸性肝炎恢复期观察的可靠指征;②严重肝功不全病人血清中δ-胆红素常小于总胆红素的35%,死前可降至20%以下,患者恢复后δ-胆红素占总胆红素的40%-90%。据此δ-胆红素可作为判断严重肝病预后的指征。
二、肝对胆红素的摄取、转化及排泄
当胆红素随血液运输到肝后,由于肝细胞具有极强的摄取胆红素的能力,故可迅速被肝细胞摄取。肝迅速地选择性地从血浆摄取胆红素的能力与下述机制有关。
⒈位于血窦表面的肝细胞膜上可能有特异的载体蛋白系统,胆红素等有机阴离子与膜上载体结合后,即从膜的外表面转移至内表面,然后进入胞质。当白蛋白-胆红素复合物通过肝窦壁时,胆红素与白蛋白解离,只有胆红素被肝细胞所摄取。
⒉肝细胞内有两种色素受体蛋白即Y蛋白和Z蛋白Y蛋白与胆红素亲和力较高,在肝细胞中含量较大,约占肝细胞浆蛋白的5%,是肝细胞内主要的胆红素载体蛋白;Z蛋白是另一种胆红素载体蛋白,对长链脂肪酸具有很强的亲和力,可能是肝细胞内脂肪酸载体蛋白。Y蛋白与Z蛋白利用其对胆红素的高亲和力,从细胞膜上接受进入胞质的胆红素,并将它运至内质网。
肝细胞对胆红素的转化在滑面内质网上进行。在葡萄糖醛酸基转移酶的催化下,胆红素被转化为葡萄糖醛酸胆红素,胆红素在肝细胞内经结合转化后,其理化性质发生了变化,从极性很低的脂溶性的未结合胆红素变为极性较强的水溶性结合物-葡萄糖醛酸胆红素,从而不易透过生物膜。这样既起到解毒作用,又有利于胆红素从胆道排泄。在肝细胞内,胆红素通过其丙酸基与葡萄糖醛酸结合,主要生成双葡萄糖醛酸胆红素。
结合胆红素被排泄至毛细胆管的过程,有内质网、高尔基复合体、溶酶体等参与,毛细胆管膜上也存在一种以载体为中介的转运过程,这一过程必须对抗浓度梯度。当肝细胞损伤时,可由于结合型胆红素的排泄障碍而造成肝细胞淤滞性黄疸。由于肝细胞内有亲和力强的胆红素载体蛋白及葡萄糖醛酸基转移酶,因而不断地将胆红素摄取、结合、转化及排泄,保证了血浆中的胆红素不断地经肝细胞而被清除(图10-2)。
三、胆红素在肠管中的变化及其肠肝循环
结合胆红素(葡萄糖醛酸胆红素)随胆汁排泄至肠管后,在回肠末端至结肠部位,在肠管菌丛的作用下大部分被水解而脱下葡萄糖醛酸,然后逐步被还原成二氢胆红素、中胆红素、二氢中胆红素、中胆素原、粪胆原及少量d-尿胆原,后三者与重氮试剂的呈色反应相同,统称为胆素原。正常人每天从粪便排出的胆素原为40-280mg,胆素原在肠管下段接触空气后分别被氧化成为尿胆素、粪胆素和d-尿胆素(三者统称为胆素),随粪便排出,成为粪便的主要色素。在小肠下段生成的胆素原约有10%-20%可被肠粘膜重吸收,再经肝门静脉入肝,重吸收入肝的胆素原大部分以原形再排入胆道,构成肠肝循环,小部(每日0.4-4.0mg)经体循环随尿排出。

图10-2 胆色素代谢概况
四、黄疸的发生机制
黄疸是指高胆红素血症引起皮肤、巩膜和粘膜等组织黄染的现象。正常人血清胆红素小于1mg/dl(10mg/L),其中未结合胆红素占80%。当胆红素超过正常范围,但又在2mg/dl以内,肉眼难于察觉,称为隐性黄疸。如胆红素超过2mg/dl(可高达7-8mg/dl)即为显性黄疸。
黄疸按原因可分为溶血性、肝细胞性和梗阻性黄疸;按发病机制可分为胆红素产生过多性、滞留性及反流性黄疸;按病变部位可分为肝前性、肝性和肝后性黄疸;按治疗观点又可分为内科性和外科性黄疸。较为合理的是按血中升高的胆红素的类型分为高未结合胆红素性黄疸及高结合胆红素性黄疸两大类,然后再按病因、发病机制等细分。
黄疸发生的机制如下:
(一)胆红素形成过多
胆红素在体内形成过多,超过肝脏处理胆红素的能力时,大量未结合胆红素即在血中积聚而发生黄疸。未结合型胆红素形成过多的原因包括溶血性与非溶血性两大类。临床上任何原因引起大量溶血时,红细胞破坏释放的大量血红蛋白即成为胆红素的来源。非溶血性的胆红素形成过多则多见于无效造血而产生过多胆红素。
(二)肝细胞处理胆红素的能力下降
这包括:①肝细胞对胆红素的摄取障碍;②肝细胞对胆红素的结合障碍(肝细胞中葡萄糖醛酸基转移酶活性降低);③肝细胞对胆红素的排泄障碍(肝内胆汁淤滞、乙醇性肝炎等)。
(三)胆红素在肝外的排泄障碍,逆流入血而引起黄疸
新生儿生理性黄疸的成因有下述几方面:①新生儿肝细胞内葡萄糖醛酸基转移酶活性不高;②胆红素在新生儿体内产生较多;③新生儿肝细胞内缺乏Y蛋白,故摄取胆红素的能力
也比成人差,这些都可能促使新生儿生理性黄疸的发生。
10-9
| 分类 |
高胆红素血症发生机制 |
临床原因 |
|||
|
高未结合胆红素血症
|
肝前性 |
胆红形成过多 |
溶血性 |
⒈先天性红细胞膜、酶或血红蛋白的遗传性缺陷等 | |
| ⒉获得性、物理因素:严重烫伤等 化学因素:氨基法、硝基苯等 生物因素:败血症、疟疾蛇毒等 免疫因素:血型不合输血等 其他因素:脾功能亢进等 | |||||
| 非溶血性 |
造血系统功能紊乱,如恶性贫血、珠蛋白生成障碍性贫血、铅中毒等引起的无效造血 | ||||
| 肝性
|
肝细胞处理胆红素能力下降 |
胆红素的摄取障碍 |
新生儿生理性黄疸 | ||
|
|
药物(如黄绵马酸)性黄疸 | ||||
|
|
体质性黄疸(轻型慢性间歇性幼年性黄疸) | ||||
| 高结合胆红素血症 |
肝细胞对胆红素排泄障碍 肝细胞混合性机制 |
肝内淤滞性黄疸(如胆汁淤滞性肝炎、妊娠复发性黄疸、药物引起的胆汁淤滞)体质性黄疸(慢性家族性非溶血性黄疸、慢性特发性黄疸)感染、化学试剂、毒物、营养不良、代谢障碍、肿瘤等所致的肝病变 | |||
| ㈠胆红素生成增加 | |||||
| ⒈溶血性黄疸 | |||||
| ⑴新生儿溶血性黄疸(血型不合妊娠) | |||||
| ⑵遗传性异常血红蛋白病:镰状细胞贫血、珠蛋白生成障碍性贫血 | |||||
| ⑶红细胞膜异常症:遗传性球形红细胞症、遗传性椭圆形红细胞症 | |||||
| ⑷先天性红细胞酶异常症:丙酮酸激酶缺损症、葡萄糖-6-磷酸脱氢酶缺损症 | |||||
| ⒉早期胆红素的增加 | |||||
| ⑴原发性早期高胆红素血症 | |||||
| ⑵先天性骨髓性卟啉症 | |||||
| ㈡肝内胆红素处理功能异常 | |||||
| ⒈结合酶活性低 | |||||
| ⑴新生儿高胆红素血症 | |||||
| ⑵肝未成熟迁延性新生儿黄疸 | |||||
| ⑶Grigler-Najjar综合征(肝葡萄糖醛酸基转移酶缺陷) | |||||
| ⒉结合障碍 | |||||
| ⑴哺乳性黄疸:母乳中孕烷3α,20β-二醇对葡萄糖醛酸基转移酶的抑制所引起 | |||||
| ⑵Lucey-Driscoll综合征:孕烷二醇等对葡萄糖醛酸基转移酶的抑制所引起 | |||||
| ⒊肝的摄取机制及向肝细胞内转运障碍 | |||||
| ⑴Gilbert综合征:先天性或家族性葡萄糖醛酸基转移酶活性低下,肝细胞膜的异常或肝细胞内色素结合蛋白的异常,引起胆红素在肝细胞内转运的障碍 | |||||
| ⑵先天性甲状腺功能低下症:肝排泄胆红素功能降低,新生儿黄疸症状长期持续 | |||||
| ⒋胃肠道狭窄或闭锁 | |||||
表10-11 高结合胆红素血症的疾病
| ㈠肝细胞损伤 |
| ⒈乳儿肝炎 |
| ⒉急性肝炎 |
| ⑴病毒性肝炎:血清性肝炎、传染性肝炎、水疱疹性肝炎、先天性风疹 |
| 症候群、卵黄囊-B病毒肝炎、腺病毒感染、巨细胞病毒肝炎等 |
| ⑵细菌感染并发的肝炎、败血症、肺炎、肾盂肾炎 |
| ⑶先天性梅毒 |
| ⑷弓形体病 |
| ⒊慢性肝炎 |
| ⒋肝硬化 |
| ㈡由肝细胞向毛细胆管排泄的异常 |
| ⒈Dubin-Johnson综合征 |
| ⒉Rotor综合征 |
| ㈢肝内胆汁淤滞 |
| ⒈先天性肝内胆管闭锁症 |
| ⒉总胆管性肝炎 |
| ⒊原发性胆汁性肝硬化 |
| ⒋Byler病引起的先天性肝内胆管闭锁 |
| ㈣肝外胆汁淤滞 |
| ⒈肝外胆道闭锁症 |
| ⒉总胆管扩张症 |
| ㈤由先天性代谢异常所引起的非溶血性黄疸 |
| ⒈半乳糖血症 |
| ⒉酪氨酸血症 |
| ⒊α1-抗胰蛋白酶缺乏症 |
| ⒋果糖血症 |
五、黄疸的鉴别试验
⒈高结合胆红素性黄疸与高未结合胆红素性黄疸的鉴别依靠结合胆红素与未结合胆红素的分别定量。高结合胆红素性黄疸血中结合胆红素增高,高未结合胆红素性黄疸时则血中未结合胆红素增高;高结合胆红素性黄疸时尿中胆红素阳性,胆素原视病因而异,可以增加(肝炎)、减少或消失(梗阻);高未结合胆红素性黄疸时,尿中胆红素阴性,尿中胆素原增加。
⒉梗阻与非梗阻性(肝细胞性)高结合胆红素性黄疸的鉴别可联合应用反映胆道梗阻(ALP、LAP、γ-GT、血清总胆固醇、总胆汁酸)及肝细胞损伤(ALT、AST、LDH活性、血清总蛋白及白蛋白定量等)的检验指标来加以鉴别。
⒊肝内淤滞与肝外梗阻性黄疸的鉴别可应用病史、肝功能试验、泼尼松治疗试验、苯巴比妥治疗试验等进行鉴别。对于原发性胆汁性肝硬化,其发病可能与免疫机制有关,胆管的抗原与来自肝门静脉的抗体反应,并与补体结合在胆道被吸附,在胆道壁形成免疫复合物。原发性胆汁性肝硬化血中ALP活性增高,γ-GT及5-核苷酸酶活性增高,IgM增高,抗线粒体抗体阳性。关于肝内性胆汁淤滞与肝外梗阻性黄疸的鉴别见表10-12。
⒋溶血性、肝细胞性及梗阻性黄量的鉴别(见表10-13)。
表10-12 肝内胆汁淤滞与肝外梗阻性黄疸的鉴别
| 肝内胆汁淤滞 |
肝外梗阻性黄疸 | ||
| 症状 |
肝炎样发病 |
常有发热,疼痛 | |
| 血沉 |
正常 |
加快 | |
| 白细胞数 |
正常 |
正常或增加 | |
| 血中胆红素 |
不定 |
一般较高 | |
| 血清ALP(KA单位) |
多在30单位以下 |
30单位以上高值 | |
| 血清胆固醇 |
不定 |
一般较高 | |
| 尿中(靛甙)尿蓝母 |
阴性 |
阳性 | |
| 药物引起 |
常有 |
无 | |
| 对肾上皮质激素的反应 |
常有 |
无 | |
| 胆道造影 |
肝外胆管阻塞 |
(-) |
(+) |
|
|
肝外胆管扩大 |
(-) |
(+) |
|
|
肝内胆管多球状 |
(-) |
(+) |
| 肝活检 |
小叶中心胆汁沉积 |
早期出现 |
早期出现 |
|
|
毛细胆管胆汁沉积 |
(-)晚期出现 |
晚期出现 |
|
|
胆汁栓,″胆汁湖″ |
(-) |
晚期出现 |
| 肝门静脉区浮肿 |
不显著 |
显著 | |
|
|
肝门静脉区粒细胞浸润 |
无 |
显著 |
|
|
嗜酸细胞浸润 |
常有 |
不明显 |
| 胆管扩大 |
(-) |
早期出现 | |
| 肝细胞灶状坏死 |
早期可有发现 |
晚期出现 | |
表10-13 溶血性黄疸、肝细胞性黄疸及梗阻性黄疸的鉴别
| 溶血性黄疸 |
肝细胞性黄疸 |
梗阻性黄疸 | ||
| 胆 |
血浆总胆红素 |
多在5mg/dl |
1-70mg/dl |
不全梗阻10-15mg/dl |
| 红 |
浓度 |
以内 |
完全梗阻20-30mg/dl | |
| 素 |
未结合胆红素 |
高度增加 |
增加 |
增加 |
| 代 |
结合胆红素 |
正常 |
增加 |
高度增加 |
| 谢 |
尿胆红素定性 |
阴性 |
阳性 |
强阳性 |
| 试 |
尿中胆素原 |
增多 |
不定,或升高 |
减少或消失 |
| 验 |
粪中胆素原 |
增多 |
减少 |
减少或消失 |
| 血 |
电泳谱 |
正常 |
Alb减少,γ-球蛋 |
球蛋白明显升高 |
| 清 |
白升高 |
|||
| 蛋 |
||||
| 白 |
脂蛋白X |
阴性 |
一般阴性 |
明显增高 |
| 谷丙转氨酶 |
正常,稍高 |
肝炎急性期增高 |
正常或增高 | |
| 碱性磷酸酶 |
正常 |
正常或轻度增高 |
明显增高 | |
| 亮氨酸氨肽酶 |
正常 |
可增高 |
明显增高 | |
| γ-谷氨酰转肽酶 |
正常 |
可增高 |
明显增高 | |
| 其 | 凝血酶原时间 |
正常 |
延长,不易被维生素K纠正 |
延长,能被维生素K纠正 |
| 胆固醇 |
正常 |
降低,胆固醇酯明显降低 |
增高 | |
| RBC脆性 |
降低 |
正常 |
正常 | |
| 他 | RBC寿命 |
降低 |
正常 |
正常 |
| 网织RBC |
增多 |
正常 |
正常 |
99-12-22 18:23 刘小琴 校对
, 百拇医药参见:首页 > 医疗版 > 疾病专题 > 消化内科 > 其它 > 黄疸