第三节 肾上腺功能紊乱的临床生化
肾上腺是由中心部的髓质和周边部的皮质两个独立的内分泌器官组成。下面将分别讨论肾上腺髓质和皮质的内分泌功能紊乱的临床生化有关内容。
一、肾上腺髓质激素及功能紊乱
㈠肾上腺髓质激素
肾上腺髓质从组织发育学上可看做是节后神经元特化为内分泌细胞(嗜铬细胞)的交感神经节,不同的嗜铬细胞可分别合成释放肾上腺素(epinephrine,E)、去甲肾上腺素(norepinephrine,NE)、多巴胺(dopamine,DA),三者在化学结构上均为儿茶酚胺类。后两者亦为神经递质,但作为递质释放的NE和DA绝大部分又重新被神经末梢及其中的囊泡主动摄取、贮存。肾上腺髓质释放的E约为NE的4倍,仅分泌微量DA,因此血液及尿液中的E几乎全部来自肾上腺髓质分泌,NE及DA则还可来自其他组织中的嗜铬细胞及未被摄取的神经递质。
儿茶酚胺类激素以酪氨为原料,经下列酶促反应生成。由于各种组织中存在的酶有不同,故分别合成E、NE或DA。
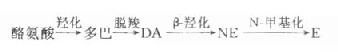
肾上腺髓质合成的E和NE贮存于嗜铬细胞的囊泡中,其释放受交感神经兴奋控制。作为激素释放的E和NE,亦具有交感神经兴奋样心血管作用及促进能量代谢、升高血糖等作用。进入血液的E和NE均迅速被单胺氧化酶及儿茶酚胺氧位甲基转移酶等代谢灭活,与临床生化检测有关的主要代谢产物如下:

㈡肾上腺髓质嗜铬细胞瘤及其临床生化诊断
肾上腺髓质嗜铬细胞瘤(pheochromocytoma)最好发部位。由于过量的E及NE释放入血液中,作用于肾上腺素受体,产生持续性或阵发性高血压,并伴有血糖、血脂肪酸、基础代谢率升高等代谢紊乱。本病的临床生化检查主要有两类。
⒈儿茶酚胺类激素及其代谢物测定 由于检测技术限制,早年主要用比色法或荧光光度法测定24h尿中总游离儿茶酚胺类物质或VMA量。正常成人24h尿游离儿茶酚胺类物质总量<1.65μmol/d(280μg/d),VMA量为15.7-88.5μmol/d(3.1-17.6mg/d),二者明显超过正常值上限有助于嗜铬细胞瘤诊断。但血和尿中儿茶酚胺类主要为递质性NE及DA,而VMA为NE及E共有的代谢物,因此这两项指标对嗜铬细胞瘤,特别是发生于肾上腺髓质者特异性不高。并且该类测定影响因素多,香蕉、茶、咖啡等含香草的食品糖果、四环素、红霉素、多种拟肾上腺素药、抗抑郁症药及含多巴结构的药等可致假阳性;芬氟拉明、甲基葡胺造影剂可产生假阴性。随后采用检测仅为E代谢物的3-氧-甲基肾上腺素的24h尿排量,虽仍受上述因素影响,但特异性有所提高。3-氧-甲基肾上腺素的成人正常参考值范围为<5.07μmol/d。
近年来,由于采用HPLC-电化学检测法的灵敏度已可满足需要,故应用本法直接分离测定血浆中E及NE,对本病的诊断价值更高。但包括静脉穿刺取血在内的紧张及各种应急状态,甚至体位改变,均可刺激肾上腺髓质释放E及NE;而取血后室温下5min内不除去红细胞,将使E和NE浓度迅速下降。因此应在清晨平卧时,插入保留式静脉取血管(indwelling catheter),至少30min后待病人安静时再取血,转入盛有冰冻过的抗凝剂和抗氧化剂的试管中,迅速低温离心分离血浆进行测定。按上述条件测得的正常成人血浆参考值范围为E:109-437pmol/L(20-80pg/ml);NE:0.615-3.240nmol/L(104-548pg/ml)。嗜铬细胞瘤时,二者明显升高,若E升高较NE显著则提示可能为肾上腺髓质嗜铬细胞瘤。
⒉动态功能试验 诊断肾上腺髓质嗜铬细胞瘤的动态功能试验方法较多。目前兴奋试验常用胰高血糖素激发试验,即在疑为本病者非发作期,按上述步骤及方法取血及测量血压后,静脉注射胰高血糖素1mg,注毕每15s量血压,1-3min内再取血,分别测定给药前后血浆E及NE。由于胰高血糖素可迅速刺激肾上腺髓质释放E及NE,因此肾上腺髓质嗜铬细胞瘤者,血浆E和NE可较基础对照值升高明显,达3倍以上,血压也急剧上升,可达26.2/21.3kPa(200/160mmHg)。本法禁用于糖尿病人。抑制试验则多用可乐定(clonidine)抑制试验。降压药可乐定可抑制递质性儿茶酚胺释放,但不影响嗜铬细胞释放E及NE。对有高血压而怀疑本病者,给予可乐定0.3mg一剂口服前及服药后3h,分别取血测定血浆NE。非嗜铬细胞瘤性高血压者,血浆NE将降低50%以上,嗜铬细胞瘤性高血压者,NE仅轻度减少。本法尤适用于有持续性高血压,其他检测结果又在边缘范围者。由于多种降压药及三环类抗抑郁药可干扰本试验,故需停用上述药至少12h后才能进行。
二、肾上腺皮质的内分泌功能
㈠肾上腺皮质激素及类固醇激素的生物合成
肾上腺皮质可分泌多种激素,按生理生化功能及分泌组织,可分做三类:①球状带分泌的盐皮质激素(mineralocorticoide),主要是醛固酮(aldosterone)和脱氧皮质酮(deoxycorticosterone);②束状带分泌的糖皮质激素(glucocorticoide),主要有皮质醇 (cortisol)及少量的皮质酮(corticosterone);③网状带分泌的性激素,如脱氢异雄酮(dehydroepiandrosterone)、雄烯二酮(androstenodione)及少量雌激素。从化学结构上看,这三类激素及性腺合成的其他性激素,均是胆固醇的衍生物,故统称类固醇激素(steroid hormones),而上述三类肾上腺皮质激素又合称皮质类固醇(corticosteroids)。
类固醇激素在人体内均是以胆固醇为原料,经过一系列酶促反应而合成的,只是由于某些酶活性在某些内分泌腺或同一腺体不同的组织中特别高,从而生成不同的激素。类固醇激素的主要合成途径及产物见图12-3。图中标示出了酶活性存在腺体差异性的反应步骤,以及临床常见的先天性酶缺陷所影响的步骤,有助于有关酶缺陷的临床生化诊断参考。
有关盐皮质激素的临床生化在第五章已作介绍,性激素的临床生化将在本章第五节讨论,故本节将只介绍有关糖皮质激素的临床生化。
㈡糖皮质激素的运输及代谢
释放入血液中的糖皮质激素主要为皮质醇及10%左右的皮质酮。二者均约75%左右与肝脏合成的一种α1-球蛋白,即皮质素转运蛋白(transcortin),亦称皮质类固醇结合球蛋白(corticosteroid-binding globulin,CBG)可逆结合,15%与白蛋白可逆结合,仅10%左右以游离形式存在。CBG对糖皮质激素的亲和力高,但每分子CBG仅有一个结合部位,且血浆浓度低,故其结合容量有限。白蛋白虽然与糖皮质激素亲和力低,但可有多个结合位点,血浆浓度又高,因此结合容量大。当血中皮质激素浓度明显升高时,与CBG结合易达饱和,将出现与白蛋白结合部分及游离部分比率不成比例的升高。只有游离糖皮质激素才能进入靶细胞发挥生理生化作用及反馈调节自身分泌。
糖皮质激素的代谢主要在肝细胞中进行。主要反应方式为C-3酮基及环节中双键被加氢还原,生成多种加氢代谢物,以四氢皮质醇最多,此外尚有少量二氢、六氢代谢物。90%氢化皮质醇等代谢物及少量原型糖皮质激素,与葡糖醛酸或硫酸结合成相应的酯化物,从尿中排出,亦有少量可随胆汁排入肠道随着粪便排泄。以游离原型从尿中排出的皮质醇仅为血液总量的1%左右。
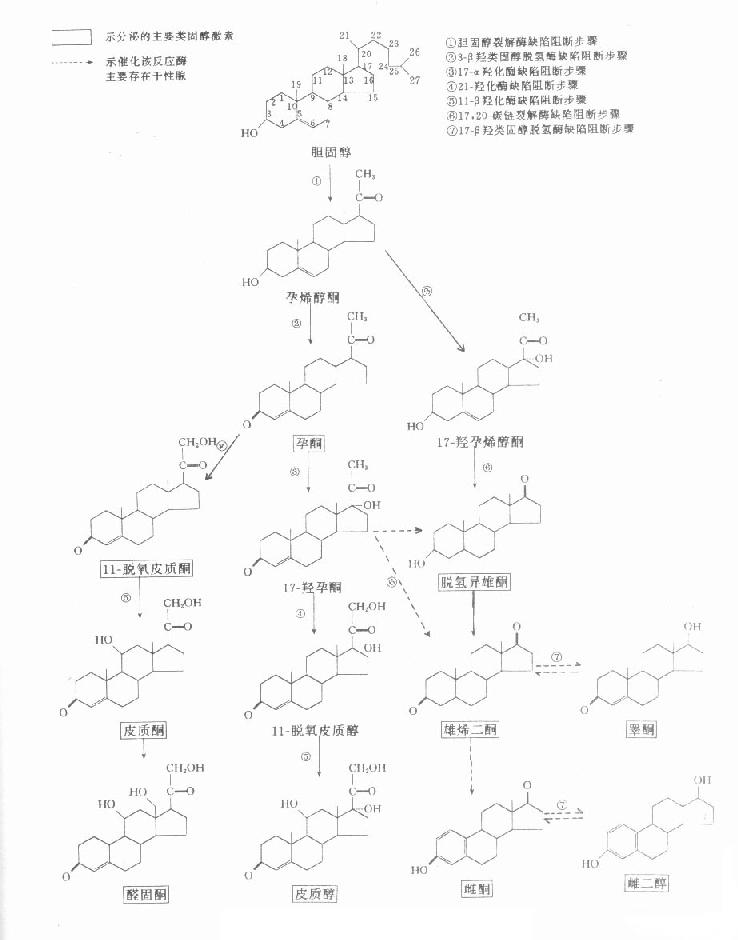
图12-3 类固醇激素生物合成的途径
㈢糖皮质激素的生理生化功能
游离皮质醇等糖皮质激素可经靶细胞扩散入胞质内,与其受体结合。糖皮质激素-受体复合物转运入细胞核内,可启动某些DNA片段转录,生成的mRNA进入胞质,指导合成特异的酶和脂皮素(lipocortin)等蛋白质或肽类介质,产生广泛的生理生化作用。生理性浓度下,糖皮质激素的主要功能为:
⒈调节糖、脂肪、蛋白质三大营养物质的代谢 对糖代谢,糖皮质激素可促进糖原异生,增加肝糖原和肌糖原含量,另一方面又抑制除脑和心脏外其他组织对糖的利用,使血糖升高。对蛋白质代谢,可促进除肝脏外多种器官、组织的蛋白质分解,抑制蛋白质的合成,升高血中氨基酸,出现尿酸、尿素氮排泄增多等负氮平衡表现。糖皮质激素能激活四肢皮下的脂酶,促进这些部位的脂肪分解,血脂肪酸升高,并使脂肪呈向心性重新分布。
⒉影响水电解质代谢 糖皮质激素有弱的盐皮质激素样潴钠排钾作用,亦有弱的促尿排钙排泄及抗利尿激素作用。
⒊允许作用(permissible action) 机体内其他一些激素、神经递质等生物活性物质的作用,需有适当浓度的糖皮质激素存在,才能正常表达,此即糖皮质激素的“允许作用”。主要为对肾上腺素及胰高血糖素的作用。
但高浓度的糖皮质激素如药用或肾上腺皮质功能亢进等,则除上述作用增强外,还可表现出抑制炎症、免疫反应,影响血细胞等作用,将在肾上腺皮质功能亢进症中介绍。
㈣糖皮质激素分泌的调节
和甲状腺激素分泌调节相似,肾上腺糖皮质激素的合成和分泌亦主要受图12-1所示的下丘脑-垂体-内分泌腺调节轴的控制。血液中游离糖皮质激素水平的变化,负反馈地引起下丘脑及垂体分别释放促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)和促肾上腺皮质激素(corticotropin 或 adrenocorticotropic hormone,ACTH)的增多或减少。CRH为下丘脑产生的一种含41个氨基酸残基的多肽,可选择性地促进腺垂体释放ACTH。ACTH是腺垂体促肾上腺皮质素细胞释放的39肽激素,可通过作用于肾上腺皮质束状带或网状带细胞膜上的ACTH受体,激活腺苷酸-cAMP-蛋白激酶系统,促进细胞增殖,合成和分泌糖皮质激素、性激素增多。持续的高ACTH状态仅早期一过性地引起盐皮质激素分泌增加,无持久影响。ACTH和CRH亦可负反馈地调节下丘脑CRH的释放。和甲状腺激素分泌调节不同,在肾上腺皮质激素的分泌调节中,最主要的是血液中游离糖皮质激素对下丘脑CRH释放的负反馈调节。ACTH和糖皮质激素的分泌存在明显的昼夜节律,分泌高峰见于晨6-8小时,低谷在午夜22-24时。此外,糖皮质激素是机体应激反应时释放的主要激素,因此,各种伤害性刺激均可通过高级神经中枢-下丘脑-垂体-肾上腺皮质轴,促进糖皮质激素的分泌。
除垂体外,一些垂体外的肿瘤主要是肺燕麦细胞癌,其次为胸腺癌、胰岛细胞癌、类癌、甲状腺髓样癌、嗜铬细胞瘤等,亦可分泌异源性ACTH。但这些异位肿瘤ACTH的分泌既不受血液糖皮质激素水平的负反馈调控,也不受CRH促进。此外,近年还发现有少数肿瘤可不受糖皮质激素反馈调节地释放异源性CRH。
现已明确,无论是腺垂体还是异位肿瘤分泌的ACTH,均和γ-黑色细胞刺激素(γ-melanocyte stimulating hormone,γ-MSH)、β-促脂解素(β-lipotropic hormone,β-LPH)、β-内啡肽(β-endophin)等,来自同一由265个氨基酸残基组成的大分子前体蛋白,称阿片皮质素原(proopiomelanocortin,POMC)。ACTH等有关多肽激素与POMC的关系见图12-4。

图12-4 阿片皮质素原及其多肽激素裂解产物的关系
三、肾上腺皮质功能紊乱
㈠皮质醇增多症
皮质醇增多症(hypercortisolism)又称库欣综合征(Cushing’s syndrome),是各种原因致慢性糖皮质激素分泌过多而产生的症候群统称。按病因可分做:①垂体腺瘤及下丘脑-垂体功能紊乱,ACTH过量释放产生的继发性皮质醇增多症,又称库欣病,约占70%。其中主要为不伴蝶鞍扩大的微腺瘤,其病因定位诊断主要依赖临床生化检测。②肾上腺皮质肿瘤或结节性增生所致的原发性者,其中以皮质腺瘤多见,约占总病例的近20%,皮质腺瘤约占5%,结节性增生少见。此类病人糖皮质激素分泌一般呈自主性,不受ACTH调控。③异源性ACTH或CRH综合征,由垂体、下丘脑以外的癌瘤细胞分泌释放异源性ACTH或CRH而致。前者以肺燕麦细胞癌最多见,其次为胸腺癌、胰岛细胞癌等;后者可见于肺癌及类癌。早年统计,异源性ACTH、CRH综合征约占皮质醇增多症的5%,但随着对此症的警惕及诊断手段提高,近年发现发病率上升,甚至有报告高达占皮质醇增多症20%的。此外,药源性皮质醇增多症虽临床常见,但因有明确的大剂量糖皮质激素应用史可查,不在此讨论。
皮质醇增多症时,因糖皮质激素病理性持续高水平,导致上述生理作用扩大、增强,产生一些共同的临床表现,如向心性肥胖,皮肤、肌蛋白大量分解而致萎缩,并因此使皮下微血管显露呈对称紫纹,骨质疏松,高血压等。因同时伴有性激素(主要是雄激素)分泌增多,女性可见多毛、月经失调、甚至男性化改变。常规临床生化检查可见血糖升高,葡萄糖耐量降低,血Na+升高,血K+、Ca2+降低,并可出现低钾性代谢性碱中毒的改变,血、尿肌酸、尿素氮明显升高等负氮平衡表现等。高浓度的糖皮质激素可通过诱导磷脂酶A2抑制性多肽脂皮素合成,减少细胞因子白三烯类、血小板活化因子及前列腺素生成等作用,抑制炎症反应及免疫反应。患者对感染的抵抗力降低,并出现各种体液和细胞免疫功能检查指标低下。还可刺激骨髓造血功能,红细胞、血红蛋白、血小板及嗜中性粒细胞均增多,但淋巴细胞和嗜酸性粒细胞明显减少等血液系统改变。库欣病及异源性ACTH综合征者,特别是后者,由于大量阿片皮质素原产生,伴有黑色细胞刺激素释放增多,出现皮肤色素沉着。
㈡肾上腺皮质功能减退症
肾上腺皮质功能减退症(adrenal cortical insufficiency)是指慢性肾上腺皮质分泌糖皮质激素不足产生的综合征。本病较少见,包括原发性及继发性两种。原发性者又称阿狄森病(Addison’s disease),多因肾上腺结核、自身免疫性肾上腺皮质萎缩、转移性肾上腺癌肿、手术切除等破坏肾上腺皮质,造成糖皮质激素和(或)盐皮质激素分泌不足致病。临床所见除心血管系统、消化系统、神经系统、生殖系统等功能低下,以及低血糖、低血Na+、高血K+、Ca2+等一般实验室检查改变外,由于低糖皮质激素水平负反馈引起ACTH释放增多,而前已介绍,ACTH前体物阿片皮质素原(POMC)中同时含有黑色细胞刺激素多肽片段,故原发性肾上腺皮质功能减退症者可出现特征性皮肤粘膜色素沉着,并可藉此与继发性者鉴别。继发性肾上腺皮质功能减退症指因各种原因,如颅内肿瘤压迫、浸润,垂体前味缺血坏死、手术切除、放疗等,造成下丘脑及垂体不能正常释放CRH、ACTH而致。此时多为多内分泌腺功能减退,极少仅单独表现为肾上腺皮质功能不足,并且无上述皮肤粘膜色素沉着出现。
㈢先天性肾上腺皮质增生症
先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)为常染色体隐性遗传性疾病,系因肾上腺皮质激素合成中某一酶先天性缺陷,肾上腺皮质激素合成受阻,反馈性引发CRH及ACTH分泌增多,致肾上腺皮质弥漫性增生。此时多伴有肾上腺皮质性激素分泌亢进,故CAH常表现为肾上腺性性征异常症。由于任何酶缺陷都将使其所催化的底物堆积并大量释放入血液,被代谢后从尿中排出,因此血和尿中的此类物质可作为该酶缺陷的生化标志物。有关酶缺陷影响的生物合成步骤参见图12-3。表12-3列举了常见的引起CAH的先天性酶缺陷类型、主要临床表现、血液及尿中有诊断意义的生化标志物。测定观察血或尿中这些标志物的变化,有助于诊断CAH及其类型。
表12-3 CAH的酶缺陷类型、主要临床表现及血和尿中的生化标志物
酶缺陷种类 |
主要临床表现 |
血生化标志物 |
尿生化标志物 |
21-羟化酶 |
轻型:女性假两性畸形,男性假性早熟 重型:同上,并出现阿狄森病 |
17-羟孕酮 |
17-羟孕酮硫酸或葡萄糖醛酸酯、孕三醇 |
胆固醇裂解酶 |
肾上腺皮质功能衰竭,早夭 |
无皮质激素 |
无皮质激素及代谢物 |
3-β羟类固醇脱氢酶 |
男女均呈假两性畸形 |
脱氢异雄酮 |
16-羟脱氢异雄酮,孕烯三醇 |
17-α羟化酶 |
高血钠,低血钾,低血糖,高血压,性幼稚症 |
孕酮 |
孕二醇 |
11-β羟化酶 |
高血压,女性假两性畸形,男性假性早熟 |
11-脱氧皮质醇 |
四氢脱氧皮质醇 |
四、肾上腺皮质功能紊乱的临床生化诊断
前述肾上腺皮质功能紊乱时出现的血液电解质、血糖等一般生化指标改变,对肾上腺皮质功能亢进或减退的诊断有一定的价值。下面我们将介绍诊断肾上腺皮质功能紊乱的一些特殊的临床生化检测项目。
㈠血、尿中糖皮质激素及其代谢物测定
⒈尿17-羟皮质类固醇、17-酮类固醇测定 尿中17-羟皮质类固醇(17-hydroxycorti-costeroids,17-OHCS)测定是指对尿中C-17上有羟基的所有类固醇类物质的测定。该类内源性物质在人类主要为肾上腺皮质所分泌的糖皮质激素皮质醇,及其活性更强的代谢产物去氧皮质醇,以及二者的二氢、四氢、六氢代谢产物。上述物质大多以葡糖醛酸酯或硫酸酯的结合形式排出。24h尿中以17-OHCS排出的糖皮质激素及其各种代谢物约占每日分泌量的25%-40%。尿17-OHCS测定一般均收集24h尿,量取体积后取样加酸水解,释放出游离17-OHCS,这样该类皮质类固醇中的二羟丙酮侧链可与硫酸溶液中的盐酸苯肼反应显色,而以分光光度法测定。成人24h尿17-OHCS正常值参考范围为:男性21.3-34.5μmol/d(7.7-12.5mg/d),女性19.3-28.2μmol/d(7.0-10.2mg/d)。儿童低于成人,约在青春期达成人水平。皮质醇增多症或肾上腺皮质功能减退症时,尿17-OHCS将分别明显增多或减少。但影响本测定的因素较多,如应激状态、营养不良、慢性消耗性疾病、肝硬化、肾功能不良、多种可干扰测定的药物及食物等,故其灵敏度及特异性均差。约有15%的皮质醇增多症者不能观察到尿17-OHCS明显升高,而其诊断皮质醇增多症的假阳性率也近15%。
尿17-酮类固醇(17-ketosteroids,17-KS)指尿中出现的所有C-17为酮基的类固醇类物质。人类尿中排出的内源性17-KS包括雄酮、异雄酮、脱氢异雄酮等及其代谢物,此外有少量皮质醇可在肝脏发生C-17羟基脱氢氧化成17-KS,由尿中排出。和17-OHCS一样,尿中上述17-KS大多也以葡糖醛酸酯或硫酸酯的结合形式存在。尿内源性17-KS中男性约2/3来自肾上腺皮质,1/3来自睾丸;女性则几乎全部来自肾上腺皮质,卵巢仅产生少量。因此,尿17-KS在女性青春期前可较粗略地代表肾上腺皮质的内分泌功能,男性则反映了肾上腺皮质和睾丸二者的内分泌功能状态。尿17-KS测定也需先酸解以释放出游离17-KS,提取后,在碱性环境中,通过其结构中的酮-亚甲基(-CO-CH2-)与间二硝基苯反应显色,再以分光法测定。24h尿17-KS正常成人参考范围为:男性28.5-61.8μmol/d(8.2-17.8mg/d),女性20.8-52.0μmol/d(6- 15mg/d),青春期前儿童低于成人。尿中存在的氯丙嗪、甲丙氨酯(眠尔通)以及多种有色药物,有色食品饮料,严重肝、肾疾患,睾丸或卵巢内分泌功能紊乱,均可影响本测定结果。故在诊断肾上腺皮质功能紊乱上,尿17-KS比尿17-OHCS特异性更低。据统计,在诊断皮质醇增多症上,尿17-KS可出现约45%假阴性和10%的假阳性。
由于以上原因,在诊断肾上腺皮质功能紊乱的临床生化检测中,单独测定尿17-OHCS及17-KS,特别是后者已较少应用。但若出现尿17-KS显著升高,且不被地塞米松抑制(见后),则有助于肾上腺皮质腺瘤或癌的诊断。因为这两种情况,特别是后者可产生大量17-KS类雄激素。此外21-羟化酶、3-β羟化酶及11-β羟化酶缺陷所致先天性肾上腺皮质增生症者,尿17-KS也明显升高。
⒉血皮质醇及24小时尿游离皮质醇测定 血液中皮质醇浓度直接反映肾上腺糖皮质激素分泌情况,而尿中游离皮质醇(urine free cortisol,UFC)由血液中游离皮质醇经肾上球滤过而来,因此其量与血浆中真正具生物活性(包括调节自身分泌)的游离皮质醇浓度成正比。血浆(清)皮质醇或24h UFC测定现被推荐为是否存在肾上腺皮质功能紊乱的临床生化检查首选项目。目前皮质醇测定方法有荧光光度法、免疫化学法、HPLC、GC、GC-MS等。其中荧光法因受多种内源性皮质激素及其前体物如皮质酮、11-去氧皮质醇(甲吡酮抑制试验时可能大量出现)等干扰,特异性较差,测定结果较其他方法偏高。HPLC、GC、GC-MS法虽然特异性、灵敏度均高,但难以在临床常规工作中使用,仅用作参考方法。免疫化学法除特异性及灵敏度均满足要求外,其操作简便、快速,且有商品试剂盒供选用,为目前最常使用的方法。
血浆(清)皮质醇测定,是检测包括蛋白结合和游离两部分的总皮质醇浓度,并不能排除CBG、白蛋白浓度改变等各种影响皮质醇蛋白结合率因素对游离皮质醇浓度的影响,因此其浓度不一定和游离皮质醇浓度平行。正常人皮质醇的分泌存在昼夜节律,可由于导致单次取样测定因取样时间在分泌峰或谷浓度,产生假阳性或假阴性结果。皮质醇增多症者,该昼夜节律多消失,并为诊断依据之一。故现在均主张分别在早晨8点及午夜12点分别取血测定,代表峰浓度、谷浓度。并且为避免因住院、静脉穿刺等产生应激性皮质醇分泌因素的影响,采血宜在住院至少3天后,并以保留式静脉取血套管进行。免疫法测得血浆(清)皮质醇正常值参考范围为晨8点165.6-441.6nmol/L(6-16μg/dl),午夜12点55.2-165.6nmol/L(2-6μg/dl),并且早晚的昼夜节律波动范围>2。血皮质醇浓度无性别差异,儿童较成人高。皮质醇增多症者,早晚血皮质醇浓度,尤其是午夜值显著高于正常,且二者比值<2。肾上腺皮质功能减退者亦多出现昼夜节律性波动消失(早/晚比值<2),且皮质醇浓度均显著低于正常值下限,特别是晨8点结果意义更大。但若同时患有任何严重的非肾上腺疾病,各种原因产生的应激状态,以及妊娠、肥胖、甲状腺功能紊乱、慢性肝病、抑郁症、吩噻嗪类抗精神失常药、苯妥英钠、利血平和长期使用糖皮质激素类药,均可影响皮质醇水平或昼夜节律。在解释结果时应予以注意。
24h UFC测定不受昼夜节律影响,并可靠地反映游离皮质醇水平。特别是当皮质醇增多症时,血皮质醇浓度超过CBG结合容量,游离皮质醇浓度将不成比例地升高,UFC亦将出现较血浆总皮质醇、尿17-OHCS和17-KS更明显的改变。故在诊断皮质醇增多症上,24h UFC测定更为敏感可靠。但本测定除同样受上述影响血浆皮质醇测定的因素影响外,还受肾功能影响。若同时测定尿肌酐排泄量,以24h UFC/24h尿肌酐表示,可在一定程度上排除肾功能对24h UFC测定的影响。免疫法检测24h UFC成人正常值以参考范围为27.6-276nmol/d(10-100μg/d)或30-99μg/g肌酐。24h UFC亦无性别差异,但儿童年龄越小越低。若成人24h UFC>552nmol/d,大多提示存在皮质醇增多症。但24h UFC存在较大的天间变动,不如血浆皮质醇浓度稳定,最好分别测定3日UFC,综合判断。
㈡下丘脑-垂体-肾上腺皮质轴功能检测及动态功能试验
上述血、尿中皮质醇及皮质激素代谢产生检测,在肾上腺皮质功能紊乱的生化诊断中,仅起着较粗糙的筛选作用,确诊及对治疗方案有指导意义的病变部位、性质的判定,往往需进行下丘脑-垂体-肾上腺皮质调节轴功能检测及必要的动态试验。
⒈血浆ACTH及N-POMC测定 ACTH为腺垂体分泌的微量多肽激素,现大多以免疫化学法检测。正常ACTH分泌存在与皮质醇相同的昼夜节律,并且在肾上腺皮质功能紊乱时,ACTH分泌的昼夜节律也大多消失。异源性ACTH分泌也无昼夜节律,故ACTH测定也和血浆皮质醇测定一样,应在早上8点及午夜12点各取血测定,既观察昼夜节律有无,也避免取样时间造成的影响。有关影响本测定的因素、注意事项及取血方法,参见血浆皮质醇测定。血浆ACTH正常成人参考范围为:早上8点2.2-22.0pmol/L(10-100pg/ml),午夜12点1.1-4.4pmol/L(5-20pg.ml),二者比率>2。在阿狄森病、先天性肾上腺皮质增生症、下丘脑及垂体性皮质醇增多症、特别是异源性ACTH综合征时,午夜ACTH明显高于正常范围,并且昼夜节律消失。而继发性肾上腺皮质功能减退症、肾上腺皮质腺瘤或癌所致的原发性皮质醇增多症者,则晨8点血浆ACTH明显降低(<1.1pmol/L),昼夜节律也消失。在高水平ACTH时,为鉴别ACTH属垂体性或异源性,可采用静脉插管,分别同时采集岩下窦及外周静脉血,测定二者ACTH。若岩下窦血ACTH为外周血2倍以上,则提示为垂体源性;而岩下窦血ACTH反低于外周血ACTH水平,则可确定为异源性ACTH综合征。这一方法在其他检查无法确定癌肿灶时,尤有价值。
前已介绍,POMC为ACTH的前体物,其N端76肽水解自然N-POMC与ACTH等分子数产生,但其降解速度慢,血中浓度高,更易检测。近年有主张以N-POMC测定代替ACTH检测的趋势。
⒉兴奋试验 肾上腺皮质功能试验紊乱的兴奋性动态功能试验有多种,目前较成熟的为ACTH兴奋试验。该试验是根据ACTH可刺激肾上腺皮质合成并迅速放贮存的皮质醇等皮质激素原理,分别检测使用ACTH前后体液中皮质醇或其代谢物的变化,反映肾上腺皮质的内分泌功能状况。通常用0.25mg合成ACTH肌肉或静脉注射,分别在注射前和注射后0.5、1h采集静脉血,测定和观察血浆皮质醇浓度变化。正常人注射ACTH后,峰浓度在0.5h出现,该时血浆皮质醇浓度较注射前基础值至少增加157.5nmol/L(7μg/dl)以上,或峰浓度值高于550nmol/L(20μg/dl)。未用皮质激素治疗的阿狄森病患者,基础值低,且对ACTH刺激无反应,有时甚至反下降;继发性肾上腺皮质功能低下者,基础值亦低,但对ACTH可有延迟性反应。肾上腺皮质腺瘤或癌性皮质醇增多症者,其皮质醇分泌呈自主性,对ACTH刺激亦多无反应,但其皮质醇基础水平高,且临床表现与阿狄森病迥异,不难鉴别。下丘脑垂体性皮质醇增多症则出现强阳性反应,而异源性ACTH综合征者,肾上腺皮质无病变,对ACTH刺激亦呈阳性反应。亦可以注射前、注射日及次日24h尿17-OHCS或UFC作为观察指标,正常人注射日或次日,前者应较基础增加1-3倍,后者增加2倍以上。近年还有根据CRF可促进腺垂体释放ACTH,但对异源性分泌ACTH的癌瘤细胞无影响的原理,检测注射CRH前后血浆ACTH变化,鉴别皮质醇增多症的病因尚未普遍开展。
⒊抑制试验 最常用地塞米松抑制试验。地塞米松(dexamethasone,DMT)为人工合成的强效糖皮质激素类药,对下丘脑-垂体-肾上腺皮质调节轴可产生皮质醇样但更强的负反馈调节作用,其影响部位主要是抑制腺垂体释放ACTH,进而间接抑制肾上腺皮质激素的合成和释放,故可用于判定肾上腺皮质功能紊乱是否因下丘脑垂体功能异常所致。具体实施方案很多,如单剂、48h及标准DMT抑制试验。其中单剂(1mg)DMT抑制试验易造成假阴性,而对类似皮质醇增多症的单纯性肥胖者却产生假阳性。标准DMT抑制试验过于耗时、繁琐,现多采用48h小剂量DMT抑制试验,即在连续两日收集24h尿作基础对照后,第三日开始DMT 0.5mg/每6h,连续两日(总剂量4mg),并分别收集这两日的24h尿。分别测定每日24h UFC或17-OHCS。正常人包括单纯性肥胖者,用DMT后尿17-OHCS或UFC均应降至基础值的50%以下。皮质醇增多症者抑制程度达不到50%,甚至几无反应。若再连续两日服用DMT 2mg/每6h,并也分别收集这两日24h尿,测定17-OHCS或UFC,即为标准DMT抑制试验。下丘脑垂体性皮质醇增多症者,使用DMT的第3或4日的24h17-OHCS或UFC可较基础值水平降低50%以上;而异源性ACTH综合征、肾上腺皮质腺癌或瘤性皮质醇增多症者则一般不受抑制。若有条件,也可用晨8点取血测定ACTH或皮质醇,作为观察指标,判断标准同上。但较长期服用有肝药酶诱导作用的药物,如苯妥英钠、苯巴比妥钠、利福平等,可加速DMT代谢灭活,产生假阴性。近期曾较长期使用糖皮质激素类药物,显然不宜进行本试验。此外,若机体处于任何原因所致的应激状态时,亦可能干扰本试验,均应避免。
甲吡酮(metyrapone,美替拉酮)抑制试验对皮质醇增多症病因与定位诊断上亦有一定价值。甲吡酮为皮质醇合成中,催化11-脱氧皮质醇转化为皮质醇的11-β羟化酶特异性抑制剂。使用后可使皮质醇合成、释放减少,反馈性诱导ACTH分泌增多,肾上腺皮质中11-脱氧皮质醇(亦属17-OHCS)大量堆积,尿中排泄增多,而皮质醇并不见增加。在试验日前收集二日24h尿,给予甲吡酮500-750mg/每4h口服共6次,再收集服药日及次日24h尿,分别测定各24h 17-OHCS。正常人可较基础值水平升高2-4倍。垂体性特别是下丘脑性皮质醇增多症者,用药后17-OHCS可升高4倍以上,也有部分垂体腺瘤者,虽然ACTH释放增多,但尿17-OHCS升高不能达诊断水平。肾上腺皮质腺瘤或癌及异源性ACTH综合征者,一般均无反应,后者若垂体源性ACTH在皮质醇分泌中仍有一定调节作用,可有一定反应,但很少能达到正常反应上限。若以直接测定血浆ACTH代替尿17-OHCS作为观察指标,则更为可靠。
肾上腺皮质功能紊乱的有关特殊临床生化检查所见总结于表12-4。
表12-4 肾上腺皮质功能紊乱的临床生化检查所见
皮质醇增多症 |
肾上腺皮质功能减退症 | |||||
下丘脑垂体性 |
肾上腺皮质腺瘤 |
肾上腺皮质腺癌 |
异源性ACTH |
阿狄森病 |
继发性 | |
尿17-OHCS |
中度升高 |
中度升高 |
明显升高 |
明显升高 |
减少 |
减少 |
尿17-KS |
升高 |
略升高 |
明显升高 |
明显升高 |
减少 |
减少 |
血皮质醇或UFC |
升高 |
升高 |
明显升高 |
明显升高 |
减少 |
减少 |
血浆ACTH |
升高 |
降低 |
降低 |
明显升高 |
升高 |
减少 |
ACTH兴奋试验 |
强反应 |
无或弱反应 |
无反应 |
多无反应 |
无反应 |
延迟反应 |
DMT抑制试验 |
无或有反应* |
无或弱反应 |
无反应 |
无或弱反应* |
||
甲吡酮抑制试验 |
强反应 |
无或弱反应 |
无反应 |
无或弱反应 |
||
* 标准地塞米松(DMT)抑制试验时才可能部分患者有一定反应。
, http://www.100md.com