优化评价流程 节约时间成本 ——对仿制药物一致性评价工作的建议
——对仿制药物一致性评价工作的建议
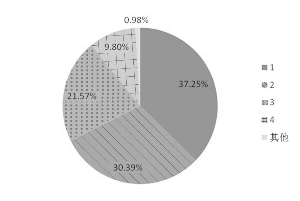
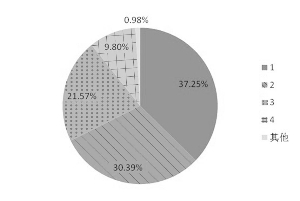
图 口服药物中不同BDDCS分类所占比例
国家食品药品监督管理局(SFDA)近日公布的《仿制药质量一致性评价工作方案(征求意见稿)》(简称《方案》),较系统地描述了仿制药物一致性评价的工作目标、方法、职责、内容、计划和工作保障等,对一致性评价的方法和流程做出了设想和规划,较明确地提出了评价工作的总体思路,对于仿制药物再评价工作具有很强的指导意义。这也体现出监管部门对规范仿制药物市场、保证公众用药安全的决心和力度,具有极大的社会意义。
《方案》指出,此次再评价工作涉及约12万种化学药物,评价工作耗时长,任务繁重。尽管做了5~10年的工作计划,相关部门平均每年仍需要对上万种药物进行评价。特别是常用的药物如氧氟沙星、甲硝唑等,单种药品的仿制药物可达上千种;对这些药物进行实验考察及材料审批,过程将是非常繁冗耗时的。因此,优化评价流程,找到合理可靠的评价指标,是再评价工作的关键。为此,笔者提出以下几点建议:
, http://www.100md.com
制定合理标准
要制定合理的一致性评价标准。
《方案》指出,将遵照“科学合理、分类开展”的原则进行评价工作,如按照药物类别和剂型分类、分步实施,是科学且高效的方式。但是仅对剂型分类是否足够?如对口服固体制剂进行溶出曲线评价,是药物再评价的重点指标,但是否所有药物的溶出曲线都可以反映体内的吸收程度,仍值得商榷。日本进行的相关质量再评价工作,主要针对难溶性药物,因此主要指标是溶出曲线和溶出曲线-体内吸收的体外体内相关性研究。但当溶出度不是药物在体内的限速步骤时,仅进行溶出曲线评价并不能反映药物在体内吸收的程度和速度。此外,对于一些体内溶解度和渗透性均较差的药物,体外指标可能无法反映体内的吸收情况,仍需要进行人体生物等效性研究。因此,还需要针对不同性质的药物确定适宜的评价方法和标准体系。
借鉴欧美经验
参考欧美仿制药物研发过程中的豁免机制,对符合标准的仿制药物进行一致性评价豁免,只进行制剂工艺评价,可以为我国仿制药物一致性评价工作节约大量的研究成本与时间。
, 百拇医药
美国食品药品管理局(FDA)、欧洲药品管理局(EMA)、世界卫生组织(WHO)自2000年起陆续开展仿制药物生物等效性豁免工作,根据药物的溶解度、渗透性/代谢程度和溶出度对药品进行考察,符合条件的仿制药被认为与原研药具有相同的生物利用度。至今,已有不少此类药品通过豁免机制上市,节约了大量社会成本与研发时间。以下笔者对欧美现行评价系统进行简要介绍,以期能为我所用。
1.生物药剂学分类系统(BCS)
该系统于1995年由Amidon等人提出,根据药物的溶解度和渗透性分为4类。其中高溶解度的定义为:在37°C,pH 1.0~7.5范围内,药物的最高使用剂量可以完全溶解于250ml或更少的介质中。高渗透性的标准是在明确药物在胃肠道内可以保持稳定的情况下,体内吸收达90%。每种药物按照不同的溶解度和渗透性,可以归为以下4类:
第1类:高溶解度-高渗透性药物,如维拉帕米、美托洛尔;
, 百拇医药
第2类:低溶解度-高渗透性药物,如环孢素、苯妥英;
第3类:高溶解度-低渗透性药物,如阿昔洛韦、西咪替丁;
第4类:低溶解度-低渗透性药物,如呋塞米、氯噻嗪。
其中第1类药物具有较高的溶解度和渗透性,吸收较好,因此如果两种口服速释制剂在不同条件下均具有相同的溶出特征,则它们将具有相同的药物吸收度。
该系统在2000年被FDA采用,作为《基于生物药剂学分类系统对口服速释固体制剂免除生物利用度和生物等效性的工业指导原则》的理论基础。根据BCS理论,非专利药品若能在体外试验中被证实具有高溶解度和高渗透性(BCS第1类),其速释制剂可以申请免除体内生物等效性研究。
根据FDA 2004~2008年的数据显示,平均每年约有600项生物等效性试验。假使能对其中的30%(BCS第1类、第3类)进行豁免,则每年可以节省上亿美元的生物等效性试验费用。
, 百拇医药
2.基于药物体内处置的生物药剂学分类系统(BDDCS)
BDDCS系统在BCS系统基础上加以改进,使用药物代谢程度作为渗透性的替代指标。代谢程度作为分类指标的优点,尤其是对于已上市的药物,就是其代谢程度是
已知参数,可以更加简便地对药物进行分类,因此特别适用于我国上市仿制药品再评价工作。该系统也于2010年被欧洲药品管理局采纳,作为渗透性的替代指标,FDA也已对其表示认可。
我国2009年版《国家基本药物处方集——化学药品和生物制品》中收录了255种化学药品和生物制品,其中涉及口服化学药物143种。我们逐个查阅药物在BDDCS系统的分类,发现共有102种药物在已发表的BDDCS系统中有明确分类,占口服药物的71.3%。其中BDDCS第1类药物有38/102个(37.25%);另有BDDCS第2、3、4类药物31(30.39%)、22(21.57%)和10种(9.80%),见图。此外,红霉素由于不同盐基对其溶解度的影响较大,因此单独进行计算,图中以“其他”表示。由此可见,我国基本药物中符合BDDCS第1类的口服化学药物约占40%,若能对此部分药物进行评价豁免,可以节约大量的人力、物力。
, 百拇医药
加强沟通合作
应加强与相关学科部门的合作及与高校和临床药理机构的沟通。
药品的上市后再评价涉及到药物生产、流通、使用和研究等各个环节,需要多学科、多部门通力合作。我国仿制药物一致性评价工作虽然侧重在制剂评价,但涉及药物品种繁多,评价体系和指标均有不同。因此,更应当借鉴不同专业的资源和经验,高效地完成仿制药物再评价工作。《方案》中指出,拟成立仿制药物质量一致性评价工作领导小组和督察组,设立专门机构进行评价工作,有助于明确职责、细化工作内容、提高评价效率。
由于我国的仿制药物再评价工作与日本先前开展的再评价工作在内容和范围上均有不同,因此按照日本模式组建我国药品再评价的专家小组恐怕未必能适应我国的工作特点和需求。笔者建议,评价工作应建立与高校和临床药理机构的沟通平台。高等院校是纯学术机构,可以对评价方法学进行评价和完善。而医疗机构药学部门和临床药理机构具有丰富的药物使用的专业知识,随着临床药学和临床药理学的飞速发展,医疗机构药学部门和临床药理机构在药物评价中的作用越来越突显。
另外,结合我国药物再评价工作的特点,仍然有部分药物可能需要进行生物等效性试验,还需要临床药理机构的参与和支持,因此临床医生、临床药师和临床药理学专家也是不可或缺的成员,可以请他们参与对仿制药物生物等效性的评价工作。
(作者单位:北京大学第三医院药剂科), 百拇医药(刘 维 杨 丽)



图 口服药物中不同BDDCS分类所占比例
国家食品药品监督管理局(SFDA)近日公布的《仿制药质量一致性评价工作方案(征求意见稿)》(简称《方案》),较系统地描述了仿制药物一致性评价的工作目标、方法、职责、内容、计划和工作保障等,对一致性评价的方法和流程做出了设想和规划,较明确地提出了评价工作的总体思路,对于仿制药物再评价工作具有很强的指导意义。这也体现出监管部门对规范仿制药物市场、保证公众用药安全的决心和力度,具有极大的社会意义。
《方案》指出,此次再评价工作涉及约12万种化学药物,评价工作耗时长,任务繁重。尽管做了5~10年的工作计划,相关部门平均每年仍需要对上万种药物进行评价。特别是常用的药物如氧氟沙星、甲硝唑等,单种药品的仿制药物可达上千种;对这些药物进行实验考察及材料审批,过程将是非常繁冗耗时的。因此,优化评价流程,找到合理可靠的评价指标,是再评价工作的关键。为此,笔者提出以下几点建议:
, http://www.100md.com
制定合理标准
要制定合理的一致性评价标准。
《方案》指出,将遵照“科学合理、分类开展”的原则进行评价工作,如按照药物类别和剂型分类、分步实施,是科学且高效的方式。但是仅对剂型分类是否足够?如对口服固体制剂进行溶出曲线评价,是药物再评价的重点指标,但是否所有药物的溶出曲线都可以反映体内的吸收程度,仍值得商榷。日本进行的相关质量再评价工作,主要针对难溶性药物,因此主要指标是溶出曲线和溶出曲线-体内吸收的体外体内相关性研究。但当溶出度不是药物在体内的限速步骤时,仅进行溶出曲线评价并不能反映药物在体内吸收的程度和速度。此外,对于一些体内溶解度和渗透性均较差的药物,体外指标可能无法反映体内的吸收情况,仍需要进行人体生物等效性研究。因此,还需要针对不同性质的药物确定适宜的评价方法和标准体系。
借鉴欧美经验
参考欧美仿制药物研发过程中的豁免机制,对符合标准的仿制药物进行一致性评价豁免,只进行制剂工艺评价,可以为我国仿制药物一致性评价工作节约大量的研究成本与时间。
, 百拇医药
美国食品药品管理局(FDA)、欧洲药品管理局(EMA)、世界卫生组织(WHO)自2000年起陆续开展仿制药物生物等效性豁免工作,根据药物的溶解度、渗透性/代谢程度和溶出度对药品进行考察,符合条件的仿制药被认为与原研药具有相同的生物利用度。至今,已有不少此类药品通过豁免机制上市,节约了大量社会成本与研发时间。以下笔者对欧美现行评价系统进行简要介绍,以期能为我所用。
1.生物药剂学分类系统(BCS)
该系统于1995年由Amidon等人提出,根据药物的溶解度和渗透性分为4类。其中高溶解度的定义为:在37°C,pH 1.0~7.5范围内,药物的最高使用剂量可以完全溶解于250ml或更少的介质中。高渗透性的标准是在明确药物在胃肠道内可以保持稳定的情况下,体内吸收达90%。每种药物按照不同的溶解度和渗透性,可以归为以下4类:
第1类:高溶解度-高渗透性药物,如维拉帕米、美托洛尔;
, 百拇医药
第2类:低溶解度-高渗透性药物,如环孢素、苯妥英;
第3类:高溶解度-低渗透性药物,如阿昔洛韦、西咪替丁;
第4类:低溶解度-低渗透性药物,如呋塞米、氯噻嗪。
其中第1类药物具有较高的溶解度和渗透性,吸收较好,因此如果两种口服速释制剂在不同条件下均具有相同的溶出特征,则它们将具有相同的药物吸收度。
该系统在2000年被FDA采用,作为《基于生物药剂学分类系统对口服速释固体制剂免除生物利用度和生物等效性的工业指导原则》的理论基础。根据BCS理论,非专利药品若能在体外试验中被证实具有高溶解度和高渗透性(BCS第1类),其速释制剂可以申请免除体内生物等效性研究。
根据FDA 2004~2008年的数据显示,平均每年约有600项生物等效性试验。假使能对其中的30%(BCS第1类、第3类)进行豁免,则每年可以节省上亿美元的生物等效性试验费用。
, 百拇医药
2.基于药物体内处置的生物药剂学分类系统(BDDCS)
BDDCS系统在BCS系统基础上加以改进,使用药物代谢程度作为渗透性的替代指标。代谢程度作为分类指标的优点,尤其是对于已上市的药物,就是其代谢程度是
已知参数,可以更加简便地对药物进行分类,因此特别适用于我国上市仿制药品再评价工作。该系统也于2010年被欧洲药品管理局采纳,作为渗透性的替代指标,FDA也已对其表示认可。
我国2009年版《国家基本药物处方集——化学药品和生物制品》中收录了255种化学药品和生物制品,其中涉及口服化学药物143种。我们逐个查阅药物在BDDCS系统的分类,发现共有102种药物在已发表的BDDCS系统中有明确分类,占口服药物的71.3%。其中BDDCS第1类药物有38/102个(37.25%);另有BDDCS第2、3、4类药物31(30.39%)、22(21.57%)和10种(9.80%),见图。此外,红霉素由于不同盐基对其溶解度的影响较大,因此单独进行计算,图中以“其他”表示。由此可见,我国基本药物中符合BDDCS第1类的口服化学药物约占40%,若能对此部分药物进行评价豁免,可以节约大量的人力、物力。
, 百拇医药
加强沟通合作
应加强与相关学科部门的合作及与高校和临床药理机构的沟通。
药品的上市后再评价涉及到药物生产、流通、使用和研究等各个环节,需要多学科、多部门通力合作。我国仿制药物一致性评价工作虽然侧重在制剂评价,但涉及药物品种繁多,评价体系和指标均有不同。因此,更应当借鉴不同专业的资源和经验,高效地完成仿制药物再评价工作。《方案》中指出,拟成立仿制药物质量一致性评价工作领导小组和督察组,设立专门机构进行评价工作,有助于明确职责、细化工作内容、提高评价效率。
由于我国的仿制药物再评价工作与日本先前开展的再评价工作在内容和范围上均有不同,因此按照日本模式组建我国药品再评价的专家小组恐怕未必能适应我国的工作特点和需求。笔者建议,评价工作应建立与高校和临床药理机构的沟通平台。高等院校是纯学术机构,可以对评价方法学进行评价和完善。而医疗机构药学部门和临床药理机构具有丰富的药物使用的专业知识,随着临床药学和临床药理学的飞速发展,医疗机构药学部门和临床药理机构在药物评价中的作用越来越突显。
另外,结合我国药物再评价工作的特点,仍然有部分药物可能需要进行生物等效性试验,还需要临床药理机构的参与和支持,因此临床医生、临床药师和临床药理学专家也是不可或缺的成员,可以请他们参与对仿制药物生物等效性的评价工作。
(作者单位:北京大学第三医院药剂科), 百拇医药(刘 维 杨 丽)