一、高密度脂蛋白胆固醇测定
血浆中脂蛋白有多种,测定其各自的含量对于了解机体正常及疾病过程中脂质代谢状况有重要的临床意义。HDL是一组不均一的脂蛋白颗粒,其胆固醇含量占血浆总胆固醇量的25%~35%。由于血浆中所有脂蛋白均含有胆固醇,因此,只有先分离出HDL才能对其进行定量。分离HDL的方法中,沉淀法是目前临床使用最多的方法,操作简便快速。沉淀法原理是利用多聚阴离子和二价阳离子共同作用于脂蛋白,并选择性地使含ApoB的VLDL和LDL脂蛋白沉淀,再测定含HDL的上清液胆固醇,即高密度脂蛋白胆固醇(HDL-C)。定量HDL全量是很困难的,因为它是蛋白质和脂类的混合物,故以测定HDL中所含胆固醇含量作为HDL定量依据。
要测定血清中HDL-C,就必需先沉淀HDL以外的脂蛋白,即VLDL和LDL。使血清中VLDL和LDL沉淀的试剂很多,常用的有四种:①肝素-锰沉淀法,该法操作简便易行,一旦遇上血脂升高的标本,有沉淀不完全的差异;②硫酸葡聚糖-镁法,该法也简单易行,试剂较贵而难买到;③聚乙二醇法,虽然简便易行,若遇高脂血症标本,其重复性差;④磷钼钨酸-镁法,操作简便易行,结果准确,是目前临床推荐使用的方法;⑤另有一种不沉淀VLDL和LDL也可直接测定HDL的方法,称之为直接测定法。其原理是,先用一种封阻血清VLDL和LDL,而不封阻HDL,当测胆固醇的酶试剂加入后,酶可作用于HDL的胆固醇进行化学反应,测出其浓度,但酶试剂就无法使已被试剂封阻的VLDL和LDL的胆固醇进行反应,这种直接法操作更为简便,无需离心等繁杂步骤,便于在自动生化分析仪上进行HDL-C测定,结果准确可靠,缺点是成本过高。下面仅介绍目前推荐使用的方法。
(一)原理
磷钨酸-镁(PTA-Mg2+)沉淀血清中含ApoB的脂蛋白(VLDL、LDL),上清液中只含HDL,用酶法测定上清液中胆固醇,即HDL-C。
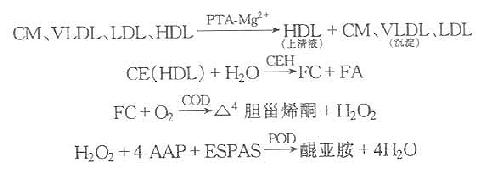
生成的醌亚胺与HDL中的CE及FC成正比。
2.试剂组成
(1)沉淀剂磷钨酸钠4g溶于50ml双蒸水中,加入1mol/l NaoH16ml,充分搅拌后,再加双水至100ml,调pH到7.6。再取40ml此溶液,加2mol/l MgCl2 10ml,混匀,再加水至100ml,此为应用液。
(2)胆固醇酶法测定试剂(同第十五章)
(3)胆固醇标准参考液(同第十五章)
3.操作
(1)空腹12h,抽取静脉血,不抗凝,分离血清备测。于24h内操作完毕。
(2)其他操作同前。
4.注意事项
(1)室温以15~20℃为宜,<15℃或>30℃时应增加或减少静置时间,离心转速要恒定一致。
(2)离心沉淀后,要立即吸出上清进行测定,否则结果偏离不准。
(3)若血清TC超过500mg/dl时,上清液会出现混浊,表明有部分胆蛋白漂浮在上清液中未沉淀完全,此时将血清稀释重新沉淀,其所测值乘以稀释倍数。
(二)血清HDL-C选择遮敝直接测定法。
1.原理
含反应抑制剂的阴离子表面活性剂加入血清中后,与CM、VLDL和LDL紧密结合,少量与HDL结合。尔后,再加入反应促进剂的聚阴离子表面活性剂后,HDL溶化并释放出胆固醇,与胆固醇测定试剂进行反应,达到仅测出高密度脂蛋白-胆固醇(HDL-C)的目的,其反应全过程为:

2.试剂(第一化学)
RⅠ:前处理液(第一反应液)
RⅡ:第二反应液(可溶性表面活性剂)及显色液
HDL-C参考血清
3.操作
按双试剂双波长法在CL-7200型全自动生化分析仪进行检测,有关参数如表16-1所示。
表16-1 HDL-C检测参数
| 名称 | 参数 |
| 分析方式 | 终点法 |
| 标本用量 | 3μl |
| RⅠ体积 | 300μl |
| RⅡ体积 | 100μl |
| 第一试剂时间 | 3~4min |
| 第二试剂时间 | 5~6min |
| 双波长 | [560][600]nm |
标本浓度按△A=A2-A1的吸光度计算
4.特点
(1)直接测定,无需预处理。
(2)操作简便,减少影响准确性的因素。
(3)标本及试剂用量少,准确性高。
(4)抗干扰能力强,适合于自动化分析。
(5)该法CV为5%以下,回收率90%~110%。线性范围(0~5.85mmol/L)。
5.注意事项
(1)待测血清标本于当日测试,2~8℃保存,一周内测定,-20℃长期保存,对测定结果无影响。
(2)干扰物维生素C 500mg/L、胆红素200mg/L、Hb5.0g/L以下均不影响测定结果。
二、血清低密度脂蛋白测定
LDL是一组不均一的脂蛋白颗粒,其胆固醇含量约占总胆固醇的45%~50%。
测定血浆中LDL,首先同样要分离LDL,其分离方法有超速离心法、聚阴离子沉淀法、色谱法、电泳法及计算法等。以聚阴离子沉淀法简便易于操作,结果准确可靠。由于直接测定LDL有一定的困难,因为它是蛋白质脂类组成的颗状结构,胆固醇是其较为衡定的因素,因此采用测定LDL中所含的胆固醇的浓度作为LDL定量的依据。
另外,还可以通过用Friedwal公式计算,主要是利用血清TC、TG及HDL-C浓度测定结果,即LDL-C=TC-HDL-C-(1/5)TG。对脂代谢异常的高脂血症,不能按此方法计算结果。
(一)聚乙烯硫酸盐(PVS)法
1.原理
 生成的醌亚胺与上清液的TC含量成正比。
生成的醌亚胺与上清液的TC含量成正比。
2.试剂组成
(1)沉淀剂:聚乙烯硫酸钾盐0.7g/L、聚乙二醇独甲醚170g/L、乙二胺四乙酸5mmol/L,混匀,4~21℃避光可保存一年。
(2)酶法胆固醇测定试剂(同第15章)。
(3)胆固醇标准液:2.58mmol/L。
3.操作
(1)空腹12h,采静脉血,3h内分离完成血清以免脂蛋白之间相互交换和防止LDL降解。-70℃可以保存数月之久。
(2)取200μl血清置于含有沉淀剂100μl试管中充分混匀,室温放置15min,3000r/min离心,留上清测定胆固醇。
(3)按下表进行操作:
| 空白管 | 测定管 | 标准管 | |
| 上清液(μl) | 30 | ||
| 定值血清(μl) | 30 | ||
| 水(μl) | 30 | ||
| 胆固醇酶试剂(μl) | 2.0 | 2.0 | 2.0 |
混匀,37℃6min,以空白管调零(500nm),读取光密度。
(4)计算

血清LDL-C=TC-上清液胆固醇
(5)注意事项
标本沉淀过程严格按要求进行。吸取上清液时,注意轻吸,别搅动沉淀。
PVS法能将Lp(α)完全沉淀,一般情况下,正常人含量极少,一旦高脂血症、Lp(α)增高时,其测定值LDL-C应为LDL-C和Lp(α)-C之和。
(二)血清LDL-C直接测定法
1.原理
含反应活性剂的试剂Ⅰ加入血清后,与HDL、VLDL和CM反应,使其胆固醇水解并与酶反应生成无色产物溶于介质中。再加入含溶解LDL的活性剂Ⅱ试剂,使LDL水解并与其中的胆固醇试剂进行偶联反应生成红色化合物,定量血清中LDL-C。
 以△A=A2-A1进行运算,测出LDL-C的含量
以△A=A2-A1进行运算,测出LDL-C的含量
2.试剂(第一化学)
R1:去垢剂1、COD、POD、4-AAP。
R2:去垢剂2、DSBmT。
3.操作
按CL-7200型或其他型号全自动生化分析仪检测,有关参数如表16-2所示。
表16-2 LDL-C检测参数
| 名称 | 参数 |
| 分析方式 | 终点法 |
| 标本用量(μl) | [3] |
| R1体积(μl) | [300] |
| R2体积(μl) | [100] |
| 第一试剂时间 | 5min |
| 第二试剂时间 | 5min |
| 波长(nm) | [560][600] |
4.特点
(1)直接测定,无需预先处理。
(2)操作简便,减少影响准确性的因素。
(3)标本及试剂用量少,准确性高。
(4)抗干扰能力强,适合于自动化分析。
(5)该法CV为5%以下,回收率90%~110%,线性范围0~88mmol/L。
5.注意事项
待测血清标本于当日测试,2~8℃一周内保存,-20℃以下长期保存,结果均不受影响。
三、高密度脂蛋白亚组份胆固醇(HDL2-C,HDL3-C)检测
聚乙二醇20000沉淀法
1.原理:
HDL中主要组份为HDL2和HDL3。用聚乙二醇20000(PEG20000)作沉淀剂,以不同浓度在不同pH条件下,可将HDL2和HDL3分离开。95g/L聚乙二醇20000在pH6.5环境下可将血清中低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)沉淀,离心后上清液中只含HDL。170g/L聚乙二醇20000在pH7.5环境中,可将LDL、VLDL、HDL2沉淀,离心后上清液中只含HDL3,以酶试剂侧定各自上清液中胆固醇含量,通过换算,计算出代表HDL各亚组分含量。
2.试剂:沉淀剂Ⅰ:95g/L PEG20000,pH6.5
沉淀剂Ⅱ:170g/L PEG20000,pH7.5。
胆固醇酶应用液及参考血清以试剂盒而定。
3.操作方法:(以生化分析仪为例)按表16-3操作
表16-3 HDL-C亚组分测定操作步骤
| 加入物 | 1管 | 2管 |
| 血清 | 100 | 100 |
| 沉淀剂Ⅰ(μl) | 200 | - |
| 沉淀剂Ⅱ(μl) | - | 200 |
置混匀器上混匀2min,置室温10min,3000r/min离心20min,上清液待测。
上清液于生化分析仪测定,测定参数参照总固醇测定法。
5.结果计算
HDL-C=上机测得结果×血清稀释倍数
HDL3-C=上机测得结果×血清稀释倍数
HDL2-C=HDL-C×HDL3
6.注意事项:
离心时间及速度一定要准确;
离心上清液混浊者应继续离心直到清亮止;
四、血清Lp(α)测定法
1.原理
血浆(清)中脂蛋白(α)(Lp(α))与Lp(α)的单克隆抗体(鼠)结合形成抗原抗体免疫复合物,有浊度改变,测定溶液界质中混浊度的光密度改变,求其血浆中Lp(α)的含量。
Lp(α)+抗人Lp(α)→抗原抗体复合物→测定光密度
2.试剂与仪器
试剂(第一化学);Lp(α)缓冲液(R1);Lp(α)抗体液(R2)。
仪器:生化分析仪(以CL-7200型为例)
3.操作方法

以△A=A2-A1进行运算Lp(α)浓度。
4.定标:
取Lp(α)定值液,用0.9%NaCl液稀释。
采用上述操作步骤,按免疫测定法定标,其操作方法及标准曲线如图16-3所示。
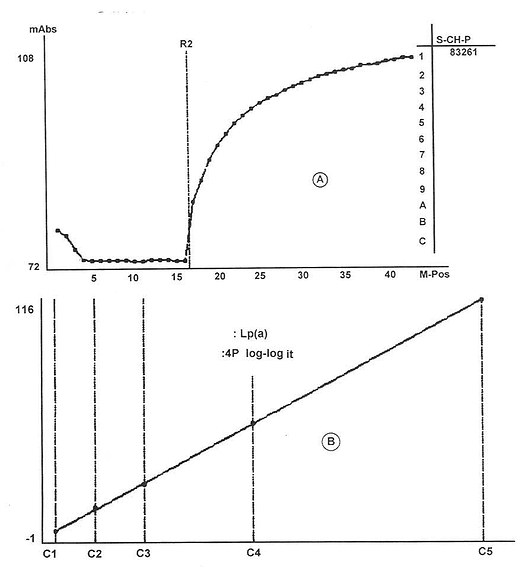
图16-3 Lp(α)免疫测定法的反应过程光密度变化值mAbs(A)及其检测的标准曲线图(B)(CL-7200型)
上机参数(以CL-72OO型为例)
| 名称 | LPA | 名称 | LPA | |
| 测定方法 | Endpoint | 标准(1) | 0.72 | |
| 标本量 | 16μl | 标准(2) | 1.44 | |
| R1试剂量 | 280μl | 标准(3) | 2.88 | |
| R2试剂量 | 40μl | 标准(4) | 5.75 | |
| 反应时间 | 第一波长 | 5min | 标准(5) | 11.5 |
| 第二波长 | 4.99min | 波长1.2 | [340][750] |
5.注意事项:
(1)操作时,标本和试剂无需处理;
(2)血浆或血清标本均可检测。标本置2~21℃保存1周不变;
(3)标本浓度超过定标最高值时,应用生理水稀释后再测;
(4)抗体试剂(R1)避免反复接触;
(5)测定时避免日光直接照射。
五、脂蛋白x 的电泳分析
1.原理
血清脂蛋白x的组成中磷脂占66%,蛋白质仅占6%,在电场中因电荷少,选择电渗大小合适的琼脂为电泳支持物,则LpX向阴极移动,而其他蛋白质向阴极移动,从而达到分离的目的。用免疫沉淀法或聚阴离子沉淀法使其在琼脂板上沉淀,对于LpX阳性的血清可以在加样孔的阴极端见到白色沉淀带。
2、试剂
巴比妥缓冲液500mmol/L:pH8.6,离子强度0.05。
1%琼脂用上述巴比妥缓冲液加热配制。
沉淀剂;每升中含MgCl20.1mol,肝素2.5g及MaCl9g。
3.仪器:电泳仪。
4.操作:
(1)制板 1%琼脂糖加热未冷却前于一洁净载玻片上均匀铺开。凝固后在一端2cm~3cm处打孔(直径约2.5mm)。
(2)电泳 将血清20μl加于小孔内(勿使外溢和有气泡)。按琼脂糖脂蛋白电泳操作、搭桥、通电1mA、40min。
(3)浆琼脂玻片浸在沉淀剂中30min后观察结果(如Lp-x阳性,数min内即出现沉淀线),Lp-x浓度到3.3mg/dl上即可出现阳性反应。
正常值:正常人血清无Lp-x带。
(储建中 吴翠华)
参考文献
1.陈保生,脂蛋白的分离提纯,见:王克勤主编,脂蛋白与动脉粥样硬化,北京人民卫生出版社,1995:24~40
2.Warnick GR,Albers JJ,Heparin,Mn++ quantition of high density lipoprotein cholesterol .Clin Chem,1978,24:900
3.Patsch J,Aune K,Gtto A ,et al .Isolation chemical characterization and bioophysical properties of three different abnormal lipoproteins:LP-X1、LP-X2and LP-X3,Jbiol Chem,1977,252:2113
4.王克勤,何锦麟,一次性密度梯度离心分离人血清VLDL、LDL、HDL2及无脂血清,生物化学杂志,1986,2:15
5.要培瑛,中华医学会检验学会因脂测定推荐方法,五,血清低密度脂蛋白固醇测定法(草案)中华升学检验杂志,1995,18:381-382
6.Kessler A,Schumacher ,M,Wood WG,Immunoluminometric assays for the quantification of apolipoprotein A I,apolipoprotein B,apolipoprtein C Ⅱ,apolipoprtein (a) and lipoprotein(a),Eur J Clin Chem Clin Biochem,1994,32:127
7.Marcovina SM ,Albers JJ,Gabel B,et al .Effect of the number of apolipoprotein(a) kringle 4 domains of immunochemical measurements of lipoproten(a) ,Clin Chem,1995,41:246-248
8.李健斋,董军,以载脂蛋白组成作脂蛋白颗粒分类,中华医学检验杂志,1995,18:329-322
9.陈薇,胡汉宁,杨佳,915名正常人血清脂蛋白(a)水平的测定,医学新知杂志,1995,5:111-112。
10.张文武,洪嘉玲,许春玲,一种分离人血浆Lp(α)的简便方法,生物化学与生物物理学进展,1993,20:294-297
11.Mcvicar JP,Kunitake ST,Hamilton RL ,et al Characterization of human lipoproteins isolated by selected affinity immunosorption of apolipoprotein AI ,Proc Natl Acad Sci USA,1984,81:1356
12.Wlicox H,Heimberg M,Isolation of plasma lipoproteins by zonal ultracentrifugatino in the B14 and B15 titanium roters.J Lipid Res,1970,11:7
, http://www.100md.com