高尿酸血症肾损害
概述
随着我国经济水平的不断提高,国民饮食结构中动物蛋白的比例在不断增加,而高尿酸血症的人群也在日益增多。虽然国内尚无大规模的临床统计数字,根据发达国家的高尿酸血症者的比例--正常人群的5%左右,估计我国高尿酸血症人群的比例应接近这一数值。
同时我们也越来越多的发现,临床上肾功能异常和心血管疾病患者多伴有高尿酸血症。国外近年来做了多个高尿酸血症与心血管系统关系的大规模临床调查,现在基本上可以肯定高尿酸血症是心血管系统疾病的独立危险因素。但高尿酸血症是否能够导致肾脏疾病一直有争议。
越来越多的证据表明,高尿酸血症会加速肾功能衰竭的速度,但具体的机制还不清楚。最近的一个对6403名患者的临床观察中发现,血尿酸水平是肾功能异常的独立危险因素,而且其风险甚至高于尿蛋白量。我们也发现很多肾脏病患者,在疾病的早期就有尿酸的明显增高。在我们对IgA患者的调查统计时发现该人群患高尿酸血症似乎更为多见。
, http://www.100md.com
很多研究也证实,氧化应激在肾脏疾病中起着非常重要的作用。尿酸在细胞培养实验中可直接刺激细胞的增殖,在体内则可导致血压升高、肾间质纤维化。
为阐明尿酸水平与肾脏疾病间的关系,国外近期建立了高尿酸血症的大鼠模型,使这方面的研究得以进展。该模型可使大鼠血尿酸水平增加3倍以上,而无肾内的尿酸沉积。大鼠出现高血压、入球小动脉增厚、轻度肾间质纤维化、间质胶原沉积和巨噬细胞浸润,这些都与人高尿酸血症时的肾脏表现相似。
最近Hitoshi Endou等根据尿酸在体内为阴离子这一特性,在人基因组里进行了与阴离子转运蛋白相似基因的全面搜索,在染色体11q13上发现了一个可能是尿酸转运蛋白的基因(SLC22A12)。作者将其命名为URAT1, 共有2,642个碱基,与阴离子转运蛋白4(OAT4)有42%的同源性,有12个跨膜区。而且该蛋白只存在于近端肾小管。
现在已发现,特发性低尿酸血症的患者在SLC22A12基因的第四号外显子的774碱基处有一G->A的突变,使该位置的色氨酸(TGG)变成了终止密码子(TAG),导致了该转运蛋白功能的丧失,无法重吸收尿酸,出现低尿酸血症。外显子3的第650个碱基由C-> T 以及外显子5第894个碱基G-> T的错义突变,也会使患者出现低尿酸血症。尿酸转运相关基因的克隆成功,揭示了尿酸在肾脏的排泄和分泌,以及临床上血尿酸水平异常的分子机制,使我们有可能在分子水平对尿酸代谢进行调控。
, 百拇医药
病因与发病机制尿酸是嘌呤的代谢终产物。在人类进化过程中,尿酸酶基因的突变,使人类失去了将尿酸分解为溶解度更高的尿囊素的能力。因此,人类只能靠肾脏及小肠将尿酸排出体外。人体尿酸主要来源于细胞核蛋白,占体内总尿酸来源的80%,并只在含有黄嘌呤氧化酶的肝脏和小肠中产生;外源性尿酸是由摄入的动物性、或其它富含嘌呤的食物分解代谢所产生,占尿酸来源的20%。尿酸为一种弱酸,pKas 为 5.75,结合为盐的形式则为10.3。
正常成年人体内尿酸池的平均水平大约1.2g,生理条件下(pH=7.4),血浆、细胞外液及滑膜液中98%的尿酸以阴离子及尿酸钠盐形式存在,5%左右的尿酸与血浆蛋白结合,后者无明显的生理作用。血中尿酸单钠盐形势的饱和浓度为415 umol/L (6.8 mg/dL),但有时达到4800 umol/L (80 mg/dL)也不出现沉淀,这与血中存在的增加尿酸溶解度的物质有关。
尿酸在尿液中的溶解度比水高,这可能是由于尿液中其它成分的影响,比如尿素、蛋白质和焦磷酸盐等。尿pH值对尿酸的溶解度有较大影响,当pH=5.0时,尿酸饱和度为360-900 umol/L(6-15mg/dL),而pH=7.0时尿酸饱和度可达到12,000 umol/L (200mg/dl)。一般认为血尿酸水平大于6.5或7.0 mg/dl(男性);大于6.0或6.5mg/dl(女性)可诊断为高尿酸血症。
, 百拇医药
人体每日生成并排泄的尿酸约600~700mg,其中1/3的尿酸通过肠道排泄,另2/3经肾脏随尿液排出。尿酸在肾脏的排泄方式通常认为是经如下四步完成的:
(1)肾小球的滤过(100%);
(2)肾小管的重吸收(98~100%);
(3)肾小管的再分泌(50%);
(4)分泌后的再次重吸收(40%),最后8~12%的由肾小球滤过的尿酸排出体外。
虽然有人对该方式提出置疑,但目前还被广泛采用。
血尿酸水平的增高无外乎三种原因,尿酸产生过多、排泄减少或两种因素共存。肾脏清除减少的缺陷比单纯血清尿酸水平增高更为常见。
, 百拇医药 一、尿酸产生过多
1、 嘌呤摄入过多:血清尿酸含量与食物内嘌呤含量成正比。摄入的食物内RNA的50%,DNA的25%都要在尿中以尿酸的形式排泄,严格限制嘌呤摄入量可使血清尿酸含量降至60umol/L(1.0mg/dL),而尿内尿酸的分泌降至1.2mmol/d(200mg/d)。
2、 内源性嘌呤产生过多:内源性嘌呤代谢紊乱较外源性因素更为重要。嘌呤由非环状到环状的从头合成过程要经过11步反应,其中酶的异常多会导致嘌呤合成过多。目前已经发现的有:
1)磷酸核糖焦磷酸(PRPP)合成酶活性增加
2)次黄嘌呤-鸟嘌呤磷酸核糖转换酶(HGPRT)缺乏
3)葡萄糖6-磷酸酶缺乏。
3、 嘌呤代谢增加:如慢性溶血性贫血、横纹肌溶解、红细胞增多症、骨髓增生性疾病及化疗或放疗时。过度运动、癫痫状态、糖原贮积症的III、V、VII型,都可加速肌肉ATP的降解。心肌梗塞、吸烟、急性呼吸衰竭也与APT加速降解有关。
, 百拇医药
二、肾清除尿酸减少
持续高尿酸血症的患者中90%有肾处理尿酸功能的异常。在高尿酸血症并有痛风的患者中,给予其不同的尿酸负荷,其尿酸盐清除与肾小球滤过率的比值要低于正常人群。尿酸分泌的减少可能与肾小球滤过率的降低,肾小管分泌减少或肾小管重吸收有关。
虽然高尿酸血症在慢性肾病中总是存在,但血尿酸浓度与血肌酐、血尿素氮之间的关系还不清楚。随着肾功能的减退,每单位肾小球的尿酸分泌量是增加的,但肾小管的分泌能力基本不变,肾小管的重吸收能力也是降低的,肾外尿酸的清除能力明显增加。 1、肾小管分泌受抑制:最为重要的机制之一。由于药物、中毒、或内源性代谢产物抑制尿酸排泄和/或再吸收增加。当阴离子转运系统受抑制时会出现这种情况,其中两个重要的抑制因子是乳酸和酮酸类( -羟基丁酸、乙酰乙酸)。干预这个转运系统会导致尿酸水平的急性变化。乳酸产生增加可见于剧烈运动或饮酒之后,而禁食后乳酸及酮酸均会产生增加。糖尿病的酮症酸中毒、饥饿、酒精中毒、水杨酸中毒都伴有有机酸的积聚,它们与尿酸竞争肾小管的分泌。
, 百拇医药
2、肾小管重吸收增多:高尿酸血症也可由于距分泌位置的远端重吸收的增强导致。这些可见于糖尿病脱水或利尿治疗的时候。
3、肾小球滤过减少:也可使血尿酸水平增高。其中之一的机制是滤过率降低,这是肾功能不全或衰竭的高尿酸血症的主要原因。尿酸净重吸收增加可发生在容量降低的情况下,这是利尿剂引起高尿酸血症的机制之一。
三、两种因素同时存在
很多患者是尿酸产生增加和排泄减少两种因素同时存在的。如葡萄糖6-磷酸酶缺乏症、遗传性乳糖不耐受的患者。酒精也可通过两种途径使尿酸潴留。过度酒精摄入加速肝脏降解ATP,增加尿酸的产出。酒精导致的高乳酸血症也阻止了尿酸的排泌。高嘌呤含量的酒精饮料如啤酒也是重要因素。
病理表现
高尿酸血症主要引起三种肾脏病变:
, http://www.100md.com
1)尿酸盐性肾病:长期但不严重的高尿酸血症患者易出现肾脏的小管间质的慢性病变。有时也叫痛风性肾病。其严重程度与血尿酸升高的持续时间和幅度有关。
慢性高尿酸血症可导致尿酸晶体主要在远端集合管和肾间质沉积,尤其在肾髓质和乳头区。镜下可见尿酸和单钠尿酸盐在肾实质内沉积。间质尿酸结晶来源于集合管。这些结晶体形成核心,周围有白细胞、巨嗜细胞浸润及纤维物质包裹。这种标志性组织学改变称为痛风石。经典的痛风性肾病,痛风石在皮髓交界处及髓质深部沉积。
在有长期痛风病史的患者中,肾脏不仅表现为痛风石形成,而且还伴有纤维形成、肾小球硬化、动脉硬化及动脉壁增厚。但后面的这些改变是非特异的,在其他一些肾脏疾病中也可见到,如高血压病及间质性肾炎。
2)尿酸性肾病:由短时间内大量尿酸结晶堆积于肾脏集合管、肾盂和输尿管所导致。由于尿液中尿酸浓度骤然增高形成过饱和状态。
, http://www.100md.com
显微镜下可见管腔内尿酸结晶的沉积,形成晶体或呈雪泥样沉积物。可阻塞肾小管,近端肾小管扩张,而肾小球结构是正常的。这种肾病通常是可逆的。这些沉积物导致梗阻及急性肾衰。间质纤维化及痛风石通常不会出现。如果得到恰当的治疗,肾功能可恢复正常。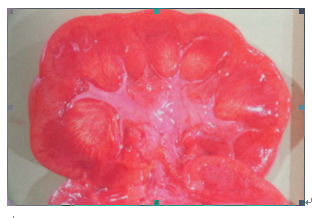
3)肾结石:镜下可见尿酸结晶在肾乳头和集合管内沉积。
临床表现及诊断
一般轻、中度的高尿酸血症是没有明显临床症状的。临床症状一般出现在急性血尿酸增高而导致肾功能异常者,如化疗引起的急性高尿酸血症出现的肾功能衰竭。
, 百拇医药
慢性高尿酸血症出现临床症状者以痛风最为常见。化验血尿酸水平很容易诊断。但如需区别由何种原因导致,则需检测尿尿酸的排泄量及酸碱度,询问家族史及饮食习惯。相关酶异常则需基因检测。
治疗
1、无症状的高尿酸血症:对于血尿酸轻度增高(7-10mg/dl)的无症状患者是否给予积极治疗仍有争议。虽然很多临床资料表明高尿酸血症可导致心血管疾病,并加速肾功能异常。但大多数临床医生对高尿酸血症的治疗持保守态度。
我们主张尽量首先用非药物方法将尿酸水平控制在正常范围。如多喝水,避免服用利尿剂和高嘌呤饮食。 对钠-水依赖型高血压患者,使用利尿剂治疗的同时,应严密监测肾功能(尿液分析,Ccr)及血尿酸水平的变化,并建议伍用ACEI或AT2受体拮抗剂保护肾功能。尤其是目前广泛应用的氯沙坦,发现该药物除可降低血压外,还有促尿酸排泄的功能。其机理可能是与尿酸竞争转运。
, http://www.100md.com
2、慢性高尿酸血症患者:对于血尿酸水平>600umol/L(10mg/dl,女性),>780umol/L(13mg/dl,男性)的患者应给予降尿酸治疗,特别是经常出现痛风症状者。别嘌呤醇仍为首选药物。别嘌呤醇通过抑制黄嘌呤氧化酶来降低尿酸,继而使嘌呤的从头合成也降低。它的主要活性代谢产物oxypurinol的半衰期很长(约28小时),也是对维持效果起主要作用的。
对于痛风患者,用药前几个月痛风的发作次数可能要增加(可以用秋水仙碱预防),12-18个月后,发作次数会降低与利尿酸剂相比,别嘌呤醇减少尿内尿酸量,对于肾衰导致的高尿酸血症以及控制结石方面,都有很好的作用,而且它的作用不受水杨酸的阻断。在肾功能不全的时候,由于其活性代谢产物的半衰期延长,别嘌呤醇的用量也要减少。
在极个别情况下,别嘌呤醇导致的黄嘌呤尿会引发黄嘌呤性肾结石,尤其在HPGRT不全患者进行白血病化疗时。大多数人可很好地耐受别嘌呤醇,但也会有人有腹泻等胃肠道的症状,或者皮疹。约0.4%的患者会出现严重的过敏反应,使肾功能受损,或者出现肝炎。
, 百拇医药
也有人出现严重的皮肤损伤,有肾功能减退的患者的风险更大,尤其是没有调整用药量的时候。如果血尿酸水平能够保持在小于360umol/L,一些痛风结节将溶解,骨侵蚀也会减轻。以前也有些必需使用别嘌呤醇的患者采取脱敏的方法服用。
预防
由于饮食中的嘌呤含量对血尿酸水平影响非常大,因此,严格控制高嘌呤食物的摄入是非常重要的。我们常吃的食物种类繁多,对每种食品都进行嘌呤含量测试很难做到,而且各家测得的数据差异较大,所以只根据食品中嘌呤含量进行分类并不十分准确。
一般认为动物内脏、肉汤(长时间炖肉使大部分嘌呤进入汤中)、啤酒等嘌呤含量最高,其次包括大部分鱼类、贝类、肉食及禽类。蔬菜中以芦笋、菜花、四季豆、菜豆、菠菜、蘑菇、花生等含量较多。而奶、蛋、米及面制品和其他大部分蔬菜嘌呤含量较低。
蔬菜水果多属碱性食物,可以增加体内碱储量,使体液pH值升高。关节液中pH值上升至6以上时,尿酸多呈游离状态,很少形成尿酸盐结晶。尿液pH值升高,可防止尿酸结晶形成和促使其溶解,增加尿酸的排出量,防止形成结石或使已形成的结石溶解。
, 百拇医药
不少蔬菜水果中含有少量的钾元素,钾可以促进肾脏排出尿酸,减少尿盐沉积。另外要注意多喝水。血尿酸与体重指数呈正相关,因此,应节制每日的进食总热量。控制每天饮食中的总热量、减轻体重。痛风病人的饮食以控制在正常人食量的80%左右为妥,严禁暴饮暴食。
参考文献
1 Robert L. Wortmann.DISORDERS OF PURINE AND PYRIMIDINE METABOLISM. In: Eugene Braunwald,Anthony S. Fauci, Dennis L. Kaspereds. HARRISON'S PRINCIPLES OF INTERNAL MEDICINE. 5TH ED. McGraw-Hill Professional: 2001:347-351
2 DUK-HEE KANG,TAKAHIKO NAKAGAWA,LILI FENG. A Role for Uric Acid in the Progression of Renal Disease. J Am Soc Nephrol,2002; 13: 2888-2897
, 百拇医药
3)LAURA G. SA′,NCHEZ-LOZADA,EDILIA TAPIA,Mild hyperuricemia induces glomerular hypertension in normal rats. Am J Physiol Renal Physiol,2002;283: F1105-F1110.
4 Susumu Watanabe, Duk-Hee Kang, Lili Feng. Uric Acid, Hominoid Evolution, and the Pathogenesis of Salt-Sensitivity. Hypertension,2002;40:355-360.
5 Michael S. Hershfield. GOUT AND URIC ACID METABOLISM. In:Goldman: Cecil Textbook of Medicine, 21st ed. Saunders Company, 2000: 1542-1548.
6 Manisha Ghei, Mihaela Mihailescu, Dennis Levinson.Pathogenesis of Hyperuricemia:Recent Advances. Current Rheumatology Reports,2002; 4:270-274, 百拇医药( 陈香美 吴镝)
随着我国经济水平的不断提高,国民饮食结构中动物蛋白的比例在不断增加,而高尿酸血症的人群也在日益增多。虽然国内尚无大规模的临床统计数字,根据发达国家的高尿酸血症者的比例--正常人群的5%左右,估计我国高尿酸血症人群的比例应接近这一数值。
同时我们也越来越多的发现,临床上肾功能异常和心血管疾病患者多伴有高尿酸血症。国外近年来做了多个高尿酸血症与心血管系统关系的大规模临床调查,现在基本上可以肯定高尿酸血症是心血管系统疾病的独立危险因素。但高尿酸血症是否能够导致肾脏疾病一直有争议。
越来越多的证据表明,高尿酸血症会加速肾功能衰竭的速度,但具体的机制还不清楚。最近的一个对6403名患者的临床观察中发现,血尿酸水平是肾功能异常的独立危险因素,而且其风险甚至高于尿蛋白量。我们也发现很多肾脏病患者,在疾病的早期就有尿酸的明显增高。在我们对IgA患者的调查统计时发现该人群患高尿酸血症似乎更为多见。
, http://www.100md.com
很多研究也证实,氧化应激在肾脏疾病中起着非常重要的作用。尿酸在细胞培养实验中可直接刺激细胞的增殖,在体内则可导致血压升高、肾间质纤维化。
为阐明尿酸水平与肾脏疾病间的关系,国外近期建立了高尿酸血症的大鼠模型,使这方面的研究得以进展。该模型可使大鼠血尿酸水平增加3倍以上,而无肾内的尿酸沉积。大鼠出现高血压、入球小动脉增厚、轻度肾间质纤维化、间质胶原沉积和巨噬细胞浸润,这些都与人高尿酸血症时的肾脏表现相似。
最近Hitoshi Endou等根据尿酸在体内为阴离子这一特性,在人基因组里进行了与阴离子转运蛋白相似基因的全面搜索,在染色体11q13上发现了一个可能是尿酸转运蛋白的基因(SLC22A12)。作者将其命名为URAT1, 共有2,642个碱基,与阴离子转运蛋白4(OAT4)有42%的同源性,有12个跨膜区。而且该蛋白只存在于近端肾小管。
现在已发现,特发性低尿酸血症的患者在SLC22A12基因的第四号外显子的774碱基处有一G->A的突变,使该位置的色氨酸(TGG)变成了终止密码子(TAG),导致了该转运蛋白功能的丧失,无法重吸收尿酸,出现低尿酸血症。外显子3的第650个碱基由C-> T 以及外显子5第894个碱基G-> T的错义突变,也会使患者出现低尿酸血症。尿酸转运相关基因的克隆成功,揭示了尿酸在肾脏的排泄和分泌,以及临床上血尿酸水平异常的分子机制,使我们有可能在分子水平对尿酸代谢进行调控。
, 百拇医药
病因与发病机制尿酸是嘌呤的代谢终产物。在人类进化过程中,尿酸酶基因的突变,使人类失去了将尿酸分解为溶解度更高的尿囊素的能力。因此,人类只能靠肾脏及小肠将尿酸排出体外。人体尿酸主要来源于细胞核蛋白,占体内总尿酸来源的80%,并只在含有黄嘌呤氧化酶的肝脏和小肠中产生;外源性尿酸是由摄入的动物性、或其它富含嘌呤的食物分解代谢所产生,占尿酸来源的20%。尿酸为一种弱酸,pKas 为 5.75,结合为盐的形式则为10.3。
正常成年人体内尿酸池的平均水平大约1.2g,生理条件下(pH=7.4),血浆、细胞外液及滑膜液中98%的尿酸以阴离子及尿酸钠盐形式存在,5%左右的尿酸与血浆蛋白结合,后者无明显的生理作用。血中尿酸单钠盐形势的饱和浓度为415 umol/L (6.8 mg/dL),但有时达到4800 umol/L (80 mg/dL)也不出现沉淀,这与血中存在的增加尿酸溶解度的物质有关。
尿酸在尿液中的溶解度比水高,这可能是由于尿液中其它成分的影响,比如尿素、蛋白质和焦磷酸盐等。尿pH值对尿酸的溶解度有较大影响,当pH=5.0时,尿酸饱和度为360-900 umol/L(6-15mg/dL),而pH=7.0时尿酸饱和度可达到12,000 umol/L (200mg/dl)。一般认为血尿酸水平大于6.5或7.0 mg/dl(男性);大于6.0或6.5mg/dl(女性)可诊断为高尿酸血症。
, 百拇医药
人体每日生成并排泄的尿酸约600~700mg,其中1/3的尿酸通过肠道排泄,另2/3经肾脏随尿液排出。尿酸在肾脏的排泄方式通常认为是经如下四步完成的:
(1)肾小球的滤过(100%);
(2)肾小管的重吸收(98~100%);
(3)肾小管的再分泌(50%);
(4)分泌后的再次重吸收(40%),最后8~12%的由肾小球滤过的尿酸排出体外。
虽然有人对该方式提出置疑,但目前还被广泛采用。
血尿酸水平的增高无外乎三种原因,尿酸产生过多、排泄减少或两种因素共存。肾脏清除减少的缺陷比单纯血清尿酸水平增高更为常见。
, 百拇医药 一、尿酸产生过多
1、 嘌呤摄入过多:血清尿酸含量与食物内嘌呤含量成正比。摄入的食物内RNA的50%,DNA的25%都要在尿中以尿酸的形式排泄,严格限制嘌呤摄入量可使血清尿酸含量降至60umol/L(1.0mg/dL),而尿内尿酸的分泌降至1.2mmol/d(200mg/d)。
2、 内源性嘌呤产生过多:内源性嘌呤代谢紊乱较外源性因素更为重要。嘌呤由非环状到环状的从头合成过程要经过11步反应,其中酶的异常多会导致嘌呤合成过多。目前已经发现的有:
1)磷酸核糖焦磷酸(PRPP)合成酶活性增加
2)次黄嘌呤-鸟嘌呤磷酸核糖转换酶(HGPRT)缺乏
3)葡萄糖6-磷酸酶缺乏。
3、 嘌呤代谢增加:如慢性溶血性贫血、横纹肌溶解、红细胞增多症、骨髓增生性疾病及化疗或放疗时。过度运动、癫痫状态、糖原贮积症的III、V、VII型,都可加速肌肉ATP的降解。心肌梗塞、吸烟、急性呼吸衰竭也与APT加速降解有关。
, 百拇医药
二、肾清除尿酸减少
持续高尿酸血症的患者中90%有肾处理尿酸功能的异常。在高尿酸血症并有痛风的患者中,给予其不同的尿酸负荷,其尿酸盐清除与肾小球滤过率的比值要低于正常人群。尿酸分泌的减少可能与肾小球滤过率的降低,肾小管分泌减少或肾小管重吸收有关。
虽然高尿酸血症在慢性肾病中总是存在,但血尿酸浓度与血肌酐、血尿素氮之间的关系还不清楚。随着肾功能的减退,每单位肾小球的尿酸分泌量是增加的,但肾小管的分泌能力基本不变,肾小管的重吸收能力也是降低的,肾外尿酸的清除能力明显增加。 1、肾小管分泌受抑制:最为重要的机制之一。由于药物、中毒、或内源性代谢产物抑制尿酸排泄和/或再吸收增加。当阴离子转运系统受抑制时会出现这种情况,其中两个重要的抑制因子是乳酸和酮酸类( -羟基丁酸、乙酰乙酸)。干预这个转运系统会导致尿酸水平的急性变化。乳酸产生增加可见于剧烈运动或饮酒之后,而禁食后乳酸及酮酸均会产生增加。糖尿病的酮症酸中毒、饥饿、酒精中毒、水杨酸中毒都伴有有机酸的积聚,它们与尿酸竞争肾小管的分泌。
, 百拇医药
2、肾小管重吸收增多:高尿酸血症也可由于距分泌位置的远端重吸收的增强导致。这些可见于糖尿病脱水或利尿治疗的时候。
3、肾小球滤过减少:也可使血尿酸水平增高。其中之一的机制是滤过率降低,这是肾功能不全或衰竭的高尿酸血症的主要原因。尿酸净重吸收增加可发生在容量降低的情况下,这是利尿剂引起高尿酸血症的机制之一。
三、两种因素同时存在
很多患者是尿酸产生增加和排泄减少两种因素同时存在的。如葡萄糖6-磷酸酶缺乏症、遗传性乳糖不耐受的患者。酒精也可通过两种途径使尿酸潴留。过度酒精摄入加速肝脏降解ATP,增加尿酸的产出。酒精导致的高乳酸血症也阻止了尿酸的排泌。高嘌呤含量的酒精饮料如啤酒也是重要因素。
病理表现
高尿酸血症主要引起三种肾脏病变:
, http://www.100md.com
1)尿酸盐性肾病:长期但不严重的高尿酸血症患者易出现肾脏的小管间质的慢性病变。有时也叫痛风性肾病。其严重程度与血尿酸升高的持续时间和幅度有关。
慢性高尿酸血症可导致尿酸晶体主要在远端集合管和肾间质沉积,尤其在肾髓质和乳头区。镜下可见尿酸和单钠尿酸盐在肾实质内沉积。间质尿酸结晶来源于集合管。这些结晶体形成核心,周围有白细胞、巨嗜细胞浸润及纤维物质包裹。这种标志性组织学改变称为痛风石。经典的痛风性肾病,痛风石在皮髓交界处及髓质深部沉积。
在有长期痛风病史的患者中,肾脏不仅表现为痛风石形成,而且还伴有纤维形成、肾小球硬化、动脉硬化及动脉壁增厚。但后面的这些改变是非特异的,在其他一些肾脏疾病中也可见到,如高血压病及间质性肾炎。

2)尿酸性肾病:由短时间内大量尿酸结晶堆积于肾脏集合管、肾盂和输尿管所导致。由于尿液中尿酸浓度骤然增高形成过饱和状态。
, http://www.100md.com
显微镜下可见管腔内尿酸结晶的沉积,形成晶体或呈雪泥样沉积物。可阻塞肾小管,近端肾小管扩张,而肾小球结构是正常的。这种肾病通常是可逆的。这些沉积物导致梗阻及急性肾衰。间质纤维化及痛风石通常不会出现。如果得到恰当的治疗,肾功能可恢复正常。

3)肾结石:镜下可见尿酸结晶在肾乳头和集合管内沉积。

临床表现及诊断
一般轻、中度的高尿酸血症是没有明显临床症状的。临床症状一般出现在急性血尿酸增高而导致肾功能异常者,如化疗引起的急性高尿酸血症出现的肾功能衰竭。
, 百拇医药
慢性高尿酸血症出现临床症状者以痛风最为常见。化验血尿酸水平很容易诊断。但如需区别由何种原因导致,则需检测尿尿酸的排泄量及酸碱度,询问家族史及饮食习惯。相关酶异常则需基因检测。
治疗
1、无症状的高尿酸血症:对于血尿酸轻度增高(7-10mg/dl)的无症状患者是否给予积极治疗仍有争议。虽然很多临床资料表明高尿酸血症可导致心血管疾病,并加速肾功能异常。但大多数临床医生对高尿酸血症的治疗持保守态度。
我们主张尽量首先用非药物方法将尿酸水平控制在正常范围。如多喝水,避免服用利尿剂和高嘌呤饮食。 对钠-水依赖型高血压患者,使用利尿剂治疗的同时,应严密监测肾功能(尿液分析,Ccr)及血尿酸水平的变化,并建议伍用ACEI或AT2受体拮抗剂保护肾功能。尤其是目前广泛应用的氯沙坦,发现该药物除可降低血压外,还有促尿酸排泄的功能。其机理可能是与尿酸竞争转运。
, http://www.100md.com
2、慢性高尿酸血症患者:对于血尿酸水平>600umol/L(10mg/dl,女性),>780umol/L(13mg/dl,男性)的患者应给予降尿酸治疗,特别是经常出现痛风症状者。别嘌呤醇仍为首选药物。别嘌呤醇通过抑制黄嘌呤氧化酶来降低尿酸,继而使嘌呤的从头合成也降低。它的主要活性代谢产物oxypurinol的半衰期很长(约28小时),也是对维持效果起主要作用的。
对于痛风患者,用药前几个月痛风的发作次数可能要增加(可以用秋水仙碱预防),12-18个月后,发作次数会降低与利尿酸剂相比,别嘌呤醇减少尿内尿酸量,对于肾衰导致的高尿酸血症以及控制结石方面,都有很好的作用,而且它的作用不受水杨酸的阻断。在肾功能不全的时候,由于其活性代谢产物的半衰期延长,别嘌呤醇的用量也要减少。
在极个别情况下,别嘌呤醇导致的黄嘌呤尿会引发黄嘌呤性肾结石,尤其在HPGRT不全患者进行白血病化疗时。大多数人可很好地耐受别嘌呤醇,但也会有人有腹泻等胃肠道的症状,或者皮疹。约0.4%的患者会出现严重的过敏反应,使肾功能受损,或者出现肝炎。
, 百拇医药
也有人出现严重的皮肤损伤,有肾功能减退的患者的风险更大,尤其是没有调整用药量的时候。如果血尿酸水平能够保持在小于360umol/L,一些痛风结节将溶解,骨侵蚀也会减轻。以前也有些必需使用别嘌呤醇的患者采取脱敏的方法服用。
预防
由于饮食中的嘌呤含量对血尿酸水平影响非常大,因此,严格控制高嘌呤食物的摄入是非常重要的。我们常吃的食物种类繁多,对每种食品都进行嘌呤含量测试很难做到,而且各家测得的数据差异较大,所以只根据食品中嘌呤含量进行分类并不十分准确。
一般认为动物内脏、肉汤(长时间炖肉使大部分嘌呤进入汤中)、啤酒等嘌呤含量最高,其次包括大部分鱼类、贝类、肉食及禽类。蔬菜中以芦笋、菜花、四季豆、菜豆、菠菜、蘑菇、花生等含量较多。而奶、蛋、米及面制品和其他大部分蔬菜嘌呤含量较低。
蔬菜水果多属碱性食物,可以增加体内碱储量,使体液pH值升高。关节液中pH值上升至6以上时,尿酸多呈游离状态,很少形成尿酸盐结晶。尿液pH值升高,可防止尿酸结晶形成和促使其溶解,增加尿酸的排出量,防止形成结石或使已形成的结石溶解。
, 百拇医药
不少蔬菜水果中含有少量的钾元素,钾可以促进肾脏排出尿酸,减少尿盐沉积。另外要注意多喝水。血尿酸与体重指数呈正相关,因此,应节制每日的进食总热量。控制每天饮食中的总热量、减轻体重。痛风病人的饮食以控制在正常人食量的80%左右为妥,严禁暴饮暴食。
参考文献
1 Robert L. Wortmann.DISORDERS OF PURINE AND PYRIMIDINE METABOLISM. In: Eugene Braunwald,Anthony S. Fauci, Dennis L. Kaspereds. HARRISON'S PRINCIPLES OF INTERNAL MEDICINE. 5TH ED. McGraw-Hill Professional: 2001:347-351
2 DUK-HEE KANG,TAKAHIKO NAKAGAWA,LILI FENG. A Role for Uric Acid in the Progression of Renal Disease. J Am Soc Nephrol,2002; 13: 2888-2897
, 百拇医药
3)LAURA G. SA′,NCHEZ-LOZADA,EDILIA TAPIA,Mild hyperuricemia induces glomerular hypertension in normal rats. Am J Physiol Renal Physiol,2002;283: F1105-F1110.
4 Susumu Watanabe, Duk-Hee Kang, Lili Feng. Uric Acid, Hominoid Evolution, and the Pathogenesis of Salt-Sensitivity. Hypertension,2002;40:355-360.
5 Michael S. Hershfield. GOUT AND URIC ACID METABOLISM. In:Goldman: Cecil Textbook of Medicine, 21st ed. Saunders Company, 2000: 1542-1548.
6 Manisha Ghei, Mihaela Mihailescu, Dennis Levinson.Pathogenesis of Hyperuricemia:Recent Advances. Current Rheumatology Reports,2002; 4:270-274, 百拇医药( 陈香美 吴镝)