肥胖、高血压、蛋白尿
 |
 |
 |
 |
病历摘要
患者男性,18 岁,因“持续蛋白尿20个月”于2002年8月入院。
患者于2001年1月出现无症状蛋白尿,当时测血压130/ 90 mmHg,尿常规:尿蛋白(++),尿蛋白定量2.55 g/24h,尿沉渣红细胞3 万/mk,肾功能正常。给予雷公藤多甙等治疗1年尿蛋白持续存在。入院前门诊查24小时尿蛋白3.65 g/d,尿红细胞阴性。患者自幼肥胖,12岁起血压偏高;病程中无夜尿增多、肉眼血尿,也无不规则发热、皮疹、关节痛、腹痛或黑便。无肥胖、糖尿病、高血压家族史,无长期饮酒史。
入院查体 体温36.2 ℃,脉搏75次/min,呼吸14 次/min,血压140/90 mmHg,体重98.7 kg,身高182 cm,体质指数(BMI) 29.8 kg/m2。;发育正常但肥胖。全身皮肤、黏膜无黄染未见皮疹、皮肤瘀点、瘀斑。双眼睑无水肿,巩膜无黄染。颈静脉无怒张,甲状腺无肿大。心肺检查正常。腹平软,全腹无压痛、反跳痛,未及异常包块肝、脾肋下未及,肝、肾区无叩痛,移动性浊音 - ,未闻及血管杂音。双下肢无水肿;双侧膝反射正常,病理反射未引出。眼底检查未见异常。
, 百拇医药
实验室检查 尿液检查:尿蛋白定量3.01 g/24 h正常值<0.4 g/24 h,尿蛋白谱:大分子17.2%,中分子76.3%,小分子6.5%,尿C3 7.44 mg/L,尿α2m 2.43 mg/L,尿沉渣红细胞0.8万/mk正常值<1万/mk。肾小管功能:尿NAG酶 20.3 U/g.Cr 正常值<16.5 U/g.Cr,尿RBP 4.94 mg/L正常值<0.5 mg/L; 禁水13 h 尿渗透压870 mOsm/ kg·H2O 正常值>800
mOsm/kg.H2O,尿糖阴性,尿尿酸< 500 mg/24h。肾小球滤过率Ccr109 mk/min。
血液检查 Hb 157 g/L WBC 6.4×109/L,N 0.62,L 0.28,PLT 286×109/L 。白蛋白44.7 g/L,球蛋白21.9 g/L,丙氨酸转氨酶120 U/L,天冬氨酸转氨酶46 U/L,尿素氮 4.4 mmok/L,血清肌酐0.77 mg/dk,血尿酸689μmok/L,胆固醇6.8 mmok/L,甘油三酯3.12 mmok/L,HDL-C 1.5 mmok/L;LDL-C 4.38 mmok/L,apoA-1 1.63 g/L,apoB 1.28 g/L,C反应蛋白<3.8 mg/L。糖化血红蛋白4.3 %,空腹血糖4.0 mmok/L,餐后2 h 血糖6.1 mmok/L,糖耐量试验:空腹血糖5.1 mmok/L 2h血糖7.1 mmok/L 。空腹:胰岛素20.8 mU/L正常值5~20 mU/L,C 肽 1.15 nmok/L正常值0.26~1.15 nmok/L,游离胰岛素17.7 mU/L正常值5~20 mU/L。自身抗体及可提取性核抗原(ENA)多肽抗体谱、抗中性粒细胞胞浆抗体均阴性。免疫球蛋白及补体,乙肝、丙肝标志物均阴性。
, 百拇医药
影像学检查 双肾B 超:左肾116 mm×51 mm×56 mm;右肾105 mm×48 mm×54 mm,双肾体积增大,结构正常。心电图:窦性心律,左心室高电压。肝胆胰脾B超示脂肪肝。X线胸片检查未见异常,心影无增大。
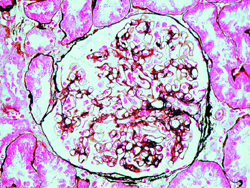
肾活检病理结果(图1,图2) 光镜下见1条皮髓组织,共12个肾小球,1个球呈节段硬化性改变。 所有肾小球体积均明显增大,正切肾小球表面积在36038~41015 μm2正常值20561±974 μm2,细胞数120~130 个/球,系膜区轻度增宽,少数系膜区中度增宽,系膜细胞、基质增生,血管袢开放尚好。肾小囊囊壁增厚、节段分层,1个小球囊壁分层明显。小管-间质病变轻至中度,可见散在小管基膜增厚,部分小管浊肿、肥大,灶性小管萎缩,管腔中可见蛋白管型,间质小灶性细胞浸润。血管未见异常。免疫荧光检查:IgM 少量,呈颗粒状分布于肾小球系膜区及血管袢。
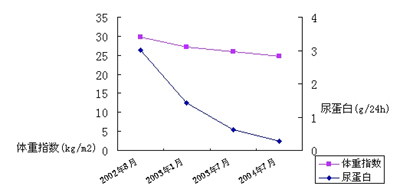
治疗及转归 根据患者的临床表现及上述检查结果,初步诊断为肥胖相关性肾病,即嘱患者控制饮食、增加运动,同时给予血管紧张素转换酶抑制剂ACEI、血管紧张素受体拮抗剂ARB及炎黄保肾胶囊大黄酸制剂。治疗5个月后门诊随访,患者体重下降至90 kg,BMI 27.2
, http://www.100md.com
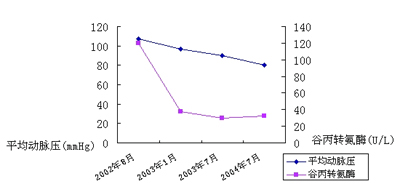
kg/m2,尿蛋白降至1.43 g/24 h,血压 132/80 mmHg,转氨酶恢复正常,血脂降至正常范围,尿酸465 μmok/L。治疗1年后门诊随访患者体重下降至86 kg,BMI 26 kg/
m2,血压 120/75 mmHg,尿蛋白降至0.62 g/24 h,转氨酶仍正常,血脂正常。治疗2年后门诊随访,患者体重下降至82 kg,BMI 24.8 kg/
m2,血压 115/61 mmHg 尿蛋白完全转阴,肾功能正常 尿酸471 μmok/L。患者近2年BMI和尿蛋白变化见表1;血压、肝功能的变化见表2。
表1
患者治疗随访期间体质指数与尿蛋白的变化
表2
患者治疗随访期间血压与肝功能的变化
, 百拇医药
诊断分析
患者为18岁男性,具有以下临床特点: ①自幼体形肥胖,BMI 超过肥胖标准,伴高血压; ②存在明显的脂质代谢异常,突出表现为血甘油三酯、LDL 升高; ③空腹及餐后血糖均在正常范围,糖耐量试验正常但伴有高胰岛素血症; ④血尿酸明显升高; ⑤有大量蛋白尿,但临床上却无明显水肿及低蛋白血症,尿蛋白谱以中分子为主,不伴镜下血尿,肾小管功能检查基本正常; ⑥肾活检病理提示明显的肾小球体积增大伴一处节段硬化性改变,免疫荧光检查免疫复合物沉积很少,仅为IgM;⑦肝脏表现为脂肪肝和肝酶升高。
患者临床表现为肥胖、高血压、蛋白尿,病理改变突出地表现为肾小球体积增大,仅有一个肾小球伴节段硬化性改变。需考虑以下一些疾病:
1. 糖尿病肾病
患者除肥胖外,存在明显的胰岛素抵抗综合征,但空腹、餐后血糖,糖化血红蛋白,糖耐量试验均正常,糖尿病诊断不成立。因此,由糖尿病所致肾小球肥大的可能性亦不存在。
, 百拇医药
2. 高血压引起的肾脏损害
患者血压偏高多年,虽然尿蛋白在2~3 g/24 h ,但尿蛋白谱分析显示以中分子为主,尤其是反映肾小管间质损伤的指标尿NAG酶、尿RBP、尿渗量 接近正常。眼底检查和心电图改变亦不符合高血压Ⅲ期的改变。特别是肾活检病理检查并未见高血压所致肾脏损伤的特征性血管病变及肾小球缺血性改变。故不支持高血压所致肾脏损伤。
3. 特发性局灶节段性肾小球硬化
特发性局灶节段肾小球硬化FSGS的临床表现为肾病综合征,常有明显的水肿、脂质代谢紊乱,对治疗反应差,并较快进展到肾功能不全。病理上有局灶性肾小球体积增大,肾小球大小不一,节段病变明显。本例患者有大量蛋白尿,但无水肿,病理上主要表现为肾小球体积普遍增大,经降低体重等治疗后尿蛋白转阴,预后良好,不支持特发性FSGS的诊断。
4. 肥胖相关性肾病
, 百拇医药
患者自幼肥胖,入院时BMI 29.8
kg/m2,有脂质代谢异常、脂肪肝和胰岛素抵抗,因此,肥胖症诊断成立。临床上有大量蛋白尿,但无明显的水肿,肾功能稳定。病理改变虽然有一处节段硬化性病变,但主要以肾小球体积增大为主。且随访资料表明,患者在控制体重,纠正代谢紊乱和胰岛素抵抗,及采用ACEI和ARB治疗后取得了显著的疗效,2年后患者尿检蛋白完全转阴。临床病理及预后均符合肥胖相关性肾病。
最后诊断: 肥胖症 肥胖相关性肾病
病例讨论
近年来,人们已认识到肥胖可以引起肾脏损害,并命名为肥胖相关性肾ORG。但目前对该病的治疗效果及远期预后尚缺乏充分的认识。
典型的肥胖相关性肾病临床表现为肾病性或非肾病性蛋白尿,少数患者合并镜下血尿,部分患者伴有肾功能不全,可缓慢进展至终末期肾脏病ESRD。Kambham 等研究发现,与特发性FSGS患者相比,ORG发病年龄较大,较少进展至ESRD,虽然有大量蛋白尿,但水肿、低蛋白血症发生率较低,血清胆固醇水平、蛋白尿严重程度均低于特发性FSGS。
, 百拇医药
肥胖相关性肾病的病理类型主要分为二种:局灶节段性肾小球硬化伴肾小球体积增大O-FSGS 或仅表现为肾小球体积增大O-GM。O-FSGS病理形态常为“经典型”局灶节段硬化。 O-GM病理改变主要是肾小球体积弥漫性增大,无球性或节段性肾小球硬化,少部分患者可出现轻度的脐部病变,其改变与本例患者相似。这二者在临床表现上无明显差别。
肾小球肥大是本病病理形态学改变的基础,其发病机制可以归结为如下几个方面:肾脏血流动力学改变肾脏高滤过、高灌注、胰岛素抵抗、交感神经系统SNS激活及肾素血管紧张素系统RAS活化。
生理研究证实,肥胖患者肾血流量RPF 及肾小球滤过率GFR 都升高,分别比对照组增加31%及51% ,导致肾小球滤过分数增高, 且肾血流量增加幅度和体重明显相关。高胰岛素血症增加了肾小球对白蛋白的通透率,高胰岛素血症还能增加肾小管对水钠和尿酸的重吸收,引起高血压和高尿酸血综合征。肥胖患者多伴有胰岛素抵抗群,临床上突出表现为游离脂肪酸增加,高胰岛素血症,脂肪代谢异常,内皮细胞功能紊乱,高尿酸血症以及皮质激素水平异常。胰岛素能刺激多种细胞因子,如胰岛素样生长因子 IGF-1 和IGF-2,进一步加重了肾小球肥大的发生。
, 百拇医药
ORG肾组织免疫荧光沉积特点为寡免疫复合物,主要为非特异性的IgM 沉积,这也提示免疫因素并未参与ORG的发生,因此血流动力学因素可能在其中起了主要作用,这也解释了为何ORG患者足突细胞损伤的程度、蛋白尿出现速度、尿蛋白的量及选择性等均较原发性FSGS 患者轻。当然也有研究者认为ORG患者蛋白尿出现较缓慢,机体能充分代偿以平衡蛋白丢失,其低蛋白血症程度相对较轻,严重水肿也比较少见。肥胖患者常常伴血生长激素GH 水平升高, GH 不仅可以导致胰岛素抵抗 ,作为一个促进蛋白质合成的激素,GH 还能促进体内蛋白质合成。另外,有研究者认为免疫性肾脏疾病导致肾病综合征,其低蛋白血症的发生与某些细胞因子引起肝脏合成功能下降有关。鉴于肥胖患者多有高生长激素血症,在其发病过程中免疫因素占的比重较小,因此ORG患者虽然有较多的蛋白尿,但其低蛋白血症并不明显。
图1
身小球体积普遍增大(PAS, 400)
, 百拇医药
图2
身小球体积增大伴局灶节段应华(PASM,400)
肥胖患者的肾脏几乎被包膜下的脂肪紧紧包裹,部分脂肪渗入肾窦,理论上,这两者构成了对肾脏的机械压力,从而导致肾组织局部缺氧。部分肥胖患者同时合并有睡眠呼吸暂停综合征SAS, 肥胖相关性SAS患者可出现低氧血症、高碳酸血症及全身静脉压升高。即使没有明显睡眠呼吸暂停,因睡眠呼吸异常导致缺氧,也可引起肾小球毛细血管血流动力学障碍。缺氧是诱导促红细胞生成素EPO 和血管内皮细胞生长因子VEGF 产生增加的重要因素,VEGF 的分泌增多亦可增加肾小球通透性,导致和加重蛋白尿。此外,EPO 增加引起血红蛋白升高则加重了血液黏滞度从而进一步加重了缺氧。
基于上述ORG发病机制,肥胖相关性肾病的治疗应该把握两个基本点:(1)控制代谢紊乱;(2)纠正肾脏局部存在的血流动力学异常。治疗的关键在于控制肥胖,减轻体重,纠正代谢紊乱。方案包括饮食控制低热量饮食,适量运动间歇运动 及培养良好的生活方式。本例患者治疗后体重下降明显,BMI 恢复至正常水平,与此同时,尿蛋白也逐渐下降至完全正常。本例患者取得如此良好的疗效还与采取逆转胰岛素抵抗的措施有关,解放军肾脏病研究所通过一系列体内和体外研究,在充分证实大黄酸减少蛋白尿、减轻肾组织损伤、延缓糖尿病肾病进展的基础上,进一步证实了大黄酸具有逆转胰岛素抵抗,调节细胞糖代谢异常,拮抗TGF-β,保护内皮细胞功能等作用。正是基于上述研究,本例患者在诊断明确后辅用大黄酸治疗,疗效令人满意。
, http://www.100md.com
ACEI和ARB 已被证实可以降低肾小球滤过压,减轻高滤过,改善胰岛素抵抗而不影响脂质代谢,并能对心脏、肾脏等器官提供保护作用。Praga 等给予ORG患者为期一年的低热能饮食,结果患者体重下降了12% ,尿蛋白减少超过80% ,而另一组用卡托普利的ORG患者,治疗终点尿蛋白下降大于70% ,但作者认为体重增加可能会抵消ACEI 的治疗效果。本例患者在诊断明确之后,在饮食控制的同时接受ACEI、ARB 和中药大黄酸制剂,随访2年,体重明显减轻,肝功能及血脂正常,血压下降至正常,尿蛋白完全转阴,再次证实了其发病环节中非免疫因素所占的主导地位。
小 结
本例病人的诊断及治疗随访经过表明,肥胖相关性肾病早期明确诊断后,采用正确的治疗方法包括控制体重、应用大黄酸纠正代谢紊乱、ACEI和ARB纠正肾脏局部的血流动力异常,以肾小球肥大改变为主的患者,临床可获得完全缓解。该病人治疗缓解的过程也再次印证了肥胖、胰岛素抵抗、肾素-血管紧张素系统活化在肥胖相关性肾病发病过程中的关键作用。目前我国人群肥胖的发病率正在增加,对肥胖相关性肾脏病的认识亟待提高,切勿将所有呈现蛋白尿的患者均诊断为免疫性肾炎,导致误诊误治。, 百拇医药(南京军区总医院 解放军肾脏病研究所 李世军 刘志红 黎磊石 病历摘要 患者男性,18 岁,因“持续)