关键词:胸部撞击伤;中性粒细胞;凋亡;呼吸爆发;继发性肺损伤
[摘 要] 目的:PMN在炎症的发生、发展和转归中起着至关重要的作用,本实验动态地观察兔胸部撞击伤时PMN凋亡的发生以及与肺损伤之间的关系。方法:制备兔胸部撞击伤模型,分离纯化灌洗液中的PMN,应用流式细胞术测定凋亡、坏死、存活细胞比例及呼吸爆发功能的变化,并且观察与LDH和胞浆游离Ca2+ 变化之间的关系。结果:肺灌洗液中PMN的凋亡延迟持续至12h,在伤后各时相点活细胞增多。而灌洗液PMN呼吸爆发从2h即显著增强,8h达到峰值。同时,灌洗液LDH的升高从4h~24h显著高于对照。伤后PMN胞浆游离Ca2+ 有短暂升高。结论:PMN在肺组织中大量扣押并且正常的凋亡途径发生障碍,造成PMN持续处于激活状态及毒性内容物的持续释放,与肺组织损伤有密切关系,并且PMN凋亡延迟可能与Ca2+ 的短暂升高有关。
PMNApoptosis and its Role in the Lung Injury after Chest Impact Trauma
Liu Ren Xiao Nan Tian Kunlun
(Research Institute of Surgery, Daping Hospital, The Third Military Medical University,Chongqing 400042)
[Abstract] Objective:PMN, one of the mostimportant inflammatory cells, functions throughout the initiation, progression andresolution of inflammation. This study was designed to examine the relationship betweenthe regulation of PMN apoptosis and the lung injury after chest impact trauma.Methods:PMNs were purified after the chest impact trauma model in rabbits was reproduced,and their apoptosis, necrosis, survival and respiratory burst were detected by flow cytometry. Meanwhile, LDH and [Ca2+ ]i were measured. Results:The delayedapoptosis of PMNs in bronchoalveolar lavage fluid was observed from 2h to 12h aftertrauma, and viable cells increased. Respirtory burst of PMNs in bronchoalveolar lavagefluid was increased significantly from 2h, approached peak value at 8h. Meanwhile, LDH inbronchoalveolar lavage fluid were higher than control (P<0.05) from 4h to 24h, andintracellular free Ca2+ in PMN was increased temporally. Conclusions:Retentionof PMN in tissues and the abnormality in apoptotic pathway inevitably generate persistentactivation of PMN and excessive release of toxic substances, resulting in tissue injury.The temporal increasing of intracellular free Ca2+ may be responsible for thedelayed apoptosis of PMN.
[Key Words] Chest impact trauma Polymorphonuclearneutrophil Apoptosis Respiratory burst Secondary lung injury
本世纪以来,随着工业运输的发达,交通事故已成为“世界第一公害”[1] ,每年胸部创伤引起高达56%的伤者死亡[2] 。胸部创伤后可引起一系列病理及病理生理改变,如:气管支气管损伤、肺损伤、心脏瓣膜损伤、心跳骤停等。中性粒细胞(polymorphonuclear neutrophil, PMN)的游出早在创伤后1h就已发生,研究表明,创伤或感染时大量PMN聚集、扣押于肺组织中,并与肺损伤的发生发展有密切关系。本实验采用兔胸部中度撞击伤模型,观察游出至肺组织中的PMN凋亡的发生规律、功能的改变、以及与肺损伤的关系。
一、材料和方法
(一) 主要试剂和仪器
DMEM培养基(Gibco),Histopaque 1119(Sigma),Histopaque 1083(Sigma),Annexin-V-FLUOS(B.M.),碘化丙啶(propidium iodide, PI, Sigma),二氢罗得明123 (dihydrorhodamine 123, DHR 123, Sigma),佛波酯(phorbol12-myristate 13-acetate, PMA,Sigma),考马斯亮蓝G-250(Pharmacia), RPMI 1640培养基(不含酚红,Hyclone),Fluo-3/AM(Molecular Probes), BIM-Ⅱ型水平式生物撞击机(本所自行研制),流式细胞仪(Coulter),离心机(Beckman),恒温水浴(Cole-Parmer),显微镜(Leica)。
(二) 实验方法
1.实验动物分组及模型制备:健康兔36只,雌雄不限,体重2.32±0.2kg。分为6组:正常对照,伤后2h,4h,8h,12h,24h,每组6只。动物麻醉后固定于兔架上,剪去胸部兔毛,然后将兔架直立,采用BIM-Ⅱ型水平式生物撞击机撞击兔胸前区,撞击中心点在兔胸骨左缘旁0.5cm,第4、5肋间。采用准静态撞击,驱动压800kPa,撞击面积1.77cm2 ,撞击时相为收缩末期。
2.肺灌洗液PMN的分离[3] :于预定时相处死动物,开胸行气管插管,20mlDMEM培养基灌洗肺,进行2次。收集灌洗液后,离心留取上清备用,沉淀重新悬浮后用Histopaque1119及Histopaque 1083进行密度梯度离心,700g离心30分钟,取PMN富集层。用0.01MPBS(pH7.2~7.4)洗2遍,低渗法溶解红细胞,0.01M PBS洗1遍。瑞氏-姬姆萨染色,PMN纯度>90%,并计数PMN数量。
3.PMN凋亡和坏死细胞定量[4] :Annexin V和PI双标法。分离纯化的PMN悬浮于100μl孵育缓冲液中(10mM Hepes, 140mM NaC1, 5mM CaCl2 , pH7.4),加2μl Annexin-V-FLUOS和2μlPI(50ug/ml),室温10~15分钟,加0.4ml孵育缓冲液终止反应,流式细胞仪双通道检测5000个细胞,激发波长488nm,发射波长515nm、610nm。
4.PMN呼吸爆发的测定[5] :80μl PMN悬液中加20μl DHR 123(10μM),37℃孵育5分钟,加PMA(500nM)2μl刺激10分钟,流式细胞仪单通道检测5000个细胞。激发波长488nm,发射波长510~550nm,结果以LnMCF表示。
5.灌洗液中LDH的测定:收集样品用全自动生化分析仪检测。
6.PMN中胞浆游离Ca2+ 的测定[6] :
Buffer A Buffer B
Hepes 2.38g 2.38g
RPMI 1640(无酚红) 10.4g10.4g
NaHCO3 2g 2g
新生牛血清 终浓度5%
pH7.0 7.4
定容 500ml 500ml
细胞用Buffer A洗涤2次后以200μl Buffer A悬浮,加Fluo-3(溶于40μl含1%Pluronic F-127的DMSO中)0.4μl,室温避光30分钟,用Buffer B洗涤2次后加0.5mlBuffer B悬浮,流式细胞仪检测5000个细胞,激发波长488nm,发射波长530nm。
三、统计学处理:结果以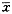
二、结 果
(一) 肺灌洗液中PMN凋亡、坏死及存活的变化(图1-3)
兔胸部撞击伤后2h~12h,肺灌洗液中PMN凋亡比例显著降低(与对照相比,P<0.05或P<0.01),24h时PMN凋亡比例升高,恢复到对照水平。而PMN坏死比例在伤后2h即显著升高(与对照相比,P<0.05),4h达到峰值,8h恢复到伤前水平,12h又升高(与对照相比,P<0.01),随后降低,至24h降低为8.65%,明显低于对照(P<0.05)。相应地,伤后2h~24h,PMN存活比例均高于对照(P<0.05或P<0.01)。
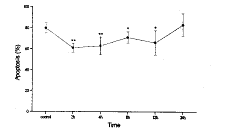
图1 肺灌洗液中PMN凋亡的变化
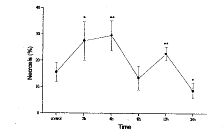
图2 肺灌洗液中PMN坏死的变化
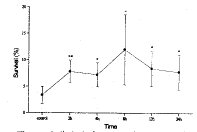
图3 肺灌洗液中PMN存活的变化
(二) 肺灌洗液中PMN呼吸爆发的改变(图4)伤后2h PMN呼吸爆发即显著升高(与对照相比,P<0.05),8h达到峰值,12h已恢复到伤前水平,随后虽有上升趋势,但至24h与对照相比无显著差异。
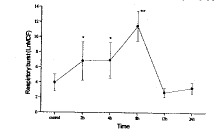
图4 肺灌洗液中PMN呼吸爆发的改变
(三) 肺灌洗液中LDH的变化(图5)
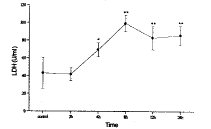
图5 肺灌洗液中LDH的改变
肺灌洗液中LDH在伤后4h显著高于对照(P<0.05),8h达到峰值,12h稍有降低,但是仍然显著高于对照(P<0.01),并持续至24h。
(四) 肺灌洗液PMN中胞浆游离Ca2+ 的变化(图6)伤后2h肺灌洗液PMN中胞浆游离Ca2+ 即有升高,但与对照相比无显著差异,4h达到峰值(与对照相比,P<0.01),随后降低,至12h已恢复到伤前水平。
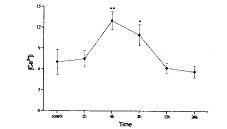
图6 肺灌洗液PMN中胞浆游离Ca2+ 的变化
三、讨 论
我们发现,兔胸部撞击伤后2h~12h,肺灌洗液中PMN凋亡比例显著降低,24h时PMN凋亡比例升高,恢复到对照水平,说明伤后12h内PMN凋亡延迟。PMN坏死呈现二次升高,峰值分别在4h、12h。相应地,存活的PMN比例从伤后2h起直至24h,均明显高于对照。这说明PMN游出血管到达肺组织后,在肺中大量聚集,存活时间延长。PMN的这种变化与肺损伤的发生可能有密切关系,因为游出的PMN是处于激活状态,如果正常的凋亡途径发生障碍,必然导致PMN凋亡延迟,存活时间延长,持续释放毒性内容物,造成周围组织损伤。
通过呼吸爆发释放毒性内容物是PMN重要的防御功能之一。我们的研究还表明,肺灌洗液PMN的呼吸爆发表现为2h时显著增强,8h时升高至峰值,随后降低的动态变化。结果提示,浸润于肺组织中的PMN释放毒性内容物的功能处于高度活化状态,这与肺灌洗液中PMN凋亡延迟、活细胞比例增加的变化是一致的,并且可能是导致肺组织损伤的启动因素。
灌洗液LDH升高的峰值发生于8h,随后呈下降趋势,但仍然显著高于对照。这与PMN呼吸爆发的变化相吻合。生理状态下,PMN游出血管不必以血管的通透性增强为前提,与细胞间连接和受体有关,并且PMN在循环血中的半衰期只有4~6小时。胸部撞击伤时,从大体标本可见双肺有散在或点片状或片状出血,以肺上叶和肺门处明显。小血管的破裂无疑为PMN快速、大量游出提供了机会。这些结果提示,PMN在肺组织中大量扣押、凋亡延迟与肺损伤的发生有密切关系。
我们目前已经知道,PMN扣押与肺损伤的发生有关,抑制PMN扣押可减轻肺损伤,但是,对PMN游出到达肺组织后的转归与肺损伤关系的研究较少。Ertel等[7] 发现,严重的头部或胸部创伤后,PMN凋亡延迟可能导致了继发的组织损伤,并与粒细胞克隆刺激因子(G-CSF)有关。本实验发现,胸部撞击伤后4h、8h胞浆游离Ca2+ 有短暂升高,12h已恢复到伤前水平。细胞内Ca2+ 浓度的改变涉及多种效应,包括细胞的增殖、分化和凋亡。对胞浆游离Ca2+ 的作用已有很多研究,一般认为失血性休克、内毒素休克、缺血再灌注和严重创伤后,平滑肌细胞、心肌细胞中游离Ca2+ 持续升高,产生钙超载,与细胞功能抑制有密切关系。肺灌洗液PMN中游离Ca2+ 的升高是短暂的,与内皮细胞、心肌细胞中的变化不同。Whyte[8] 在体外实验中发现胞浆游离Ca2+ 的短暂升高可以抑制PMN凋亡,提示这种Ca2+ 的短暂升高可能有特殊的意义。Ca2+ 影响凋亡,主要是因为某些核小体DNA的降解为钙依赖性。尽管我们的结果与Whyte观察到的现象非常一致,但在体内环境中Ca2+ 与PMN凋亡之间的关系是否如此,Ca2+ 影响PMN凋亡的作用有多大,尚需深入的研究。
本实验详细研究了兔胸部撞击伤时肺灌洗液中PMN凋亡、坏死、存活的动态变化及其功能的抑制或亢进。结果表明,肺灌洗液中PMN表现为凋亡延迟,存活细胞比例增加,PMN在肺组织中持续存活并且释放毒性内容物与肺损伤之间有密切关系。目前已经明确MOF是过度炎症反应的结果,在创伤后有MOF高风险的病人中,PMN凋亡延迟[9] 。因此,PMN凋亡的异常在创伤后SIRS及MODS的发生发展中可能具有重要的作用[10,11] 。
参 考 文 献
[1]王正国.交通事故伤.中国危重病急救医学,1999;11(6):325-326
[2]Gebhard F,Kelbel MW, Strecker W,et al. Chest trauma and its impact on the releaseof vasoactive mediators. Shock, 1997;7(5):313-317
[3]Szucs S, Varga C,Ember I, et al. The separation of the granulocytes from differentrat strains. A comparative study. J Immunol Methods, 1994;167:245-251
[4]Vermes I, Haanen C,Steffens-Nakken H, et al. A novel assay for apoptosis: flowcytometric detection of phosphatidylserine expression on early apoptotic cells usingfluorescein labelled Annexin V.J Immunol Methods, 1995;184:39-51
[5]Smith JA, Weidemann MJ. Further characterization of the neutrophil oxidative burstby flow cytometry. J Immunol Methods, 1993;162:261-268
[6]Merritt JE, McCarthy SA, Davies MPA, et al. Use of Fluo-3 to measure Ca2+ in platelet and neutrophils. Biochem J, 1990;269:513-519
[7]Ertel W,Keel M,Buergi U, et al. Granulocyte colony-stimulating factor inhibitsneutrophil apoptosis at the local site after severe heart and thoracic injury. J Trauma,1999;46(5):784-793
[8]Whyte MK, Hardwick SJ, Meagher LC, et al. Transient elevations of cytosolic freecalcium retard subsequent apoptosis in neutrophils in vitro. J Clin Invest,1993;92(1):446-455
[9]Biffl WL, Moore EE, Zallen G, et al. Neutrophils are primed for cytotoxicity andresist apoptosis in the injured patients at risk for multiple organ failure. Surgery,1999;126(2):198-202
[10]Schlag G,Redl H.Mediators of injury and inflammation. World J Surg,1996;20(4):406-410
[11]Coris RJA. MODS/SIRS: result of an overwhelming inflammatory response? World J Surg, 1996;20(4):418-421 , http://www.100md.com