甲磺酸去铁胺抗庆大霉素耳毒性作用及机理研究
http://www.100md.com
中华耳鼻咽喉科杂志
Priuska等[1]提出庆大霉素(gentamicin,GM)耳毒性可能是由于GM在体内形成GM-铁复合物,催化产生自由基而损伤毛细胞。自由基清除剂和铁螯合剂可以减轻GM 引起的听力损害[2]。本实验通过ABR检测、耳蜗铺片及透射电镜技术,观察豚鼠用药前后听反应阈及耳蜗毛细胞、血管纹的改变,观察铁螯合剂甲磺酸去铁胺(deferoxamine mesylate,DFO)对抗GM耳毒性的作用;同时检测耳蜗和肾皮质组织丙二醛、超氧化物歧化酶和铁离子的含量,测定血清GM和尿素氮、肌苷水平,以探讨其可能的作用机理及其与肾毒性的关系。
材料及方法
1.实验动物:耳廓反射正常的健康雄性杂色豚鼠50只,体重250~350 g,随机分成4组。 GM组17只:硫酸庆大霉素(西北第二合成药厂生产,批号970818) 120 mg/kg皮下注射,每天1次,连续19 d;DFO组8只:DFO(Sigma公司,美国,密西根大学医学中心Kresge听力研究所提供) 每次100 mg/kg皮下注射,每天2次(间隔4 h),连续19 d;GM+DFO组17只:GM和DFO同时注射,4 h后注射DFO,剂量同上;对照组 8只:生理盐水等量皮下注射,每天1次,连续19 d。 动物实验期间每天秤体重以调整药量。
, http://www.100md.com
2.ABR检测听反应阈:用药前及用药后第9和19 d、第28和42 d周检测双耳ABR。动物在戊巴比妥钠 40 mg/kg 腹腔注射麻醉后,针型记录电极置前额正中皮下,参考电极置测试耳外耳道口后上皮下,鼻尖接地。用SS-1型声刺激器,286计算机自动采样,采用短声(click)1、2、4、8 kHz刺激,间隔75 ms,扫描时间20 ms,叠加256次,带通滤波80~1 500 Hz,在屏蔽隔声室内常规测试。
3.透射电镜标本制备:停药后第2 d检测ABR后各组随机取4 只动物断头处死,每只动物各取1耳,听泡置2.5%戊二醛内,解剖显微镜下摘除镫骨,刺破圆窗,挑开蜗顶,灌流固定后浸渍固定24 h,磷酸缓冲液漂洗后解剖标本,取出各回基底膜及血管纹,1%锇酸后固定,丙酮脱水,环氧树脂包埋,超薄切片,铀铅染色。
4.耳蜗硬铺片标本制备:取材时间同上,另1耳听泡硝酸银染色法常规制备[3]。
, 百拇医药 5.微生物纸片扩散法测定庆大霉素血药浓度[4]:GM组和GM+DFO组动物第9和19 d注射庆大霉素后 1 h剪爪取血,测定血清抑菌环直径,再查标准曲线图,得出血清庆大霉素浓度。
6.检测肾功:取样时间和方法同上,全自动生化检测仪(日立公司, 日本)测定血清尿素氮和肌苷。
7.检测耳蜗和肾皮质的丙二醛、超氧化物歧化酶和铁:GM组和GM+DFO组第9和19 d各取3只动物活杀,迅速取出耳蜗,双耳合为1份标本制成匀浆,4 000 r/min离心10 min,取上清液-20 ℃冻存。采用南京建成生物研究所的丙二醛、超氧化物歧化酶和考马斯亮蓝蛋白测定试剂盒,按说明操作检测;原子吸收分光光度计(天津第一医疗器材设备厂)检测铁的含量。统计学处理用方差分析。
结果
1.实验中GM组3只动物分别于用药第11、18和19 d死亡,死前均消瘦、无力、耳廓反射消失,其余各组无死亡。第19 d对照组平均增长35 g,而GM组动物体重平均减少2 g, 差异有显著性(P<0.05);停药后GM组动物恢复体重增长。GM+DFO组、DFO组第19 d体重平均增长33g和31g,和对照组之间比较差异无显著性(P>0.05)。
, 百拇医药
2.ABR检测:豚鼠的ABR以Ⅲ波最著,因此以Ⅲ波判断ABR反应阈(dB SPL),用药后各组动物ABR平均反应阈移见图1。虽然实验动物对药物的反应具有个体差异,但GM+DFO组反应阈损害较GM组明显减轻。用药后第4周,GM组4 kHz及8 kHz反应阈平均(±s,下同)升高(44±18)dB及(60±17)dB,而GM+DFO组则分别为(16±5)dB及(21±5)dB,两组差异有显著性(P<0.05)。损伤具有频率差异,高频损伤明显比低频损伤严重(P<0.01)。DFO组和对照组反应阈变化不明显(P>0.05)。
图1 用药后各组动物不同频率短声刺激的ABR平均阈移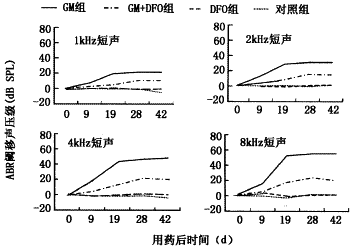
3.耳蜗铺片及透射电镜所见:耳蜗铺片显示GM组用药后3排外毛细胞损伤明显比GM+DFO组重(图2,3),且从顶回至底回逐渐加重,外毛细胞损伤较内毛细胞重。透射电镜见GM组耳蜗毛细胞胞浆细胞器减少,呈空泡变性(图4);GM+DFO组则显示损伤较轻,线粒体完整,出现一些多泡体结构(图5)。GM组还可见耳蜗传入神经突触线粒体空化,血管纹边缘细胞突起中的少数线粒体亦出现嵴减少、空化。DFO组与对照组用药前后耳蜗铺片及透射电镜改变不明显。
, 百拇医药
图2 耳蜗铺片见GM组第二回外毛细胞损伤明显,仅有少数残留,内毛细胞亦见损伤。×400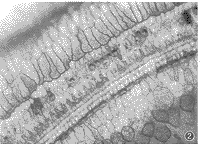
图3 耳蜗铺片见GM+DFO组第二回外毛细胞损伤较轻,内毛细胞无缺失。×400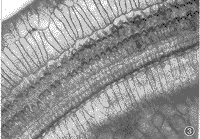
图4 透射电镜观察GM组毛细胞胞浆稀疏呈空泡变性,胞核浓缩。×6000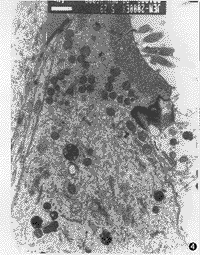
图5 透射电镜观察GM+DFO组毛细胞胞浆丰富,有多个多泡体形成。×4000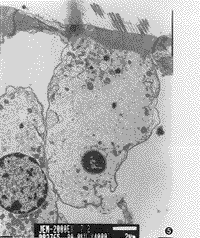
, http://www.100md.com
4.血清检测:GM组和GM+DFO组动物的血清GM浓度差异无显著性(P>0.05)。第9 d测定值(±s,下同)分别为(75±12) mg/L和(80±9) mg/L,第19d测定值分别为(110±12) mg/L和(114±9) mg/L。GM组第19 d血清尿素氮和肌苷分别为(28.34±4.3)mmol/L和(93.39±15.8)mmol/L,GM+DFO组分别为 (11.48±5.6) mmol/L和(45.47±12.8) mmol/L,两组间差异有显著性(P<0.05)。
5. 耳蜗和肾皮质的丙二醛、超氧化物歧化酶和铁检测: GM+DFO组耳蜗组织第9和19 d的铁离子平均含量为5.01μmol/L和5.21μmol/L,低于GM组9.70μmol/L和8.21μmol/L,差异均有显著性(P<0.05);GM+DFO组耳蜗组织同期的丙二醛平均含量为2.43和2.83 mmol/mg蛋白,低于GM组3.83和4.78 mmol/mg蛋白,差异有显著性(P<0.05);GM+DFO组第9 d超氧化物歧化酶含量则显著高于GM组(P<0.05),分别为4 351和2 480 U/mg蛋白(nitris unit)。两组肾皮质组织丙二醛、超氧化物歧化酶和铁含量差异无显著性(P>0.05)。此外,第19 d可见GM组3只动物的肾脏肿大如球状,呈亮黄色。
, http://www.100md.com
讨论
DFO是一种螯合剂,主要与铁离子和三价铝离子形成复合物,其复合物形成常数分别为1031和1025。这两种复合物通过胆汁和尿可完全排泄,因此而减少铁或铝在器官的病理性沉积。临床用于治疗输血所致的含铁血黄素沉着病和地中海贫血等急、慢性铁中毒[5] 。临床曾报道DFO作长期治疗时,尤其所用剂量超过推荐剂量和/或其剂量未按低血清铁蛋白或血清铝浓度而调整时,可引起视力、听力障碍。也有研究证明其长期服用的安全性[6]。本实验所用庆大霉素为临床应用的20倍,而DFO只是临床剂量的2~4倍,DFO组听反应阈在整个实验过程中保持稳定,表明其安全无毒性。停药后1周听力损害达到顶峰,GM+DFO组8 kHz听反应阈平均较GM组降低31.5 dB,1 kHz也降低了11 dB(P<0.05) ,耳蜗毛细胞的形态学损伤与听反应阈升高的程度相平行。这与Song等[7]的结果一致,说明DFO能有效减轻GM的耳毒作用,成为有希望的预防药物。而且这种保护作用不影响GM的血药浓度,仍能保持GM的抗菌效力。与以往的报道相同,GM的听力损害以高频尤为敏感,8 kHz首先出现反应阈升高,且损失较中、低频为甚(P<0.01)。因此,高频听反应阈的升高可早期预示GM的耳毒性。
, 百拇医药
有关氨基糖甙类抗生素的耳毒性机理的学说很多,尚未完全明了,其中之一为自由基学说。1981年Pierson等[8]报道自由基清除剂WR2721可延缓卡那霉素耳中毒的发生,并减轻听力损失程度。但随后各家实验的结果不相一致,不同的自由基清除剂治疗得到不同的结果。Garets等[9]和Lautermann等[10]都证实谷氨酰胺可减轻庆大霉素耳毒性,但仅对疾病状态下或营养缺乏的动物有效。这表明应用自由基清除剂防护庆大霉素耳毒性作用的不确定性。机体内的氧自由基由酶系统和非酶系统产生某些复合物催化的Haber-Weiss反应,由铁离子提供电子产生羟自由基是其中一条重要途径。Priuska等[1]提出GM的耳毒作用是通过与游离铁离子形成复合物,催化产生自由基的反应而发挥耳毒性作用。自由基可通过生物膜中不饱和脂肪酸的过氧化引起细胞损伤,并因此形成脂质过氧化物,如:醛基(丙二醛)、酮基、羟基、羰基等。因而测试丙二醛含量常可反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度。
本实验结果证实铁螯合剂DFO能明显减轻GM对豚鼠的听力损害。DFO+GM组的耳蜗组织丙二醛和铁离子含量都显著低于GM组,说明丙二醛和铁离子可能在GM耳毒机理中起重要作用。DFO+GM组的耳蜗组织超氧化物歧化酶含量显著高于GM组(P<0.05), 间接反映了DFO的保护作用与自由基有关。实验结果GM组肾功有明显损伤,而两组肾皮质组织丙二醛、超氧化物歧化酶和铁离子含量差异无显著性(P>0.05),表明GM的肾毒性可能还有更复杂的作用机理,有待进一步研究。
, 百拇医药
参考文献
1 Priuska EM, Schacht J.Formation of free radicals by gentamicin and iron and evidence for an iron/gentamicin complex. Biochem Pharmacol, 1995,50:1749-1752.
2 Song BB, Schacht J.Variable efficacy of radical scavengers and iron chelators to attenuate gentamicin ototoxicity in guinea pig in vivo. Hear Res, 1996,94:87-93.
3 刘顺利,王锦玲.制备耳蜗硬铺片银浸标本的体会.第四军医大学学报,1985,6:353-354.
, 百拇医药
4 Sabath LD, Matsen JM.Assay of antimicrobial agents. In: Lennethe EH, Spaulding EH, Truant JP, eds. Manual of clinical microbiology. 2ed. Washington:American Society for Microbiology,1974.428-430.
5 Hershko C.Iron chelators in medicine. Mol Aspects Med, 1992,13:113-165.
6 Shirane M, Harrison RV.The effects of deferoxamine mesylate and hypoxia on the cochlea.Acta Otolaryngol,1987,16:334-339.
, 百拇医药 7 Song BB, Anderson DJ, Schacht J.Protection from gentamicin ototoxicity by iron chelators in guinea pig in vivo. J Pharmacol Exp Ther, 1997,282:369-377.
8 Pierson MG, Moller AR.Prophylaxis of kanamycin-induced ototoxicity by a radioprotectant. Hear Res, 1981,4:79-87.
9 Garets SL,Altschuler RA,Schacht J.Attenuation of gentamicin ototoxicity by glutathione in the guinea pig in vivo.Hear Res,1994,77:81-87.
10 Lautermann J,McLaren J ,Schacht J.Glutathione protection against gentamicin ototoxicity depends on nutritional status.Hear Res,1995,86:15-24., http://www.100md.com
材料及方法
1.实验动物:耳廓反射正常的健康雄性杂色豚鼠50只,体重250~350 g,随机分成4组。 GM组17只:硫酸庆大霉素(西北第二合成药厂生产,批号970818) 120 mg/kg皮下注射,每天1次,连续19 d;DFO组8只:DFO(Sigma公司,美国,密西根大学医学中心Kresge听力研究所提供) 每次100 mg/kg皮下注射,每天2次(间隔4 h),连续19 d;GM+DFO组17只:GM和DFO同时注射,4 h后注射DFO,剂量同上;对照组 8只:生理盐水等量皮下注射,每天1次,连续19 d。 动物实验期间每天秤体重以调整药量。
, http://www.100md.com
2.ABR检测听反应阈:用药前及用药后第9和19 d、第28和42 d周检测双耳ABR。动物在戊巴比妥钠 40 mg/kg 腹腔注射麻醉后,针型记录电极置前额正中皮下,参考电极置测试耳外耳道口后上皮下,鼻尖接地。用SS-1型声刺激器,286计算机自动采样,采用短声(click)1、2、4、8 kHz刺激,间隔75 ms,扫描时间20 ms,叠加256次,带通滤波80~1 500 Hz,在屏蔽隔声室内常规测试。
3.透射电镜标本制备:停药后第2 d检测ABR后各组随机取4 只动物断头处死,每只动物各取1耳,听泡置2.5%戊二醛内,解剖显微镜下摘除镫骨,刺破圆窗,挑开蜗顶,灌流固定后浸渍固定24 h,磷酸缓冲液漂洗后解剖标本,取出各回基底膜及血管纹,1%锇酸后固定,丙酮脱水,环氧树脂包埋,超薄切片,铀铅染色。
4.耳蜗硬铺片标本制备:取材时间同上,另1耳听泡硝酸银染色法常规制备[3]。
, 百拇医药 5.微生物纸片扩散法测定庆大霉素血药浓度[4]:GM组和GM+DFO组动物第9和19 d注射庆大霉素后 1 h剪爪取血,测定血清抑菌环直径,再查标准曲线图,得出血清庆大霉素浓度。
6.检测肾功:取样时间和方法同上,全自动生化检测仪(日立公司, 日本)测定血清尿素氮和肌苷。
7.检测耳蜗和肾皮质的丙二醛、超氧化物歧化酶和铁:GM组和GM+DFO组第9和19 d各取3只动物活杀,迅速取出耳蜗,双耳合为1份标本制成匀浆,4 000 r/min离心10 min,取上清液-20 ℃冻存。采用南京建成生物研究所的丙二醛、超氧化物歧化酶和考马斯亮蓝蛋白测定试剂盒,按说明操作检测;原子吸收分光光度计(天津第一医疗器材设备厂)检测铁的含量。统计学处理用方差分析。
结果
1.实验中GM组3只动物分别于用药第11、18和19 d死亡,死前均消瘦、无力、耳廓反射消失,其余各组无死亡。第19 d对照组平均增长35 g,而GM组动物体重平均减少2 g, 差异有显著性(P<0.05);停药后GM组动物恢复体重增长。GM+DFO组、DFO组第19 d体重平均增长33g和31g,和对照组之间比较差异无显著性(P>0.05)。
, 百拇医药
2.ABR检测:豚鼠的ABR以Ⅲ波最著,因此以Ⅲ波判断ABR反应阈(dB SPL),用药后各组动物ABR平均反应阈移见图1。虽然实验动物对药物的反应具有个体差异,但GM+DFO组反应阈损害较GM组明显减轻。用药后第4周,GM组4 kHz及8 kHz反应阈平均(±s,下同)升高(44±18)dB及(60±17)dB,而GM+DFO组则分别为(16±5)dB及(21±5)dB,两组差异有显著性(P<0.05)。损伤具有频率差异,高频损伤明显比低频损伤严重(P<0.01)。DFO组和对照组反应阈变化不明显(P>0.05)。
图1 用药后各组动物不同频率短声刺激的ABR平均阈移

3.耳蜗铺片及透射电镜所见:耳蜗铺片显示GM组用药后3排外毛细胞损伤明显比GM+DFO组重(图2,3),且从顶回至底回逐渐加重,外毛细胞损伤较内毛细胞重。透射电镜见GM组耳蜗毛细胞胞浆细胞器减少,呈空泡变性(图4);GM+DFO组则显示损伤较轻,线粒体完整,出现一些多泡体结构(图5)。GM组还可见耳蜗传入神经突触线粒体空化,血管纹边缘细胞突起中的少数线粒体亦出现嵴减少、空化。DFO组与对照组用药前后耳蜗铺片及透射电镜改变不明显。
, 百拇医药
图2 耳蜗铺片见GM组第二回外毛细胞损伤明显,仅有少数残留,内毛细胞亦见损伤。×400

图3 耳蜗铺片见GM+DFO组第二回外毛细胞损伤较轻,内毛细胞无缺失。×400

图4 透射电镜观察GM组毛细胞胞浆稀疏呈空泡变性,胞核浓缩。×6000

图5 透射电镜观察GM+DFO组毛细胞胞浆丰富,有多个多泡体形成。×4000

, http://www.100md.com
4.血清检测:GM组和GM+DFO组动物的血清GM浓度差异无显著性(P>0.05)。第9 d测定值(±s,下同)分别为(75±12) mg/L和(80±9) mg/L,第19d测定值分别为(110±12) mg/L和(114±9) mg/L。GM组第19 d血清尿素氮和肌苷分别为(28.34±4.3)mmol/L和(93.39±15.8)mmol/L,GM+DFO组分别为 (11.48±5.6) mmol/L和(45.47±12.8) mmol/L,两组间差异有显著性(P<0.05)。
5. 耳蜗和肾皮质的丙二醛、超氧化物歧化酶和铁检测: GM+DFO组耳蜗组织第9和19 d的铁离子平均含量为5.01μmol/L和5.21μmol/L,低于GM组9.70μmol/L和8.21μmol/L,差异均有显著性(P<0.05);GM+DFO组耳蜗组织同期的丙二醛平均含量为2.43和2.83 mmol/mg蛋白,低于GM组3.83和4.78 mmol/mg蛋白,差异有显著性(P<0.05);GM+DFO组第9 d超氧化物歧化酶含量则显著高于GM组(P<0.05),分别为4 351和2 480 U/mg蛋白(nitris unit)。两组肾皮质组织丙二醛、超氧化物歧化酶和铁含量差异无显著性(P>0.05)。此外,第19 d可见GM组3只动物的肾脏肿大如球状,呈亮黄色。
, http://www.100md.com
讨论
DFO是一种螯合剂,主要与铁离子和三价铝离子形成复合物,其复合物形成常数分别为1031和1025。这两种复合物通过胆汁和尿可完全排泄,因此而减少铁或铝在器官的病理性沉积。临床用于治疗输血所致的含铁血黄素沉着病和地中海贫血等急、慢性铁中毒[5] 。临床曾报道DFO作长期治疗时,尤其所用剂量超过推荐剂量和/或其剂量未按低血清铁蛋白或血清铝浓度而调整时,可引起视力、听力障碍。也有研究证明其长期服用的安全性[6]。本实验所用庆大霉素为临床应用的20倍,而DFO只是临床剂量的2~4倍,DFO组听反应阈在整个实验过程中保持稳定,表明其安全无毒性。停药后1周听力损害达到顶峰,GM+DFO组8 kHz听反应阈平均较GM组降低31.5 dB,1 kHz也降低了11 dB(P<0.05) ,耳蜗毛细胞的形态学损伤与听反应阈升高的程度相平行。这与Song等[7]的结果一致,说明DFO能有效减轻GM的耳毒作用,成为有希望的预防药物。而且这种保护作用不影响GM的血药浓度,仍能保持GM的抗菌效力。与以往的报道相同,GM的听力损害以高频尤为敏感,8 kHz首先出现反应阈升高,且损失较中、低频为甚(P<0.01)。因此,高频听反应阈的升高可早期预示GM的耳毒性。
, 百拇医药
有关氨基糖甙类抗生素的耳毒性机理的学说很多,尚未完全明了,其中之一为自由基学说。1981年Pierson等[8]报道自由基清除剂WR2721可延缓卡那霉素耳中毒的发生,并减轻听力损失程度。但随后各家实验的结果不相一致,不同的自由基清除剂治疗得到不同的结果。Garets等[9]和Lautermann等[10]都证实谷氨酰胺可减轻庆大霉素耳毒性,但仅对疾病状态下或营养缺乏的动物有效。这表明应用自由基清除剂防护庆大霉素耳毒性作用的不确定性。机体内的氧自由基由酶系统和非酶系统产生某些复合物催化的Haber-Weiss反应,由铁离子提供电子产生羟自由基是其中一条重要途径。Priuska等[1]提出GM的耳毒作用是通过与游离铁离子形成复合物,催化产生自由基的反应而发挥耳毒性作用。自由基可通过生物膜中不饱和脂肪酸的过氧化引起细胞损伤,并因此形成脂质过氧化物,如:醛基(丙二醛)、酮基、羟基、羰基等。因而测试丙二醛含量常可反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度。
本实验结果证实铁螯合剂DFO能明显减轻GM对豚鼠的听力损害。DFO+GM组的耳蜗组织丙二醛和铁离子含量都显著低于GM组,说明丙二醛和铁离子可能在GM耳毒机理中起重要作用。DFO+GM组的耳蜗组织超氧化物歧化酶含量显著高于GM组(P<0.05), 间接反映了DFO的保护作用与自由基有关。实验结果GM组肾功有明显损伤,而两组肾皮质组织丙二醛、超氧化物歧化酶和铁离子含量差异无显著性(P>0.05),表明GM的肾毒性可能还有更复杂的作用机理,有待进一步研究。
, 百拇医药
参考文献
1 Priuska EM, Schacht J.Formation of free radicals by gentamicin and iron and evidence for an iron/gentamicin complex. Biochem Pharmacol, 1995,50:1749-1752.
2 Song BB, Schacht J.Variable efficacy of radical scavengers and iron chelators to attenuate gentamicin ototoxicity in guinea pig in vivo. Hear Res, 1996,94:87-93.
3 刘顺利,王锦玲.制备耳蜗硬铺片银浸标本的体会.第四军医大学学报,1985,6:353-354.
, 百拇医药
4 Sabath LD, Matsen JM.Assay of antimicrobial agents. In: Lennethe EH, Spaulding EH, Truant JP, eds. Manual of clinical microbiology. 2ed. Washington:American Society for Microbiology,1974.428-430.
5 Hershko C.Iron chelators in medicine. Mol Aspects Med, 1992,13:113-165.
6 Shirane M, Harrison RV.The effects of deferoxamine mesylate and hypoxia on the cochlea.Acta Otolaryngol,1987,16:334-339.
, 百拇医药 7 Song BB, Anderson DJ, Schacht J.Protection from gentamicin ototoxicity by iron chelators in guinea pig in vivo. J Pharmacol Exp Ther, 1997,282:369-377.
8 Pierson MG, Moller AR.Prophylaxis of kanamycin-induced ototoxicity by a radioprotectant. Hear Res, 1981,4:79-87.
9 Garets SL,Altschuler RA,Schacht J.Attenuation of gentamicin ototoxicity by glutathione in the guinea pig in vivo.Hear Res,1994,77:81-87.
10 Lautermann J,McLaren J ,Schacht J.Glutathione protection against gentamicin ototoxicity depends on nutritional status.Hear Res,1995,86:15-24., http://www.100md.com