关键词:肝素;血小板生成素;巨核细胞
摘要 目的 探索肝素能否增强血小板生成素(Tpo)刺激巨核细胞生成。方法 以巨核细胞白血病细胞株M07e,人脐带血CD34 + 细胞和BALB/c小鼠为研究对象,用[3 H]-TdR掺入试验,巨核细胞集落(CFU-MK)血浆半固体培养和小鼠体内实验等方法研究肝素或(和)Tpo对巨核细胞生成的作用。结果 肝素能增强Tpo刺激白血病细胞株M07e增殖、人脐带血CD34 + 细胞衍生的CFU-MK生长和小鼠体内巨核细胞生成。结论 肝素通过增强Tpo的促巨核细胞生成参与巨核细胞生成的正调控。
Heparin enhances the stimulatingeffect of thrombopoietin on megakaryocytopoiesis
CHEN Qiusheng , SHEN Zhixiang, HAN Zhongchao, et al.
Shanghai Institute of Hematology, Ruijin Hospital, Shanghai Second MedicalUniversity, Shanghai 200025
Abstract Objective To verify whether heparincould enhance the stimulating effect of Tpo on megakaryocytopoiesis. Methods Megakaryocyticleukemia cell line M07e, human cord blood CD34 + cells and BALB/cmice were used in this study. The effects of heparin and/or Tpo on megakaryocytopoiesiswere studied by [3 H]-TdR incorporation assay, CFU-MK plasmic semi-solidculture and in vivo experiment in BALB/c mice. Results Heparin could enhance thestimulating effect of Tpo on stimulating the proliferation of M07e, the growth of CFU-MKfrom human cord blood CD34 + cells and in vivo megakaryocytopoiesisin mice. Conclusion Heparin participates in positive regulation of megakaryocytopoiesisby enhancing the megakaryocytopoietic activities of Tpo.
Key words Heparin Thrombopoietin Megakaryocyte
肝素在体外有血清,尤其再生障碍性贫血(再障)血清的培养体系中和体内都具有促进巨核细胞或(和)血小板生成的作用,而在无血清培养体系中无此作用,其机制目前仍不清楚[1-4] 。再障血清富含血小板生成素(Tpo)[5] ,后者是至今发现的能特异地刺激巨核细胞-血小板系生成的细胞因子[6] ,因此可以设想肝素的作用与Tpo有关。我们以人脐带血CD34 + 细胞、巨核细胞白血病细胞株M07e为靶细胞,并在小鼠体内研究肝素增强Tpo对巨核细胞生成的刺激作用,为临床上肝素和Tpo合用治疗血小板减少症提供理论依据。
材料和方法
1 细胞和细胞生长因子
巨核细胞白血病细胞株M07e由法国William教授惠赠。小鼠有核细胞取
自于6~8周龄雄性BALB/c小鼠(上海市BK实验动物有限公司)的股骨骨髓。人脐带血CD34 + 细胞按照MACSCD34 + 祖细胞分离试剂盒(Miltenyi Biotec公司)说明稍加改变的方法分离而得:①用淋巴细胞分离液梯度离心(2000r/min×20分钟)分离单个核细胞;②磁珠标记CD34 + 细胞;③磁性分离CD34 + 细胞;④测定分离的CD34 + 细胞的纯度:用FITC标记的CD34 单抗HPCA-2(BD公司产品)温育后,用流式细胞仪(FACScan)检测。重组人白细胞介素(IL)-3、IL-6、干细胞因子(SCF)、和粒-巨噬细胞集落刺激因子(GM-CSF)均购自上海贝特生物技术有限公司。重组的人Tpo和兔抗人Tpo由麒麟公司惠赠。未级分肝素(Cutheparin,5000IU/0.2ml)购自法国Bioseda公司。
2 M07e 细胞的增殖试验
收集在含体积分数为20%的小牛血清和10μg/L rhGM-CSF的α-MEM中培养的指数生长M07e细胞,用α-MEM洗涤2次,重悬浮后计活细胞数,调整细胞浓度,接种于96孔细胞培养板,培养体系为含体积分数为20%的小牛血清及常规剂量青、链霉素的α-MEM,分组加入各种浓度的肝素或(和)rhTpo,每组3孔,每孔5×104 细胞,最终体积为0.2ml。置37℃、体积分数为5%的CO2 及饱和湿度的孵育箱中培养60小时后,每孔加入18.5kBq[3 H]-TdR,继续孵育6小时后收集细胞于玻纤滤纸上,测定放射活性。
3 小鼠体内实验
将BALB/c小鼠随机分组,各组给药(不同浓度的肝素和rhTpo,对照组注射PBS),连续5天,停药后第2天颈椎脱臼法处死小鼠,分离小鼠股骨,用5号针头反复冲洗骨髓腔至α-MEM中,计算有核细胞数,进行巨核细胞集落(CFU-MK)培养。
4 半固体CFU-MK培养
4.1 人CFU-MK培养[7] :每毫升培养体系为含5×103 CD34 + 细胞、10g/L去离子牛血清清蛋白、47.6mmol/L枸橼酸抗凝的牛血浆、体积分数为10%的人AB血清、1×10-4 mol/L2-巯基乙醇、0.34mg CaCl2 、50ng rhSCF、5ng rhIL-3、5ng rhIL-6、 5ngrhGM-CSF、常规剂量庆大霉素以及各种浓度的肝素、rhTpo或(和)兔抗rhTpo(纯IgG,10μg/ml )等的α-MEM,接种在24孔培养板,每组3孔,每孔0.33ml。各种浓度的肝素用α-MEM配制,在血浆凝块形成后加入,每孔70μl。置37℃,体积分数为5%的CO2 和饱和湿度的孵育箱中培养12天后染色计算CFU-MK集落数。
4.2 小鼠CFU-MK培养[8] :每毫升培养体系含小鼠骨髓有核细胞2×105 ,rhTpo10ng,其他培养条件同人CFU-MK的培养,但不加rhSCF、rhIL-3、rhIL-6和rhGM-CSF,培养7天后染色计算集落数。
5 CFU-MK集落的染色和计数
5.1 人CFU-MK的染色:参照Vectastain ABC试剂盒说明书的方法,略作改良。倒置显微镜下计算集落数,阳性细胞为棕褐色,以3个或3个以上的阳性细胞组成的细胞群为一个CFU-MK。
5.2 小鼠CFU-MK染色:乙酰胆碱酯酶法染色。苏木精复染后镜检CFU-MK,阳性细胞为棕黄色,计数标准同人CFU-MK。
6 统计学方法
数据以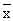
结果
1 肝素和Tpo对M07e细胞的增殖影响 在有血清培养体系中,单一肝素在浓度为1U/ml~100U/ml时对M07e细胞均无促增殖作用(P>0.05),单一Tpo浓度为1ng/ml时对M07e细胞未见促增殖作用(P>0.05),而在5ng/ml~100ng/ml时,具有明显的刺激增殖作用(P<0.05),在1ng/ml~50ng/ml时显示剂量依赖效应(Y=10528.38+667.65X,P= 0.015),当浓度为50ng/ml时效应最大,可达对照组的5.7倍,肝素(10U/ml)与Tpo(1ng/ml~100ng/ml)合用时,对M07e细胞的增殖均显示增强刺激作用(各点P值均小于0.05)(图1)。

*CPM为放射性核素每分钟闪烁计数
图1 Tpo及其与肝素合用对M07e细胞的增殖作用
2 肝素和Tpo对人脐血CFU-MK生长的影响
我们应用MACS系统从人脐带血单个核细胞中磁性正选择分离到纯度达97.6%的CD34 + 细胞。以CD34 + 细胞为靶细胞,在半固体血浆凝块培养体系中观察肝素和Tpo各自单一或联合应用对CFU-MK生长的影响,结果显示肝素在1U/ml时即能促进CFU-MK生长,集落数从对照组的55.0±7.5/5×103 CD34 + 细胞增加到96.0±3.0/5×103 CD34 + 细胞(P<0.01),但是随着肝素浓度的增大,其效应并不增强。Tpo在1ng/ml时对CFU-MK就有明显的促进生长作用,与对照组比较,CFU-MK数增加近一倍(P<0.01),随着Tpo剂量的增大,集落数逐渐增多,在1ng/ml~20ng/ml时呈剂量依赖效应(Y=88.23+12.75X,P=0.002), 当Tpo浓度为20ng/ml时,集落数达最高值,是对照组的6.3倍(P<0.01)。Tpo对CFU-MK的刺激作用可被抗Tpo抗体(10μg/ml)中和(P<0.01),而肝素(10U/ml)对各浓度的Tpo均有协同刺激CFU-MK生长作用(各点P值均小于0.05)(图2)。此外,抗Tpo抗体部分抑制Tpo有血清培养体系中CFU-MK生长和肝素对CFU-MK生长的刺激作用(P<0.05)。
3 肝素和Tpo对小鼠体内巨核细胞生成的影响
如表1所示,肝素和Tpo都能刺激小鼠体内巨核祖细胞生长(P均小于0.01)。
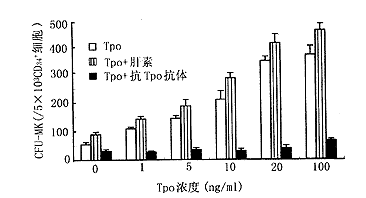
图2 Tpo及其与肝素或抗Tpo抗体合用对CFU-MK的影响 表1 肝素和Tpo各自单一或联合对小鼠巨核细胞生成的影响(n=5, |
| 组别 | 剂量 | CFU-MK数(×103 /股骨) |
| 对照组 | 1.30±0.15 | |
| 肝素 | ||
| 0.2U/次 | 2.90±0.61 | |
| 1.0U/次 | 3.00±0.18 | |
| 5.0U/次 | 3.20±0.38 | |
| Tpo | ||
| 16ng/次 | 2.90±0.79 | |
| 80ng/次 | 4.80±0.76 | |
| 400ng/次 | 7.10±1.24 | |
| 2000ng/次 | 17.10±1.47 | |
| Tpo+肝素 | (16ng/次+1.0U/次) | 8.90±1.10 |
讨论
近年研究表明,在半固体培养体系中肝素能明显地促进小鼠CFU-MK的生长,包括每集落巨核细胞数的增多和巨核细胞体积的增大,但对粒系和红系的祖细胞生长无影响,提示肝素对巨核系细胞生成有刺激作用。肝素在小鼠体内能促进骨髓巨核细胞和外周血血小板生成。最近Shen等[3] 报道临床上小剂量肝素具有明显的治疗慢性免疫性血小板减少性紫癜的作用,为治疗血小板减少症开辟了新途径。但是,肝素在巨核细胞和血小板生成中的作用机制仍不清楚,尽管已有报道肝素可以明显地中和血小板因子4和转化生长因子β1对巨核细胞集落生长的抑制作用[4] 。
我们研究的结果表明单一肝素对细胞因子(IL-3, GM-CSF, Tpo)依赖的巨核细胞白血病细胞株M07e无增殖作用,而能明显地促进Tpo对M07e细胞的增殖活性,说明肝素能增强Tpo刺激M07e细胞增殖。我们的研究显示肝素在体外也能明显地增强Tpo刺激人脐带血CD34 + 细胞衍生的CFU-MK生长。有趣的是,我们也观察到在血浆凝块培养体系中单一肝素对CFU-MK生长也有作用,并且它的活性能被抗Tpo抗体明显而不完全地抑制,同样说明肝素能增强该培养体系中的Tpo和其他一些细胞因子刺激CFU-MK生长。这一结果支持Han等[4] 的资料:肝素在小鼠体外能提高Tpo和IL-6的促巨核细胞生成的活性。我们的研究还表明,肝素和Tpo能够协同刺激小鼠体内巨核细胞的生成,也就是说,为了提高某一个体的血小板生成,如果联合应用肝素和Tpo,Tpo的剂量可以大大地减少。因此, Tpo与肝素联合应用是治疗血小板减少症的一个可能既经济又有效的方法,具有一定的临床应用前景。肝素增强Tpo刺激巨核细胞生成的机制仍不清楚,目前正在研究之中。
参考文献
1 Han ZC, Wan HY, Bellucci S, et al.Glycosaminoglycans stimulate megakaryocytopoiesis in vitro and in vivo. Exp Hematol,1993,21:1061(abstr 27A).
2 Shen ZX, Basara N, Xi XD, et al. Fraxiparin, a low-molecular-weigh heparin, stimulatesmegakaryocytopoiesis in vitro and in vivo in mice. Br J Haematol, 1994, 88:608-612.
3 Shen ZX, Li JM, Wang ZY, et al. Thrombocytopoietic effect of heparin given in chronicimmune thrombocytopoietic purpura. Lancet, 1995,346:220-221.
4 Han ZC, Bellucci S, Shen ZX, et al.Glycosaminoglycans enhance megakaryocytopoiesisby modifying the activities of hematopoietic growth regulators. J Cellular Physiol, 1996,168: 97-104.
5 Nichol J, Hornkohl A, Selesi D, et al. TPO levels in plasma of patients withthrombocytopenia or thrombocytosis. Blood, 1996, 86:371a.
6 Kaushansky K, Broudy VC, Lin N, et al. Thrombopoietin, the Mpl ligand, is essentialfor full megakaryocyte development. Proc Natl Acad Sci U S A, 1995, 92: 3234-3238.
7 Han ZC, Sensebe L, Abgrall JF, et al. Platelet factor 4 inhibits humanmegakaryocytopoiesis in vitro. Blood, 1990, 75:1234-1239.
8 Han ZC, Bellucci S, Wan HY, et al. Now insights into the regulation ofmegakaryocytopoiesis by haematopoietic and fibroblast growth factors and transforminggrowth factor β1. Br J Haematol, 1992, 81: 1-5.
收稿:1998-05-04
修回:1999-03-02, 百拇医药
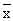 ±s)
±s)