 |
 |
关键词:HP450;肝硬化;受体,组胺H1
【摘要】 目的 研究四氯化碳诱导大鼠肝硬化的不同时期肝脏微粒体中抗组胺药敏感性细胞色素P450(HP450)及血液中组胺水平的变化趋势。方法 采用3 H-mepyramine为放射性配体,利用受体-配体结合研究技术检测HP450,同时采用荧光法检测外周血液中组胺水平。结果 在肝硬化早期,大鼠肝脏微粒体中HP450的水平降低明显,在肝硬化中期和晚期,HP450水平的降低逐渐达到一最低水平的稳定值。HP450的内在亲和力也随之改变,早期Kd值明显下降,受体的亲和力升高,然后随着病变的发展,Kd值逐渐升高,即受体的亲和力逐渐下降,但各期Kd值经统计学检验后差异无显著性(与对照组相比P>0.05)。动物血液中的组胺水平早期明显升高,到了中期和晚期后组胺下降的幅度逐渐减低。结论 组胺水平在肝硬化大鼠体内升高显著,可能对肝硬化的形成起着重要的作用。
The variance of anti-histaminergic drug sensitive cytochrome P450 in cirrhotic rats
ZANG Linquan, WANG Naiping, WEI Jinbin, et al.
The Medical Scientific Experiment Center.Guangxi Medical University, Nanning, 530021
【 Abstract】 Objective To observe the changes of anti-histaminergic drug sensitive cytochrome P450 (HP450) in CCl4 induced cirrhosis in rats. Methods Using 3H-mepyramine as radioactive ligand, the variance of HP450 was studied by means of receptor-ligand binding assay. Meanwhile fluorescence technique was used to check the changes of histamine in peripheral blood of CCl4 induced cirrhosis. Results Both the HP450 and histamine in different stages of cirrhosis were significantly higher than cirrhotic at the early stage, and were significantly decreased more than that at the medium and later stages. The Kd value and the concentration of HP450 and histamine tended to keep at a steady level. Conclusion The levels of histamine and HP450 may play an important role in cirrhosis and the possible mechanism of low HP450 in cirrhosis might be concerned with the “ down regulation” of histamine receptor.
【 Key words】 HP450 Liver cirrhosis Receptor, Histamine H1
细胞色素P450是参与体内生物活性物质、激素和外来异物包括药物代谢灭活的重要酶系。组胺及其受体在体内分布广泛。在中枢神经,组胺及其受体起着信息的传递作用;在免疫系统,组胺及其受体通过T细胞亚群中H1 、H2 受体数量的变化调节机体的免疫功能等。有研究发现,肝脏微粒体中的受体与大脑等组织中经典的H1 受体不同,最主要的是此受体对除了mepyramine以外的H1 受体拮抗剂敏感性较低,称其为mepyramine结合蛋白。进一步的研究表明,这种受体的氨基酸排列在许多部分与细胞色素P450相似。而且,细胞色素P450拮抗剂对这种“受体”也有阻断作用,但对经典的H1 (如大脑等组织中)受体却毫无影响[1] 。因此,把肝脏微粒体中这种特殊的细胞色素P450命名为抗组胺药敏感性细胞色素P450(简称HP450)。鉴于HP450在肝脏中兼具H1 受体与CytP450两种物质的特性,且广泛存在于人及哺乳动物的肝脏组织内[2] ,其在肝脏中的病理生理意义仍未明了。因此,我们对其在大鼠肝硬化中的变化进行了动态研究。
材料与方法
一、实验动物
雄性纯系Wistar大鼠,体重105.5±28.7g,由广西中医药研究所动物室提供。
二、肝硬化动物模型的制备
选用Wistar雄性大鼠90只,将其随机分为空白对照组、四氯化碳(CCl4 )肝硬化组(5.0ml/kg),其中把肝硬化组分为第一(1个月)、第二(2个月)、第三(3个月)、第四(4个月)共四组,每组18只动物。CCl4 用药程序为:每周一、三、五给予CCl4 ,第一组于给CCl4 1个月后处死,第二组于给CCl4 2个月后处死,第3组于给CCl4 3个月后处死,第4组于给CCl4 4个月后处死,处死前24小时禁食不禁饮。
三、肝脏微粒体的制备
取出新鲜肝脏组织后,用生理盐水冲洗至陶土色,取2g组织,以5ml 0.1M TMS pH7.5(Tris 6.05g, MgCl2 0.609g,Sucrose 68.4g)用DY89-Ⅰ型电动玻璃匀浆机,以500rpm/min的转速在冰水浴中上下研磨12~15次成匀浆。匀浆转移至5ml离心管中,用Hitachi 80p-7型自动制备式低温超速离心机分步离心,第一次用900rpm/min离心30分钟,取上清液进行第二次离心,100 900rpm/min,60分钟。沉淀板用0.1M 缓冲液 pH7.4加20%的甘油共2ml悬浮,于-80℃保存备用。
四、受体-配体结合实验[1]
将样品浓度稀释至1mg/kg,反应体系500μl,总结合管样品50μl,3 H-mepyramine终浓度2nmol/L,补充0.1M pH7.4 缓冲液至500μl作为反应体系,非特异结合管除了含有以上物质外,另加Triprolidine终浓度2μmol/L。在25℃水浴中反应1小时,然后用GF/B型玻璃纤维滤膜真空抽滤,用0.05M(pH7.4)缓冲液每次5ml,冲洗4次。滤膜放入Beckman SL-6500型液闪仪专用液闪杯,50℃烘干,然后加入4ml PPO/POPOP甲苯闪烁液,在液闪仪上过夜记数。
五、外周血液中组胺的测定
参见文献[3]。
六、蛋白质含量测定
按照Lowry法测定蛋白含量[4] 。
七、统计分析
华西医科大学统计学教研室编制的PEMS 2.1版统计软件包。采用±s表示均数和标准差,统计方法采用t检验、F检验及q检验。
结果
一、HP450(H1 受体)水平在肝硬化中的变化
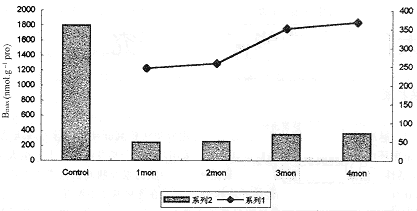
从本实验中可以看出,CCl4 诱导第1个月,17只大鼠微粒体中HP450的含量范围在186.9~304.3(均数为245.6)nmol/g pro之间,明显低于18只正常对照组大鼠的1146~2464.4(均数为1805.2)nmol/g pro的水平,与对照组比较P<0.01。Kd值在2.87~11.09(均数为6.98)nmol/L之间;虽然低于对照组的5.3~15.9(均数为10.6)nmol/L;但差异无显著性;CCl4 中毒第2、第3、第4个月,大鼠肝脏微粒体中HP450含量较中毒初期均有所增高,但都显著低于正常对照组(P<0.01),Kd值与对照组相比差异均无显著性。在CCl4 诱导肝硬化的第2个月,15只大鼠微粒体中HP450的含量在193.4~324.0(均数为258.7)nmol/g pro之间,Kd值为3.94~10.88(均数为7.41)nmol/L,第3个月13只大鼠微粒体中HP450含量在282.3~421.5(均数为351.9)nmol/g pro之间,Kd值为4.64~11.14(均数为7.89)nmol/L,第4个月10只大鼠微粒体中HP450为308.0~429.6(均数为368.8)nmol/gpro,Kd值为5.58~11.54(均数为8.56)nmol/L,各阶段HP450水平均呈显著的下降趋势(与对照组相比,P<0.01)。其中以病变第1个月下降幅度较大,在病变的中、晚期,HP450降低的幅度逐渐减小,并接近于一稳定值(见图1)。说明在CCl4 诱发大鼠发生肝硬化的各个阶段,HP450(H1 受体)均呈明显的下降趋势。
图1 CCl4 诱导肝硬化大鼠肝微粒体中HP450的Bmax 变化(系列1为肝硬化的HP450变化与对照组相比。系列2为肝硬化不同阶段HP450的变异)
二、外周血液中组胺水平在大鼠肝硬化时的变化
从实验中可以看出,CCl4 诱导第1个月,17只大鼠外周血液中组胺的含量范围在143.6~321.8(均数为232.7)μg/L之间,明显高于18只正常对照组大鼠的52.2~90.8(均数为71.5)μg/L的水平,与对照组比较P<0.01。CCl4 中毒第2、第3、第4个月,大鼠外周血液中组胺含量较中毒初期均有所减低,但都显著高于正常对照组(P<0.01)。在CCl4 诱导肝硬化的第2个月,15只大鼠外周血液中组胺含量在125.3~282.3(均数为203.8)μg/L之间;第3个月13只大鼠外周血液中组胺含量在120~259.4(均数为189.7)μg/L之间;第4个月10只大鼠外周血液中组胺含量在112.6~287(均数为199.8)μg/L,各阶段外周血液中组胺含量均呈显著升高趋势(与对照组相比,P<0.01)。说明在动物发生肝硬化时,外周血液中的组胺水平在各个时期均明显升高,随着病变时间的增加而略降低,并逐渐趋于稳定。
讨论
众所周知,受体有两个基本特征:①与配体特异性结合;②与配体结合后引起特异的生物效应。通过受体-配体结合实验测得的受体数量由两方面的因素来决定:一种是受体的最大结合量,即所测得的Bmax 值,它反映了受体的最大结合容量;另一种因素是受体与配体的内在亲和力,即由Kd值的倒数所决定。本实验采用放射性配体测定HP450受体性质,检测方法灵敏、准确,重复性好,易于控制条件,即以测得的H1 受体的数量即Bmax 值作为判断HP450数量的指标。结果发现,在实验性肝硬化中,肝脏的H1 受体的数量较正常对照组显著减少,受体的亲和力虽然增强,但与对照组相比差异无显著性,所以最大结合容量仍显著减少,证明在大鼠发生肝硬化时,肝脏微粒体中的Bmax 的降低是导致HP450(H1 受体)数量下降的主要因素。而在本实验中,肝硬化发生时受体亲和力升高的原因尚不明了。同时,用荧光法测定肝硬化大鼠外周血液中的组胺水平,发现在大鼠发生肝硬化的各个不同阶段中,组胺水平均显著升高。如前所述,既然组胺是参与机体炎症反应的主要活性物质,促进血管通透性的升高,血液中炎性介质及巨噬细胞、中性粒细胞等炎性细胞渗出增加。因此,在四氯化碳反复、持续破坏、损害肝脏时,组胺水平持续升高是否是引起肝硬化及其腹水的原因有待进一步研究证实。
在肝硬化的发生过程中,大鼠肝脏微粒体内的HP450(H1 受体)之所以发生上述改变的可能原因:一是在本实验中,当肝硬化发生后,大鼠血中的组胺浓度明显升高,与肝脏组织内的HP450(H1 受体)大量结合,机体可能会反馈性地通过“受体内移”(即组胺-受体复合物通过特殊的胞饮作用,移入细胞内部)等机制,使肝脏细胞内的HP450(H1 受体)数量下降产生“下行调节”,从而起到维护内环境稳定的作用[5] 。二是本实验中用于诱导肝硬化的CCl4 对生物膜具有损害作用,因而也可能会破坏肝脏生物膜的组胺受体而使其数量下降[6] 。由于在CCl4 的作用下,造成脂质过氧化及自由基的大量产生,从而引起CytP450下降[7] ,CCl4 直接抑制CytP450酶的合成等中间环节也有一定的关系。
国家自然科学基金资助项目
参考文献
1. Fukui H, Mizuguichi H, Liu YQ, et al. Purification of [3 H] mepyramine receptor from rat liver and its amino acid sequence homology with debrisoquine 4-hydroxylase cytochrome P-450.Eur J Pharmacol, 1990, 183:1727-1728.
2. 臧林泉,王乃平.肝脏中的组胺与细胞色素P450.中国药理学通报,1993;9:414-417.
3. 向军俭,陈华粹.组胺的荧光测定法的研究.中国医学科学院学报,1981,3:183-186.
4. Lowry OH, Rosebrough NJ, Farr AL, et al. Protein measurement with the folin phenel reagent. J Biol Chem, 1951, 193:265-275.
5. El-Gendi MA, Nassar SH, El-Bassiouni EA, et al. Histamine and histamine receptor antagonists in splanchnic compartments in schistosomal portal hypertension. Clin Pharmacol Ther, 1988, 44:396-405.
6. Slater TF. Free radical mechanisms in tissue injury. Biochem J, 1984, 222:1.
7. 仲来福,张瑾岗,张富勤,等.四氯化碳致大鼠肝损伤的机理.中国药理与毒理学杂志, 1989, 3:298-303.
(收稿:1998-03-29 修回:1998-12-03) , 百拇医药