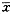 |
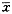 |
关键词:
细胞凋亡(apoptosis)是近年来免疫学、细胞分子生物学及临床医学研究的热点。正常的细胞凋亡过程是生命活动的组成部分,而细胞凋亡过早过多或过迟过少与多种疾病的发生有关。目前随着对糖尿病研究的深入,业已发现胰岛细胞的凋亡对1型糖尿病的发生和发展起着重要作用,对2型糖尿病的作用尚无定论。此外,细胞凋亡异常对糖尿病慢性血管并发症的发生也起一定的作用。我们对糖尿病大鼠外周血淋巴细胞和胰腺细胞的凋亡以及胰岛素对二种细胞凋亡的影响进行了研究,旨在了解糖尿病大鼠外周血淋巴细胞及胰腺细胞的凋亡情况以及胰岛素治疗是否具有抑制细胞凋亡的作用。
一、材料与方法
1.动物模型的建立:选体重250克左右的雄性Wistar大鼠18只。其中12 只以链脲佐菌素 (STZ)60 mg/kg〔溶于0.1 mmol/L柠檬酸钠缓冲液(pH 4.5),STZ浓度为1%〕一次腹腔内注射,48小时后用ONE TOUCHⅡ型血糖仪测定鼠尾静脉全血血糖,当血糖≥13.9 m mo l/L时定为糖尿病;其余6只大鼠注射相同体积的柠檬酸钠缓冲液,作为正常对照组(N组)。12只糖 尿病大鼠分成糖尿病组(D组)和胰岛素治疗组(Ⅰ组)各6只,每组自由进食及进水,D组保持血糖在较高水平;Ⅰ组根据血糖水平腹腔内注射鱼精蛋白锌胰岛素(PZI)2~3U/d,控 制任意血糖至11.1 mmol/L左右。4周后取血及胰腺组织进行各项检测。
2.方法:(1)用ONE TOUCHⅡ型血糖仪分别测定三组大鼠静脉血实验前后的任意血糖。(2)取大鼠心脏内血液3 ml,置于无菌肝素抗凝管内,以淋巴细胞分离液从新鲜血中分离淋巴细胞 ,经PBS洗涤后,用含10%人AB型血清的RPMI1640培养液将细胞调至1.5×106 /ml。将待检 的淋巴细胞置于37℃ 5%的CO2 培养24小时,吸取细胞用DNA断端标记法(TDT)标记。(3)无菌状态下取大鼠胰尾部分(经Mallory三色染色法在光镜下证实胰尾部含较多胰岛细胞〔1〕 ),置于含2%新生小牛血清(NBS)的生理盐水中制成细胞悬液,96目尼龙网过滤、洗涤。将细胞调成1×106 /ml,于含10% NBS的DMEM培养液中, 37℃ 5%的CO2 孵育24小时,取出进行Tunel法染色 ,观察胰岛细胞凋亡。(4)参照Gorczyca等〔2〕 方法,略加改良,将细胞沉淀加入含1%甲醛的PBS 1 ml,4℃ 30分钟,洗涤二次,加入0.5 μg末端转移酶,0.5nmol/L生物素 -16-dUTP,37℃ 3小时后取出,PBS洗涤后加入生物素标记的异硫氰基萤光素(FITC),室温30分钟,PBS洗涤 ,发生凋亡的细胞DNA出现断裂,可被dUTP标记在流式细胞仪及荧光显微镜下呈荧光阳性。(5)将待检 的胰腺组织置于10% NBS RPMI1640中制成细胞悬液,加0.5 mg/mlRNAase消化,37℃ 30分 钟碘化丙啶(PI)染色,流式细胞仪检测计算G0 /G1 期之前的A0 峰,以峰值面值计算凋亡量。(6)荧光显微镜下的细胞凋亡形态:早期凋亡荧光染色呈环形;中期凋亡呈斑块形与新月小体形;晚期凋亡的细胞体积缩小,呈一极亮的荧光团,或表现为凋亡小体聚集的形式〔3〕 。
3.统计学处理:所有实验数据均以±s表示,组间差异用t检验。
二、结果
1.三组大鼠血糖的变化:实验前、后N组大鼠血糖分别为(2.76±0.38)mmol/L和(2.95±0.36)mmol/L,D组分别为(17.28±2.70)mmol/L和(16.50±3.05)mmol/L,均显著高于正常组([HT P<0.001)。I组糖尿病大鼠经胰岛素治疗后,血糖由(1 7.35±2.9)mmol/L降至(12.42±1.82)mmol/L,治疗前后血糖浓度差异有显著性(P<0.05)。
2.荧光显微镜下大鼠外周血淋巴细胞的凋亡形态显示,D组呈典型的凋亡图像,呈荧光浓染。I组中也可见较多的凋亡小体。而N组仅见少量的细胞凋亡。
3.流式细胞仪测定大鼠外周血淋巴细胞和胰腺β细胞的凋亡率。
D组外周血淋巴细胞的凋亡率(40.15±10.70)明显高于N组(17.70±3.92)与I组(27.00±4.44) (P 值分别 <0.01及<0.05);N组与I 组相比差异亦有显著 性(P<0.01)。胰岛细胞凋亡的观察结果则表明:D组大鼠胰腺中发生凋亡的细胞明显增多(35.33±4.59),与N组(23.00±2.90)及I组(23.33±7.12)之间差异均有显著性(P值均<0.01)。而N组与I组 之间无差异(P>0.05)。
三、讨论
糖尿病是一组异质性代谢疾病,其发病机制极为复杂,细胞凋亡是近年来注意的又一热点。Bronwyn等〔4〕 研究发现胰岛内凋亡的细胞为β细胞。在1型糖尿病中,目前认为由于体内针对胰岛β细胞自身反应性T、B淋巴细胞凋亡减少,使β细胞受其攻击而发生凋亡增多〔5〕 ,此外免疫活性细胞产生的细胞因子如IL-1、TNF以及烷化剂或NO也介导β细胞凋亡〔6〕 。而2型糖尿病患者胰岛β细胞的胰淀粉样多肽能诱导胰岛β细胞发生凋亡〔7〕 。在糖尿病的发生过程中,由于胰岛β细胞凋亡增加,使其功能降低,可能是导致糖尿病发生的机制之一。本组实验发现糖尿病大鼠胰岛细胞凋亡比正常组显著增高,提示化学药物或免疫介导的胰岛β细胞凋亡可能部分参与了糖尿病的发生。但本组实验发现外周血淋巴细胞凋亡增多,可能使保护胰岛的T h2与杀伤胰岛的Th1 淋巴细胞比值降低,这种现象有待于深入研究。
1型及部分2型糖尿病患者的主要治疗措施是胰岛素替代治疗,最近Glasdone等〔8〕 研究发现其作用机制除了使胰岛β细胞得到充分休息外,还可能与胰岛素调节T淋巴细胞亚群,恢复Th1 /Th2 之间的平衡有关,胰岛素可促进Th2 功能,抑制Th1 细胞杀伤能力,减少对胰岛β细胞的免疫杀伤。本实验中发现I组大鼠的血糖水平以及外周血淋巴细胞和胰腺细胞 的凋亡率较D组有统计学意义的降低,似支持这一观点。I组与N组相比,I组血糖仍明显高于N组,但胰腺细胞凋亡率则与N组无差异,因此其细胞凋亡的减少除可能存在上述机制外,或许还与血糖的改善有关,有待今后积累更多的样本作回归分析后加以明确。
总之,本组研究结果显示大鼠糖尿病模型存在外周血淋巴细胞及胰岛细胞的凋亡增多,胰岛素替代治疗不仅改善血糖的控制,而且似有保护胰岛及外周淋巴细胞,延缓或减少其凋亡的作用,值得作更深入的研究。
参 考 文 献
1,龚志锦, 詹洲.《病理组织制片和染色技术》上海科学技术出版社 , 1994.253.
2,Gorzyca W, Gong JP, Darzynkiewicz Z. Detection of DNA strand br eaks in individualapoptosis cells by the in situ terminal deoxynucleotidyl tran sferase and nick translationassays. Cancer Res, 1993,53:1945.
3,Li NL, Shen BM, Zheng ZX, et al. Analysis of apoptosis by DNA end labe ling method(TDT) in leukemia cell lines HL-60 and U937. Chin J Cancer Res, 199 7,9:6-10.
4,O'Brien BA, Harmon BV, Cameron DP, et al. Apoptosis is the mode of β-cell deathresponsible for the development of IDDM in the nonobe se diabetic (NOB) mouse. Diabetes,1997,46:750-757.
5,Eisenbarth GS. Type Ⅰ diabetes mellitus: a chronic autoimmune disease . N Engl JMed, 1986,21:1360-1368.
6,Stassi G, Todaro M, Trucco M, et al. Triggering of Fas (APO-1/CD95)- induced apoptosisin human pancreatic β-cells. Diabetes, 1996,45(Suppl):240A.
7,Ankarcrona M, Dypbukt JM, Brune B, et al. Interleukin-1-induced nitr ic oxideproduction activates apoptosis in pancreatic RINm5F cell. Exp Cell Res, 1994,213:172-177.
8,Glasdone P, Nepom GT. The prevention of IDDM. Injecting insulin into t he cytokinenetwork. Diabetes, 1995,44:859-862.
(收稿日期: 1999-04-12 ) , 百拇医药