 |
 |
关键词:纤维蛋白;骨形态发生蛋白;载体;小鼠
摘要 目的:将纤维蛋白用作BMP(骨形态发生蛋白)的载体材料。方法:用5mg BMP分别与3种不同浓度的纤维蛋白制成复合物,植入小鼠肌囊后不同时间进行组织学观察、测定碱性磷酸酶活性和钙含量等。结果:纤维蛋白浓度为120mg/ml的复合物具有良好的骨诱导活性,成骨量是单纯5mg BMP的两倍。结论:纤维蛋白是理想的BMP载体材料,复合物可望应用于临床骨缺损的修复。
Studies on Fibrin as A Carrier of Bone Morphogenetic Protein Chen Keming, Liu Xingyan, Ge Baofeng, et al. Orthopaedic Institute of Lanzhou General PLA Hospital, Lanzhou 730050
Abstract Purpose : To investigate the effect of human fibrin as carrier ofbone morphogenetic protein (BMP). Materials and Methods: The composites containing 5mg BMPwere constituted with 80 mg/ml, 120 mg/ml and 150 mg/ml human fibrin seperately, and wereimplanted into the muscle pouch of mice. The bone formation were studied after 1, 2 and 3weeks of operation by histological obervation and determination of alkaline phosphataseactivity and calcium content. Results: The osteoinductive activity was quite differentamong the three composites, the composite with 120mg/ml fibrin had the highest bone yield,that is two times higher than 5 mg BMP alone. Conclusion: The fibrin of 120 mg/ml wasideal carrier for BMP, and the composites can be used to repair bone defects.
Key words Fibrin Bone morphogeneticprotein Carrier Mice
BMP(骨形态发生蛋白)是一种具有骨诱导活性的多肽类生长因子,可用于治疗骨缺损性疾病,但其载体问题已困扰人们多年。本实验将纤维蛋白用做BMP的载体材料并研究了复合物的骨诱导活性。
材 料 和 方 法
(一)BMP和纤维蛋白复合物的制备: BMP按Urist 等[1] 报道的方法从小牛新鲜皮质骨中提取,为部分纯化产品。动物实验及临床应用表明具有良好骨诱导活性,并且无明显排斥反应[2] 。纤维蛋白按Kjaergard报道的方法制备等[3] ,先从人新鲜冷冻血浆中提取纤维蛋白原,配成一定浓度后与等体积凝血酶在37℃混合,生成半透明的凝胶即为纤维蛋白。精确称取5mgBMP,分别混合到0.4ml浓度为80、120和150mg/ml 的纤维蛋白中,制成形状为圆柱形的复合物。
(二)动物实验:体重20g左右的雄性昆明小白鼠60只,随机分成四组,在乙醚麻醉下切开大腿后侧肌群,按表1植入复合物和单纯BMP。
表1 动物分组及处理
| 组别 | 肢 体 数 | 纤维蛋白 (mg/ml) | BMP(mg) |
| A | 30 | 80 | 5 |
| B | 30 | 120 | 5 |
| C | 30 | 150 | 5 |
| 对照 | 30 | 0 | 5 |
(三)术后检查:术后1、2、3周每组处死5只动物,一侧取材做组织学常规检查,HE染色。另一侧进行碱性磷酸酶活性(ALP)和钙含量测定,方法根据文献报道有所改进[4] 。标本称重后,加2 ml预冷生理盐水,在电动玻璃匀浆器内匀浆,10000 rpm离心10分钟,上清液测ALP活性,以对硝基苯磷酸钠为反应底物,410nm波长处测定。结果用每毫克标本含酶活力单位表示(U/mg)。第3周标本离心后的沉淀用10ml0.5N的盐酸消化,离心,上清液用原子吸收分光光度仪(Hitcuhi 7500)测定钙含量,结果表示为每毫克标本钙含量(ug/mg)。
| 组别 | 7天 | 14天 | 21天 | 成骨率 (21天) | 钙含量 (mg /ml) |
| A | 复合物大部分降解,可见肥 | 复合物消失,软骨正在钙化 | 编织骨、骨髓 | 5/5 | 12.74±1.21* |
| 大间充质细胞、软骨细胞和肥 | |||||
| 大软骨细胞等(图1) | |||||
| B | 复合物部分降解,细胞组成 | 团块状复合物,钙化软骨 | 同上 | 5/5 | 16.20±1.34* |
| 同A组 | |||||
| C | 复合物无明显降解,可见间 | 复合物部分降解,可见淋巴 | 复合物大部分降解,巨 | 2/5 | 4.47±0.71* |
| 充质细胞和淋巴细胞 | 细胞、巨噬细胞,小软骨团 | 噬细胞,新生肉芽组织 | |||
| 对照 | 幼稚软骨细胞团 | 钙化软骨 | 编织骨、骨髓 | 5/5 | 8.42±0.97 |
(一)组织学检查和钙含量:组织学检查、钙含量和成骨率见表2。1周时A、B组复合物周围环绕包围着大量肥大间充质细胞、软骨细胞和肥大软骨细胞等不同发育阶段的成骨性细胞群(图1),对照组则为幼稚的软骨细胞团(图2)。3周后除C组外,各组均产生编织骨和骨髓,成骨率为100%。钙含量顺序为:B>A>对照(P<0.01)。C组仅2例标本检测到骨组织,钙含量低于对照(P<0.01)。复合物中的纤维蛋白呈红色不规则团块或丝状,易于与周围肌肉组织区分,根据其降解消失的先后顺序可确定3组复合物的降解速度为:A>B>C。
(二)ALP测定结果:A组ALP水平1、2、3周均高于对照组(P<0. 05),B组2、3周时高于对照组(P<0.01),C组始终低于对照组(P<0. 05)。A、B两组间,1周时无显著差别,2、3周时B组高于A组(P<0. 05)(表3)。
表3 不同时期ALP水平
(x ±s)| 组别 | 7天 | 14天 | 21天 |
| A | 0.68±0.11** | 1.42±0.15* | 0.97±0.22* |
| B | 0.57±0.23 | 1.73±0.33** | 1.31±0.18** |
| C | 0.22±0.55** | 0.41±0.07** | 0.34±0.05* |
| 对照 | 0.45±0.10 | 1.07±0.11 | 0.75±0.19 |
讨 论
纤维蛋白是一种低抗原的生物大分子材料,易于降解,可塑性良好,在多方面符合BMP载体的理想条件。Kawamura等[5] 报道,BMP 与纤维蛋白复合后骨诱导活性显著提高。为将复合物应用于骨缺损修复,我们进一步研究了纤维蛋白浓度与复合物骨诱导活性的关系。
在可携带BMP的浓度范围内取纤维蛋白的高、中、低3种浓度分别与5mg BMP制成复合物,通过植入小鼠肌囊后不同时间做组织学观察和进行定量测定发现,3种复合物的骨诱导活性具有显著性差异,以中等浓度者(120mg/ml)活性最高, 成骨量可达单纯5mg BMP的两倍,低浓度者(80mg/ml)居其次,活性也高于单纯BMP ,最高浓度者(150mg/ml)活性最低,3周时的成骨率仅为40%(2/5)。
我们分析,纤维蛋白是立体网状结构的凝胶材料,其网孔致密性和在机体内降解速度均与浓度有关[6] 。在低浓度情况下纤维蛋白网孔稀疏易降解,BMP 很快被释放,因而载体效果不明显;而在高浓度时纤维蛋白网孔致密降解缓慢,BMP 又难以释放,载体反而起阻碍作用;只有当浓度适中时纤维蛋白边降解边释放BMP,使BMP得到持续稳定的释放,从而使复合物的骨诱导活性达到最高。
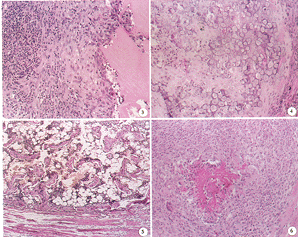
图1 A组术7天,可见复合物大量降解,周围有不同发育阶段软骨细胞×200
图2 对照组术后7天,可见幼稚骨细胞团 ×200
图3 复合物仅轻微降解,可见肥大间充质细胞和淋巴细胞 ×200
图4 B组术后2周。可见钙化软骨 ×200 图5 B组术后3周,可见编织骨及骨髓×100
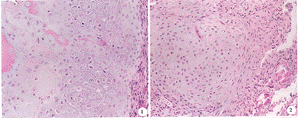
图6 C组术后3周,可见丝状纤维蛋白及巨噬细胞 ×200
参 考 文 献
1 Urist MR, Chang JJ, Lietze A, et al. Methods ofpreparation and bioassay of bone morphogenetic protein and fragments. Methods in Enzymology, 1987, 146: 294-312.
2 白孟海,葛宝丰,杨超,等 . 牛骨形态形成蛋白复合物的临床应用(附 13例初步报告) . 中华骨科杂志, 1995, 15: 20-22.
3 Kjaergard HK, Weis Fough US,Sorensen H, et al. A simple method of preparation of autologous fibrin by means ofethanol. Sur Gymecol Obstet, 1992, 175: 72-73.
4 Redi AH, Sullivn NE.Matrix-induced endochondral bone differention influence of hypophysectomy,growth hormoneand thyroid-stimukating hormone. Endocrinology, 1980, 107: 1291-1299.
5 Kawamura M, Urist MR. Humanfibrin is a physiological delivery system for bone morphogenetic protein. Clin Orthop,1988, 235: 302-310.
6 Gibble JW, Ness PM. Fibrin glue: the perfect operative sealant Transfusion, 1990, 30: 741-752.
(收稿:1997-02-25 修回:1998-01-22) , 百拇医药