 |
关键词:乳腺肿瘤 肿瘤细胞,培养的 蛋白质p53 基因,p53 基因表达 基因,WAF1/CIP1 蛋白质,mdm-2
【摘要 】 目的 研究人乳腺癌细胞株WAF1/CIP1基因的DNA状况、mRNA和蛋白的表达水平及其意义。方法 应用细胞培养、分子生物学Southern blot和Northern blot杂交以及免疫组化染色等技术,检测人乳腺癌表达野生型p53(wtp53)的MCF-7细胞和表达突变型p53(mtp53)的MDA-MB-231细胞中WAF1/CIP1基因DNA状况、mRNA和蛋白质的表达水平,研究其与mdm-2、p53蛋白的表达和细胞生物学特性的关系。结果 比较MCF-7细胞与MDA-MB-231细胞:(1)两者WAF1/CIP1基因DNA状况无明显差异,前者mRNA和蛋白质的表达水平明显高于后者(P<0.05);(2)两者p53蛋白的性质和分布不同,前者mdm-2蛋白的表达水平明显高于后者(P<0.05);(3)前者生物学特性好于后者。结论 人乳腺癌细胞株WAF1/CIP1基因mRNA和蛋白质的表达水平与p53基因表型和细胞生物学特性有关。
WAF1/CIP1/p21 gene in wild type p53 and mutant p53 human breast cancer cell lines in relation to its cytobiological features Jiang Ming, Shao Zhimin, Wu Jiong, et al. Department ofSurgery, Cancer Hospital, Shanghai Medical University, Shanghai 200032
【Abstract 】 Objective Tostudy the WAF1/CIP1 gene DNA status, mRNA and protein expressions in human breast cancercell line and its significance. Methods Using cell culture, molecular biological techniques such asSouthern blot, Northern blot and immunocytochemical methods, the WAF1/CIP1 gene DNAstatus, mRNA and protein expression levels in MCF-7 expressing wild type p53(wtp53) andMDA-MB-231 expressing mutant p53 (mtp53) human breast cancer cell lines were detectedrespectively. The p53 and mdm-2 protein expression levels and cytobiological features ofthe 2 cell lines were compared and correlated to their WAF1/CIP1 gene expression levels. Results (1)There was no difference in WAF1/CIP1 gene DNA status in the twobreast cancer cell lines. Neither of them showed gene amplificatian or deletion. However,the WAF1/CIP1 mRNA and p21WAF1/CIP1 protein expression levels of MCF-7 cellswere higer than those of MDA-MB-231 cells (P<0.05). (2)The character and cellulardistribution of p53 protein in the two cell lines were clearly different. The expressionlevel of mdm-2 proteion was significantly higher in MCE-7 than in MDA-MB-231 cells(P<0.05). (3)Compered to the other breast cancer cell line, MCF-7 cells were betterdifferentiated, grew more slowly and adhered more closely with each other. Conclusion The WAF1/CIP1 gene expression at mRNA and protein levels isassociated with p53 phenotype and some cytobiological features of human breast cancer.
【Subject words 】 Breast neoplasm Tumorcells, cultured Protein p53 Genes, p53 Gene expression Gen, WAF1/CIP1 Protein,mdm-2
野生型p53激活片段1(wild-type p53 activated fragment 1, WAF1)或CDK相互作用蛋白1(CDK-interactedprotein, CIP1)基因是新克隆的wtp53基因的下游靶基因,其转录产物(p21WAF1/CIP1 )通过结合并抑制CDKs和cyclins的活性来控制细胞周期的进程[1] ,p53基因与小鼠双微体2(murine double minute2, mdm-2)癌基因组成自动调节反馈环(auto-regulatory feedback loop)[2] ,它们表达水平的改变可能与肿瘤发生、发展机制有关[3,4] 。目前,人乳腺癌的细胞生物学特性与WAF1/CIP1、p53和mdm-2等基因的关系尚不明确。我们应用细胞和分子生物学技术,研究人乳腺癌细胞株表达野生型p53(wtp53)的MCF7细胞和表达突变型p53(mtp53)的MDA-MB-231细胞中WAF1基因DNA状况(status)、mRNA和蛋白质的表达水平及其与p53、mdm-2蛋白的表达和细胞生物学特性的关系,为了解乳腺细胞癌变和乳腺癌异质性的机制提供资料。
材料与方法
一、实验材料
1.人乳腺癌细胞株:人乳腺癌细胞株MCF-7(表达wtp53)和MDA-MB-231(表达mtp53)[5,6] 均由美国马利兰大学癌症中心Dr. Fontana赠送,本室常规传代培养。
2.质粒和试剂:pZL-WAF1质粒由美国马利兰大学癌症中心Dr. Fontana赠送,PK酶、EcoRⅠ酶、异硫氰酸胍、LSAB免疫组化染色试剂盒和DAB购自上海中达生物试剂公司(进口分装),α-32 P-dCTP和随机引物标记试剂盒购自英国Amershan公司,Geneclean Ⅱ Kit购自美国Biotechnet公司,p21WAF1/CIP1 (187)和mdm-2(SMP14)单抗购自美国Santa Cruz公司,p53单抗(Ab-2)购自美国Oncor Science公司。
二、实验方法
1.细胞培养和观察:人乳腺癌细胞株培养于DMEM/F12培养液,其中加入10%小牛血清、20 mmol/L Hepes和50 μg/ml庆大霉素,每天在倒置显微镜下观察细胞生长情况,每3天传代1次。
2.制作细胞生长曲线图:将MCF-7和MDA-MB-231各自用0.05%胰酶和0.02% EDTA混合液消化后,用显微镜计数板、台盼蓝染色活细胞计数法,制成1×104 细胞悬液,接种于24孔培养板,每天消化后计数,共9天,每组设3孔,实验结果制成细胞生长曲线图。
3.分子生物学方法:(1)制备32 P标记WAF1/CIP1基因cDNA探针:pZL-WAF1质粒经EcoRⅠ酶切,电泳,Geneclean Ⅱ kit Glassmilk法回收,特异性WAF1/CIP1基因cDNA片段为1.12 kb和1.0 kg,应用随机引物法标记α-32 P-dCTP。(2)Southern印迹方法:根据Gross-Bellard等[7] 方法提取传代后72小时的乳腺癌细胞基因组DNA,定量取10 μg DNA样品,加入EcoRⅠ酶(10 U/μg),37℃ 4小时,0.8%琼脂糖凝胶电泳,30V16小时,检查酶切效果好,凝胶经变性液和中和液依次处理,转膜。(3)Northern blot杂交方法:应用Chomcyznsky等[8] 一步法,结合本室改良提取传代后72小时的乳腺癌细胞总RNA。定量取30 μg RNA样品,1.2%琼脂糖凝胶(含2.2 mol/L甲醛),于1×MOPS电泳缓冲液中电泳,30V 16小时,检查提取总RNA无降解,18s,28s清晰,凝胶经漂洗后处理,转膜。(4)杂交和放射自显影:将Southern和Northern印迹膜分别放入杂交袋,依次加入预杂交液,42℃预杂交过夜,再加入杂交液(预杂交液+32 P标记WAF1基因cDNA探针)42℃摇床杂交过夜,次日将杂交膜漂洗2次,将膜置入暗盒,放入一张Kodak X线胶片,放射自显影3~7天。
4.细胞爬片方法:将各实验组细胞制成密度为1×105 悬液,接种于直径10 cm的培养皿中。皿中预置5片18 mm×18 mm的盖玻片,72小时后吸去培养液,用1×PBS液洗3次,加入2 ml丙酮固定4分钟,取出盖玻片,晾干,粘于载玻片上。
5.免疫组化染色法:参照LSAB试剂盒说明书步骤,进行免疫组化染色。结果判断:以细胞核内出现棕色颗粒为阳性,随机计数5个高倍镜(×40)视野中阳性细胞百分率。
6.统计学分析:应用χ2 检验,比较各组资料阳性细胞百分率的差异有无显著性。
结果
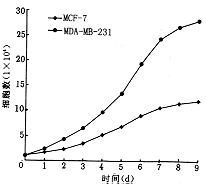
1.乳腺癌细胞形态和生长特性:倒置显微镜下观察MCF-7和MDA-MB-231细胞的生长情况,两株细胞均呈贴壁依赖性生长,前者分化较好,生长倍增速度慢,细胞形态为多角形,体积较大,胞浆丰富,核大,圆形居中,细胞之间粘附性高成膜状生长,传代时胰酶不易消化;后者分化较差,生长倍增速度快,细胞形态为圆形或长梭形,体积较小,胞浆少,核小,圆形居中,细胞之间粘附性差,传代时胰酶易消化(附图)。
附图 人乳腺癌细胞株生长曲线
2.乳腺癌细胞WAF1/CIP1基因DNA状况:Southern blot杂交结果,MCF-7和MDA-MB-231细胞的放射自显影X线胶片上均显示位于λDNA/EcoRⅠ+HindⅢ Markers DNA片段21 227bp与4 973 bp之间的约5.2 kb和5 kb的两条条带,两者未见明显差异,无丢失或扩增。
3.乳腺癌细胞WAF1/CIP1基因mRNA表达水平:Northernblot杂交结果,MCF-7和MDA-MB-231细胞的放射自显影X线胶片上均显示一条2.1kb的条带,前者显色强度明显高于后者。
4.乳腺癌细胞p21WAF1/CIP1 、mdm-2和p53的定位和表达水平:免疫组化染色结果,MCF-7和MDA-MB-231细胞p21WAF1/CIP1 、mdm-2和p53蛋白棕色染色颗粒均定位于细胞核。我们应用美国Oncor Science公司的p53(Ab-2)单抗具有识别wtp53和mtp53蛋白两种抗原决定族的特点,MCF-7细胞表达wtp53蛋白,细胞核内棕黄色染色颗粒呈均匀分布,染色强度中等,阳性细胞为85.0%;MDA-MB-231细胞表达mtp53蛋白,核内染色颗粒浓集呈不均匀分布,染色较强,阳性细胞为98.0%;p21WAF1/CIP1 蛋白染色阳性细胞百分率,MCF-7细胞为65.0%,MDA-MB-231细胞为22.5%,两者相比,差异有显著性(P<0.05);mdm-2染色结果阳性细胞百分率,MCF-7细胞为86.0%,MDA-MB-231细胞为42%,两者相比,差异有显著性(P<0.05)。
讨论
细胞周期细胞通过一系列时空有序的细胞内生化事件,实现生长、分裂、增殖的过程。细胞周期检查点(checkpoint)是保证细胞周期按次序正常运行的调控机制,其中G1 期检查点相关基因负向调控途径由野生型p53及其下游靶基因WAF1/CIP1和GADD45等肿瘤抑制基因组成,而正向调控途径由mdm-2和CDK4、cyclin D,E等原癌基因组成。细胞周期G1 期检查点正负向调控基因的功能失常是肿瘤细胞发生异常增殖的机制之一,其表达水平的异常可能与癌细胞生物学特性有关[3,4] 。
目前,有学者研究了软组织肿瘤、淋巴瘤和乳腺癌等肿瘤细胞和组织中p53基因与mdm-2基因的相互关系[9] 、外源性因子诱导肿瘤细胞WAF1/CIP1基因的表达和意义[10] 等,鲜见不同p53表型的乳腺癌细胞WAF1/CIP1基因分子生物学水平的研究以及与mdm-2、p53基因和细胞生物学特性关系的研究。
应用细胞和分子生物学技术,我们系统地检测了表达wtp53的MCF-7和表达mtp53的MDA-MB-231人乳腺癌细胞株WAF1/CIP1基因的DNA状况、mRNA和蛋白质的表达水平。比较其与p53和mdm-2蛋白的表达水平以及细胞生物学特性的关系,发现MCF-7细胞分化好,生长倍增速度慢,细胞之间的粘附性好;而MDA-MB-231细胞分化差,生长倍增速度快,细胞之间粘附性差。两者p53蛋白的染色强度和表达分布均不一样,反映了p53蛋白不同的性质和功能状态。前者WAF1/CIP1基因mRNA、p21WAF1/CIP1 和mdm-2蛋白的表达水平均明显高于后者(P<0.05),而WAF1/CIP1基因的DNA状况两者无明显差异,说明人乳腺癌细胞WAF1/CIP1基因mRNA和蛋白质的表达水平与p53基因的功能状况和细胞生物学特性有关。
我们认为,MCF-7细胞WAF1/CIP1基因的表达是通过依赖于wtp53基因功能的途径来进行调控。该细胞p21WAF1/CIP1 蛋白表达水平较高,通过结合并抑制CDKs和cyclins的活性来控制细胞周期G1 期的进程,细胞表现为生长速度较慢,恶性度较低,且WAF1/CIP1基因直接与细胞分化有关[3] 。MCF-7细胞p53基因为野生型,其恶性表现可能与mdm-2蛋白表达较高结合并抑制wtp53蛋白有关[2] 。据此,是否能解释临床上乳腺癌组织标本检测p53基因突变和丢失仅为20%~25%,而p53蛋白免疫组化染色结果阳性率为40%~70%的原因,因为mdm-2蛋白与wtp53蛋白结合使后者稳定性增加易于检测[3] ,这一点我们将另行研究。MDA-MB-231细胞的生长速度较快,恶性度较高可能与mtp53蛋白表达水平较高、而WAF1/CIP1基因mRNA和蛋白质的表达水平较低有关,mdm-2蛋白可能不是主要因素[6] 。本实验结果为以后研究乳腺癌组织标本p53基因与其相关基因WAF1/CIP1和MDM-2等的关系与临床意义提供了新的思路。
参考文献
1El-Deiry WS, Tokino T, Velculescu VE, et al. Waf1, a potential mediator of p53 tumor suppression. Cell, 1993, 75: 817-824.
2Momand J, Zametti CO, Olson DC, et al. The mdm2 oncogene protein forms a complex with p53protein and inhibits p53-mediated transactivation. Cell, 1992, 69:1237-1245.
3Hartwell L, Kastan MB. Cell cycle control and cancer. Science, 1994, 266: 1820-1828.
4Enoch T, Norbury C. Cellular responses to DNA damage: cell cycle checkpoints, apoptosisand the roles of p53 and ATM. TIBS, 1995, 20:426-430.
5Runnebaum IB, Nagarajan M, Bowman M, et al. Mutations in p53 as a potential molecularmarkers for human breast cancer. Proc Natl Acad Sci USA, 1991, 88: 10657-10661.
6Sheikh MS, Shao ZM, Hussain A, et al. The p53-binding protein MDM2 gene is differentiallyexpressed in human breast carcinoma. Cancer Res, 1993, 53: 3226-3228.
7Cross-Bellard M, Oudet P, Chambon P, et al. Isolation of high molecular weight DNA frommammalian cells. Eur J Biochem, 1973, 36: 32-35.
8Chomczynsky P, Sacchi N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Amnal Biochem, 1987, 162: 156-159.
9Bueso-Ramos CE, Manshouri T, Haidar MA, et al. Abnormal expression of mdm-2 in humanbreast carcinoma. Breast Cancer Res Treat, 1996, 37: 179-188.
10El-Deiry WS, Harper JW, O′connor PM, et al.WAF1/CIP1 is induced in p53-mediated G1 arrest and apoptosis. Cancer Res, 1994, 54:1169-1174.
(收稿:1997-10-27 修回:1997-12-12) , 百拇医药