关键词:IL-12;基因转染;树突状细胞;肿瘤疫苗;Th1/Th2分化
摘 要 目的:探讨IL-12基因转染的树突状细胞(DCs)能否体外加强细胞免疫反应。方法:脂质体转染(经过Flt-3L、SCF、GM-CSF刺激)增殖周期中的DCs前体细胞。加入GM-CSF、IL-4和TNF-α扩增转染细胞。在流式细胞仪上分析细胞表型及IL-12的表达。成熟DCs装载上分别能与HLA-I类 和HLA-II类分子结合的多肽,观察IL-12基因转染DCs对特异性Th细胞发育及特异性CTL诱导和功能的影响。结果:IL-12基因转染细胞在上述细胞因子作用下发育成为能有效表达IL-12并具有典型形态学与表型特征的DCs。在装载上CD4+ T细胞表位HBcAg50-69 后,能诱导这些细胞发育成为IFN-γ产生型的Th1细胞。HLA-A201亚型DCs在其同时装载CD4+ T和CD8+ T细胞相应的表位后,IL-12基因转染DCs所诱导产生的自身淋巴细胞的CTL效应增强。结论:IL-12基因转染的DCs能增强对Th1细胞的刺激和CTL效应的诱导能力,提示它在肿瘤疫苗发展中的潜力。
中国图书分类号 R398
IL-12 engineered human dendritic cells in enhancing antigen presenting functions to augment cell mediated immune response in vitro
QU Chun-Feng GU Pei-Di JU Ji-Yu
(National Laboratory of Molecular Oncology, Cancer Institute, Chinese Academy MedicalSciences,Beijing 100021)
Abstract Objective:To explorewhether IL-12 engineered human dendritic cells (DCs) might enhance its antigen presentingfunctions to augment cell mediated immune responses. Methods: The early replicatingprogenitors of DCs (stimulated by Flt-3L, SCF and GM-CSF) were transfected with IL-12recombinant retroviral vector by lipofection. The transfected cells were driven throughcommitted expansion into DCs lineage by adding the above cytokines plus IL-4 and TNF-α.IL-12 transfected and untransfected DCs pulsed with HBcAg50-69 and p53264-272 were used to induce specific Th and CTL immune responses in vitro. Results: Afterculturing in the cocktail of the above mentioned cytokines, IL-12 transfected DCsdeveloped and maintained the characteristic morphological and phenotypic features of DCs.When the DCs were pulsed with a broad spectrum class II epitope HBcAg50-69 , theIL-12 transfected DCs stimulated the autologous lymphocytes to proliferate to a higherlevel, and the primed Th cells released more IFN-γ when compared with the effects shownin untransfected DCs. Meanwhile, the production of IL-4 was decreased. Preliminaryexperiment in HLA-A201 subtype system showed that the autologous lymphocytes, primed byIL-12 transfected DCs loaded with class I and class II restricted epitopes, secreted more IFN-γ when they were subsequently co-cultured with A201 target cells loaded only withclass I restricted peptide. The latter fact indicated that the specific CTL response wasenhanced. Conclusion: IL-12 engineered human dendritic cells enhanced its functions tostimulate Th1 cells as well as to induce specific CTL effect, showing its promise fordeveloping cancer vaccine.
Key words IL-12 Dendritic cells Gene transfection Cancervaccine Th1/Th2 differentiation
IL-12通过增强特异性与非特异性细胞免疫应答,而成为一种有效的抗肿瘤、抗感染免疫的生物佐剂[1] ,但其全身应用毒性严重。因此,寻找合适的应用途径具有重要的临床意义。我们以前对p53蛋白的一些多肽抗原表位研究显示:p53264-272 多肽是HLA-A201个体CD8+ T细胞识别表位[2] 。HBcAg50-69 多肽是一段能够较广泛地被CD4+ T淋巴细胞所识别的HBV核心抗原表位[3] 。本文报道采用这两种多肽抗原表位观察了IL-12基因转染的DCs在呈递抗原多肽后对特异性Th细胞的增殖与分化、以及对特异性CTL的诱导是否有增强的效应,籍以探讨其在肿瘤疫苗发展中的应用潜力。
1 材料与方法
1.1 载体与细胞 人IL-2逆转录病毒双亚基共表达载体pL35P40SN是在pLXPXSN载体(由NIH的Dr.R. Morgen 赠送)基础上构建[4] 。174CEM T2细胞株由美国NCI的Dr.E. Appella赠送。
1.2 抗原性多肽 p53264-272 为HLA-201 分子限制的CD8+ T细胞识别表位。氨基酸序列为LLGRNSFEV,由 Dr. E. Appella 赠送,HBcAg50-69 为HLA-II类分子限制的CD4+ T细胞识别的较广谱的抗原表位,氨基酸序列为PHHTALRQAILCWGELMTLA,由青岛大学医学院分子病毒学实验室合成。
1.3 主要试剂 细胞因子SCF、GM-CSF、Flt-3L、IL-4,IL-12定量ELISA检测试剂均为R&D产品,TNF-α为北方同正公司产品,IL-4和IFN-γ检测试剂为晶美公司进口分装试剂,DOTAP 为B.M. 产品。
1.4 PCR-SSP进行HLA-A2型及A201亚型分析 方法参见文献[2,5],所用引物购自英国Bristol大学移植科学部。
1.5 人脐带血DCs的培养及IL-12基因转染 25 ng/ml SCF溶于0.1 mol/L pH8.5 Na2 HPO4 中,每孔0.8ml加入到6孔细胞培养板中,4℃过夜。经淋巴细胞分离液分离的新生儿脐带血(产后12h内)单个核细胞加入到上述细胞培养板中,37℃孵育1~2 h,用预温到37℃的培养液进行洗涤。粘壁细胞加入Flt-3L、GM-CSF、SCF刺激48~50h,进行DOTAP脂质体介导的基因转染,DOTAP与DNA之比为4:1,转染过程中继续加入上述细胞因子,转染共进行8~8.5h。此后于培养的第5、第8天再转染两次,每次2~3 h。转染终止后加入含细胞因子的培养液继续培养。第8天后加入IL-4和TNF-α,12~14d收集细胞进行其表型鉴定及细胞因子的表达检测及功能分析。
1.6 培养细胞表型分析 收集培养12~14 d的细胞,进行CD3、CD14、CD19、CD80、CD86、MHC-I、MHC-II的间接免疫荧光染色(所用试剂均为DAKO产品),在Coulter流式细胞仪上进行检测。
1.7 肽特异性淋巴细胞增殖实验 12~14 d常规培养成熟的DCs、重组人IL-12基因载体及空载体pLXPXSN转染的DCs,经洗涤后悬浮于AIM-V培养液中(1×106 ml-1 ),每孔0.2 ml加到24孔板中。然后加入HBcAg50-69 多肽使其终浓度达到10μg/ml,混匀后放置于37℃ 2 h。加入液氮冻存复苏后的自身淋巴细胞0.5ml,使刺激细胞与应答细胞数之比为1:10。放置于37℃培养,24 h后加入IL-2(10U/ml)。第7天按上述方法重复刺激1次。收集培养细胞上清进行IFN-γ、IL-4的检测(按厂家说明进行)。将上述增殖细胞分3份均匀加入到96孔培养板中,随后加入3 H-TdR继续培养16~18h,收获细胞进行β计数。采用刺激指数(Stimulating Index, SI)进行分析:
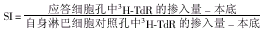
1.8 多肽特异性CTL的体外诱导及其活性的检测 参照文献[2,5]对所收集到的脐带血通过PCR-SSP法筛选HLA-A201亚型个体,其DCs前体细胞按照前述方法进行IL-12基因转染及DCs的扩增培养。部分培养DCs于第7天加入TNF-α诱导24h促进其成熟。将细胞洗涤后悬浮于AIM-V中,置于24孔板中加入HBcAg50-69 及p53264-272 两种多肽,终浓度均分别为10 μg/ml。余同上。通过此方法诱导的细胞作为效应细胞。174CEMT2细胞按前述方法进行p53264-272 多肽的结合,多肽浓度为50 μg/ml,洗涤后作为CTL的靶细胞。两者共同培养,收集培养48h的上清检测其IFN-γ(按厂家说明进行)的分泌能力。
2 结果
2.1 人脐带血造血干细胞的富集 在CD34阳性的造血干细胞的表面通常也存在着一种酪氨酸激酶受体——c-kit,其配体为干细胞因子(Stem Cells Factor,SCF)[6] 。本实验采用预包被于细胞培养板上的SCF来富集人脐带血中的c-kit阳性造血干细胞,在光镜下观察发现,富集得到的造血干细胞较牢固地粘附于细胞培养板上。采用FITC标记的CD34抗体进行直接免疫荧光染色,流式细胞仪测定分析显示,通过上述方法所富集到的细胞,其CD34阳性率约80%。
2.2 IL-12基因表达载体转染DCs前体细胞后DC的发育和IL-12的表达 通过形态学观察和流式细胞仪分析,发现IL-12基因转染的DCs在培养12~14d后,发育为具有典型形态学及表型特征的DCs细胞,细胞表面有大量的CD80、CD86、HLA-I、HLA-II分子表达。通过细胞内细胞因子染色法检查发现,IL-12在转染细胞中的表达可达到50%,每106 细胞中IL-12的产量为1.2~1.8 ng/24 h。
2.3 IL-12基因转染的DCs对Th细胞增殖和分化的影响 IL-12基因转染DCs对CD4+ T淋巴细胞增殖水平的影响结果如图1所示。为确定上述对HBcAg50-69 多肽产生应答反应的Th细胞的性质,实验中收集在Th应答反应过程中的细胞上清,分别测定了IFN-γ和IL-4的产量,结果如图2所示。以DCs作为抗原提呈细胞,IL-12基因转染的DCs在诱导特异性Th细胞分化过程中,IFN-γ的产量明显高于空载体转染的DCs,而IL-4的产量则降低。这种细胞因子产量的显著差异在第2次刺激后更为明显(见图2)。表明IL-12基因转染的DCs在负载上HBcAg50-69 多肽后能够诱导IFN-γ产生型的Th1细胞的分化。
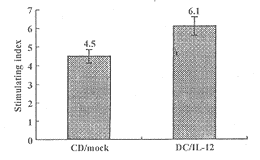
图1 IL-12基因转染的DCs对Th细胞增殖的影响
Fig.1 IL-12 engineered DCs enhanced the proliferation of Th cells
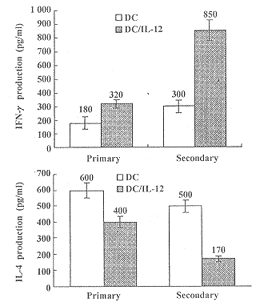
图2 IL-12基因转染的DCs对IFN-γ和IL-4产量的影响
Fig.1 The production of IFN-γ and IL-4 by IL-12 transfected and nontransfected DCs
2.4 IL-12基因转染的DCs对CTL的诱导及其活性的影响 IL-12基因转染的HLA-A201亚型个体脐带血DCs,在负载上HBcAg50-69 和p53264-272 时与自身淋巴细胞作用7天后,光镜下可见到有较多的淋巴细胞克隆在DCs周围形成。收集这些增殖的细胞作为效应细胞。采用负载了p53264-272 多肽的T2细胞作为靶细胞,按效:靶=10:1的比例混合,进行特异性CTL活性测定,通过检测其与靶细胞作用后IFN-γ的释放来反映其CTL效应。结果发现IL-12基因转染的DCs所诱导的CTL在与靶细胞作用后,IFN-γ的产生明显升高。每105 细胞可产生550pg/ml,而未转染的DCs所诱导的同样数量的CTL在与靶细胞作用后,IFN-γ的产量为150pg/ml。
3 讨论
在机体生理条件下,抗原递呈细胞(APC)通过局部分泌产生IL-12诱导Th0→Th1的分化,有效产生细胞介导的免疫应答反应[1] 。然而,在感染及肿瘤发生过程中,APC自然分泌的IL-12不能有效拮抗其微环境中IL-4和IL-10的作用,致使Th1的发育受到一定的阻碍[7] 。采用预包被于细胞培养板上的SCF富集脐带血中的造血干细胞,加入Flt-3L、SCF、GM-CSF刺激后,进行IL-12基因的转染。随后,在GM-CSF、IL-4和TNF-α作用下,细胞发育成为能够表达外来IL-12基因并具有典型DCs形态学和表型特征的细胞,为促进T淋巴细胞识别抗原后发育成Th1提供了可能。
实验结果显示,IL-12基因转染的DCs在负载CD4+ T细胞的抗原表位HBcAg50-69 多肽后,T淋巴细胞产生明显的增殖反应,并且IFN-γ的产量也明显高于空载体转染的DCs,而IL-4的产生量则显著降低,这种细胞因子产量的差异在第2次刺激后更为明显。提示IL-12基因转染DCs在CD4+ T细胞抗原表位存在下,抑制了IL-4产生型Th2细胞的分化,促进IFN-γ产生型Th1细胞的产生。
在DCs同时负载上能够与HLA-I、HLA-II类分子相结合的多肽后,初步实验结果显示,IL-12基因转染DCs所诱导产生的效应细胞,在与相应靶细胞作用后,特异性CTL所释放的IFN-γ产量是空载体转染DCs诱导细胞释放IFN-α产量的3倍。提示在CD4+ 和CD8+ T细胞抗原表位的共同存在下,IL-12在抗原提呈局部通过诱导Th1细胞的发育,而有可能促进CTL的应答反应,并能加强CTL对其特异性靶细胞的杀伤活性。
采用p53264-272 和HBcAg50-69 作为肿瘤抗原多肽研究模型,在体外实验中发现:与基因未转染的DCs相比,IL-12基因转染DCs在装载上CD4+ T细胞表位后,能增强这类淋巴细胞的增殖水平,并促进IFN-γ的分泌,向着有利于Th1细胞分化的方向发育;同时装载上CD4+ 和CD8+ T细胞表位后,显著增强特异性CTL的应答反应。表明IL-12基因转染DCs的生物佐剂效应较单纯DCs更强,在其装载肿瘤相关的抗原后,可能成为一种值得探索的抗肿瘤的治疗性疫苗。
作者简介:曲春枫,女,免疫学博士;孙宗棠,男,教授,博士生导师,主要从事肝癌的发生及预防研究
参考文献
1,Trinchieri G. Interleukin-12: aproinflammatory cytokine with immunoregulatory function that bridge innate resistance andantigen-specific adaptive immunity. Annu Rev Immunol,1995;13:251
2,侯亚菲, 孙宗棠, Appella E et al. 北方汉族人群HLA-A2亚型分布及p53的合成多肽体外诱导CTL反应.中华微生物学与免疫学杂志,1999;19(1):47
3,Chisari F V, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol,1995;13:29
4,曲春枫,孙宗棠. 人IL-12基因克隆、表达及生物学活性鉴定.中国免疫学杂志,1999;15(1):13
5,Browning M J, Krausa P, Rowan A et al. Tissue typing the HLA-A locus from genomic DNAby sequence-specific. PCR Proc Natl Acad Sci USA, 1993;90:2842
6,Zsebo K M, Willias D, Geissler E N. Stem cell factor is encoded at the S1 locus of themouse and is the ligand for c-kit tyrosine kinase receptor. Cell, 1990; 63:213
7,Gorham J D, Guler M L, Fenoglio D et al. Low dose TGF-α attenuates IL-12responsiveness in murine Th1 cells. J Immunol,1998;161:1664
收稿2000-01-28
修回2000-04-20 , http://www.100md.com