耳蜗用微量渗透泵灌注生长因子对庆大霉素致聋豚鼠的治疗作用
http://www.100md.com
李胜利. 朱宏亮. 申卫东. 王林古.
耳蜗.微量渗透泵.灌注.表皮生长因子.扫描电镜.听觉诱发电位.
参见附件(206kb)。
作者:李胜利 朱宏亮 申卫东 王林古
单位:(西安医科大学第二附属医院耳鼻咽喉科学教研室 西安 710004)
关键词:耳蜗;微量渗透泵;灌注;表皮生长因子;扫描电镜;听觉诱发电位
西安医科大学学报000218摘要 目的 应用微量渗透泵(Mini-Osmotic pump, MOP)给正常动物耳蜗和庆大霉素(GM))致聋豚鼠耳蜗长期恒速灌注人工外淋巴和表皮生长因子(Epidermal growth factor,EGF),观察其对听力和内耳组织形态的影响。方法 用Alzet model-2004型MOP向三组各10只的正常豚鼠A组和GM致聋豚鼠B组,耳 蜗底回鼓阶灌注人工外淋巴液,同法给GM致聋豚鼠耳蜗灌注EGF设为C组,在MOP埋植前和埋植后1、2、3和4周测定ABR反应阈值,用扫描电镜观察各组动物耳蜗Corti器的组织形态改变。结果 MOP给正常动物灌注人工外淋巴对ABR和耳蜗内外毛细胞无明显影响,而给GM致聋组豚鼠耳蜗灌注EGF可促进受损内耳组织细胞修复,使ABR阈值改善。结论 应用MOP可向耳蜗长期恒速灌注人工外淋巴,对耳蜗功能和形态无明显影响;而长期恒速灌注EGF对GM耳中毒豚鼠的耳蜗毛细胞有修复治疗作用。可使ABR反应阈值下降。
中图分类号 R764.43+1 文献标识码 A 文章编号 0258-0659(2000)02-0137-04
Effect of chronic infusion of EGF into the cochlea by an mini-osmotic pump on the function and morpholog on guinea pigs
Li Shengli Zhu Hongliang Shen Weidong
(Department of Otolaryngology,Second Affiliated Hospital, Xi′an Medical University, Xi′an 710004,China)
ABSTRACT Objective To observe the effects of chroni infusion of drugs into the cochlea using mini-osmotic pump (MOP) on the function and morpholog in normal and defened guinea pigs by gentamycin(GM),infusion drugs were epidermal growth factor(EGF) and artifical perilymph (AP).Methods MOP stainless steel tube were surgically implanted into the basal turn of the experiment guinea pigs cochlea.EGF were infused into 10 of the experimental guinea pigs GMAP was into 10 normal and GM .After MOP implaned 1,2, 3 and 4 weeks, auditory brainatem response(ABR) threshold and cochlea morphology were examined.Results 10 normal guinea pig with AP infused cochlea,ABR threshold were kept in the normal level and no hair cell loss was found.In GM groups with EGF infusion cochleas,ABR thresholds showed vecovery.Conclusion This study suggests that long term and quickly EGF infusing into cochlea can recovery hearing function and repair the hair cell trauma.
KEY WORDS cochlea mini-osmotic pump infusion epidermal growth factor
耳蜗深隐于颅骨的颞骨之中 , 具有血-脑和血-迷路等多重屏障, 致使某些蛋白类生长因子和神经细胞营养药物难以充分到达内耳组织[1],给内耳疾病的治疗造成一定困难。人们正积极探索将药物直接灌流入内耳的技术[2],以有效治疗感音神经性耳聋,我们应用微量渗透泵(Mini-Osmotic pump, MOP)将人工外淋巴液和表皮生长因子(Epidermal growth factor,EGF),恒速持续灌注入庆大霉素(Gentamycin, GM)致聋豚鼠耳蜗,观察MOP埋植后动物ABR反应阈值的改变,以及对耳蜗Corti器组织形态的影响。以评价耳蜗直接给药的可行性。 1 材料与方法
1.1 动物 选用体重300~400g健康青年豚鼠30只,雌雄不拘,动物由西安医科大学实验动物中心提供。随机选取20只按80mg/(kd*d)肌注庆大霉素10~14d,动物ABR反应阈值升在90~105BSPL范围内,造成感音神经性耳聋动物模型后,再随机分B、C两组埋植MOP,C组MOP灌装EGF为治疗组,B组MOP灌装人工外淋巴液为治疗对照组。余10只A组MOP灌装人工外淋巴液的为正常对照组。
1.2 ABR反应阈值测定方法 对3组动物MOP埋植前后在体1、2、3和4周时进行ABR反应阈值测定。实验动物用硫喷妥钠按40mg/kg剂量腹腔注射麻醉,固定于自制动物固定架上,颅顶正中为记录电极,同侧乳突为参考电极,鼻尖为接地电极,用Dantec Neuromatic-2000c诱发电位仪测试。用短声极性交替刺激,扫描时间10ms,重复率11.1次/s,带通滤波,叠250~500次。以Ⅰ、Ⅲ、Ⅴ波出现的最低刺激强度为反应阈值。
1.3 耳蜗灌注液配方 生理性人工外淋巴液(按解放军总医院于宁等方法配制)NaCl 125mmol/L, KCl 3.5mmol/L, NaHCO3 25mmol/L,NGGL2 1.20mmol/L,NaH2PO4 0.75mmol/L,CaCl2 1.3mmol/L。葡萄糖5.0mmol/L,配好后调pH 为7.4,过滤消毒后分装待用。
EGF 1g/支系粉剂(Sigma, USA)用无菌人工外淋巴溶解为4ng/μl的溶液。
1.4 微量渗透泵 应用加拿大Alzet公司生产Model-2004型Mini-Osmotic pump (MOP)。泵速度(0.25±0.05)μl/h,使用有效期28d,施药量200μl。
MOP灌装药液方法详见说明。在无菌状态将贮药池垂直放置,用充液管将人工外淋巴和EGF溶液充装在MOP贮液池中,将导液管用相同溶液充满,随后将导液管缓慢地垂直插入贮药池内,可看到多余溶液由针尖溢出。将灌装好的MOP置于无菌生理盐水中过夜,以保证MOP在植入前能正常工作。
1.5 耳蜗埋植MOP手术方法 实验动物用硫喷妥钠按40mg/kg腹腔注射麻醉,利多卡因右侧耳后局麻,耳后背腹侧进路暴露听泡,用尖刀削破听泡骨壁,扩大骨孔,暴露出耳蜗底回,手术显微镜下,在耳蜗底回鼓阶处骨壁钻一小骨孔,作为灌注针入路,将MOP导液管细钢针尖由骨孔刺入鼓阶,深约0.2mm,当进入鼓阶后,用骨胶粘封骨孔固定针头。听泡骨孔用调和好的自凝牙托粉粘堵,钢管出听泡向后背打90~120°弯角,以使导液塑料避免打折,保证MOP灌流畅通。手术完成后再沿切口向耳背部皮下钝性分离,造成一纵贯条形囊袋,将MOP泵体埋植其中,疏通导液管畅流入耳蜗后缝合切口并包扎,随后每天给手术动物肌注20万单位青霉素抗感染。各组动物灌注药物及分组见表1。
表1 各组动物MOP灌注数目及埋植期
组 别
耳蜗灌药
分 类
动物数
(只)
MOP基值
年数(年)
灌注时
期(d)
A组正常动物
人工外淋巴
10
10
28
B组GM致聋动物
人工外淋巴
10
10
28
C组GM致聋动物
EGF
10
10
29
1.6 耳蜗Corti器组织形态观察 在MOP埋植28d后,测定ABR反应阈值后动物断头,取出MOP泵体,从听泡外剪断导液管,分离颞骨取出听泡,暴露出耳蜗,在手术显微镜下观察导液管钢针在耳蜗底回固定及与周围组织结构的关系,将园窗和卵园窗开放,在蜗顶挑一小孔,用2.5% PBS戊二醛固定液固定耳蜗10h,PSB冲洗后入1%锇酸后固定,梯度乙醇脱水,临界干燥,喷金后Kyky 2000型扫描电镜下观察手术侧Corti器组织形态。
2 结 果
2.1 MOP埋植后各组动物ABR反应阈值变化
正常动物右侧耳埋植充装人工外淋巴MOP后1到4周的ABR反应阈值无明显改变,基本在正常的听阈范围内;GM致聋豚鼠在MOP埋植前ABR阈值在93~105dB之间,埋植后充装人工外淋巴液组ABR逐渐升高,而充装EGF动物组灌注3~4周ABR阈值有一定下降,与人工外淋巴组相比有显著性差异。说明EGF可帮助恢复GM损害的耳蜗功能。结果见表2。
2.2 MOP埋植后中耳和内耳组织形态改变
MOP埋植后正常组和GM组灌流人工外淋巴液动物各有1只中耳感染,有粘脓性分泌物充满听泡,听泡骨壁增厚,耳蜗骨壳有骨质侵蚀和钙质沉着;GM组灌注EGF的10只动物中2只动物中耳有轻度感染,可见中耳粘膜充血水肿,其余动物均见耳蜗底回灌流孔周围有上皮增生并覆盖于蜗壳骨壁上,其上有蔓生的血管明显分布。另一只动物可见听泡骨孔处长出的表皮攀附在导液管上,并已形成一皮管桥接在耳蜗底回上,可能系EGF由接口浸出促进组织增生所致。其余动物未见明显病理改变。表2 各组动物MOP埋植前后ABR反应阈值(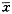 ±s
±s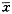 ,dB) 组 别
,dB) 组 别
MOP
灌药组别
MOP
埋植前
MOP埋植后
1周
2周
3周
4周
A组正常动物
人工外淋巴
43.6±2.4
44.5±3.6
44.8±2.9
43.8±2.5
43.8±1.8
B组GM致聋组
人工外淋巴
94.3±5.4
86.7±9.8
87.2±8.3
95.4±6.2
99.2±5.7
C组GM致聋组
EGF
93.6±6.8
94.7±8.4
91.5±5.9
90.4±10.2
88.8±8.4
B、C组与A组比较*P<0.01
图1 应用MOP向正常豚鼠耳蜗灌注人工外淋巴液4周后,Corti器无内外毛细胞损害消失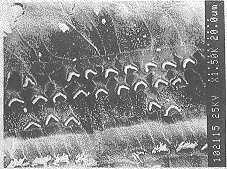
图2 GM致聋豚鼠耳蜗第三回内外毛细胞严重损害消失。用MOP向耳蜗灌注EGF未见毛细胞修复及再生出现
图3 GM致聋后EGF灌流4周后
正常动物MOP埋植向耳蜗灌液人工外淋巴4周后,SEM观察未见明显的内外毛细胞损害消失,无静纤毛束散乱,倒伏及消失现象,Corti器组织形态基本正常(图1)。GM致聋后豚鼠耳蜗底回到第三回内外毛细胞严重损害消失(图2)。可 见有广泛的Corti器消失和萎缩,外毛细胞静纤毛束消失,表皮板消失后邻近指状突充添其位,其上有微绒毛丛生(图3)。MOP埋植灌流人工外淋巴液可见病理变化同GM致聋所见。而MOP埋植灌流EGF组动物可见底回的内外毛细胞损害程度减轻,内外毛细胞消失数目减少。萎缩Corti器组织很少见到,说明EGF对Corti器有治疗作用。
3 讨 论
内耳由于具有血-脑和血-迷路双重屏障作用,可能使某些蛋白类生长因子和神经营养药物难以充分到达内耳[1],故给许多内耳疾病治疗带来极大的困难。近几年许多研究证明,体外培养的耳蜗Corti器用生长因子类药物可以促进毛细胞再生和修复[3,4],给耳聋治疗带来了极大的希望,但在体研究至今尚未取得突破。目前国内外耳科学者在耳蜗给药途径上进行积极探索,已在进行转基因给药、中耳载体渗透给药和耳蜗直接给药诸方法的研究[5]。Brown JN等1993年开始应用微型渗透泵耳蜗灌流给药[2]。胡博华等1998年用微型渗透泵进行耳蜗灌流Hank液认为不会对耳蜗产生明显影响[6]。本实验表明MOP埋植向耳蜗灌流人工外淋巴对内耳组织形态无明显影响,与上述研究结论相同。但在长期向GM致聋豚鼠耳蜗灌流EGF后,能促进受损的Corti器修复。ABR测定EGF灌流组的听阈值亦有一定的恢复(表2)。所以应用MOP向耳蜗直接给药能对GM致感音神经性耳聋起到一定的治疗作用。但应在技术方法进行完善后,方可应用于人类。
微渗透泵是一种崭新的持续长久给药的方法,泵体由3个同心层—贮药池、渗透性套筒及控制渗透泵药物释放速度的半透膜外层构成。其原理为组织渗出液由半透膜进入渗透性套筒内,其内置有高浓度的NaCl结晶的驱动物质,该物质膨胀压迫贮药池囊壁,使囊内药液沿内导液管流入灌注部位。优点是局部给药浓度高,避免全身副作用,另外对价值昂贵的珍稀药品用量少,而靶效应高。我们应用的是加拿大Alzet公司的2004型微量渗透泵,可持续内耳给药28d。避免了血脑和血迷路等多重屏障,从本实验看MOP泵的导管接口要严密,消毒要充分, 一般未发现组织排异。以往国外有关报道证实MOP可直接植入不同动物皮下腹腔,再通过导管支达膀胱、胃肠、子宫、静脉、动脉等空脏器,或局部组织(脑室、脑内局部核团、外周神经等)[7]。MOP在内耳的应用才起步,有必要进行深入研究。
许多研究证明生长因子类物质可促进内耳受损的神经和细胞修复再生[3,4],但有关哺乳动物的在体试验尚未获得成功。国内翟所强等直接给耳蜗打孔灌入αFGF和βFGF显示对爆震性聋豚鼠CAP反应阈恢复有促进作用,在耳蜗声损伤过程中有保护和修复功能[8]。王锦玲等也同样发现EGF对爆震性聋豚鼠耳蜗毛细胞损伤修复可能有关[9]。Kopke根据近几年的研究对神经营养因子对内耳的作用进行临床推断显示诱人的前景[1]。本研究初步证明耳蜗直接灌注EGF对庆大霉素致聋豚鼠的受损耳蜗Corti器有一定的帮助恢复作用,能提高听力功能。但尚需探讨更有特效的内耳灌注治疗药物,以推广应用于人类感音神经性耳聋的防治。此项研究具有一定的应用前景。
国家自然科学基金(39400145)和卫生部科学研究基金项目(320,4100-024)
参考文献
1,Kopke R,Staecker H,Lefebvre P et al.Effect of neurotrophic factor the inner ear clincal implications[J].Acta Otolaryngol(Stockh),1996;116(2)∶248
2,Brwn JN,Miller JM,Altschuler RA et al.Osmotic pump implant for chronic infusion of drugs into the inner ear[J].Hear Res,1993,70∶167
3,Lefebrre PP,Malgrange B, Staecker H et al.Retinoic acid stimulates regeneration of mammalian auditory hair cell[J].Science, 1993;260∶692
4,Lambert PR.Inner ear hair cell regeneration in a mammal :Identification of a rtifggering factor[J].Laryngscpe,1994;104∶701
5 十行宽.第16届世界耳鼻咽喉—头颈外科大会有关听力学及噪音医学内容简介[J].听力学及言语疾病杂志,1997;5(3)∶162
6,胡博华,Salvi RJ,Henderson D.应用微型渗透泵进行耳蜗慢性灌流的方法.中华耳鼻喉科杂志[J],1998;33(3)∶169
7,陈紫薇,李冬冬,史向党等.一种体内恒速持续给药的方法微量渗透泵.中国应用生理学杂志[J],1997;13∶278
8,翟所强,成晋川,王嘉陵等.成纤维细胞生长因子耳蜗内灌注防治爆震性聋的实验研究.中华耳鼻咽喉科杂志[J],1997;32(6)∶354
9,王锦玲,姜鸿彦,刘顺利等.表皮生长因子及地塞米松对爆震性聋治疗作用的实验研究.中华耳鼻咽喉科杂志[J].1996;31(3)∶136
(1999-10-20收稿 1999-12-12修回)
作者:李胜利 朱宏亮 申卫东 王林古
单位:(西安医科大学第二附属医院耳鼻咽喉科学教研室 西安 710004)
关键词:耳蜗;微量渗透泵;灌注;表皮生长因子;扫描电镜;听觉诱发电位
西安医科大学学报000218摘要 目的 应用微量渗透泵(Mini-Osmotic pump, MOP)给正常动物耳蜗和庆大霉素(GM))致聋豚鼠耳蜗长期恒速灌注人工外淋巴和表皮生长因子(Epidermal growth factor,EGF),观察其对听力和内耳组织形态的影响。方法 用Alzet model-2004型MOP向三组各10只的正常豚鼠A组和GM致聋豚鼠B组,耳 蜗底回鼓阶灌注人工外淋巴液,同法给GM致聋豚鼠耳蜗灌注EGF设为C组,在MOP埋植前和埋植后1、2、3和4周测定ABR反应阈值,用扫描电镜观察各组动物耳蜗Corti器的组织形态改变。结果 MOP给正常动物灌注人工外淋巴对ABR和耳蜗内外毛细胞无明显影响,而给GM致聋组豚鼠耳蜗灌注EGF可促进受损内耳组织细胞修复,使ABR阈值改善。结论 应用MOP可向耳蜗长期恒速灌注人工外淋巴,对耳蜗功能和形态无明显影响;而长期恒速灌注EGF对GM耳中毒豚鼠的耳蜗毛细胞有修复治疗作用。可使ABR反应阈值下降。
中图分类号 R764.43+1 文献标识码 A 文章编号 0258-0659(2000)02-0137-04
Effect of chronic infusion of EGF into the cochlea by an mini-osmotic pump on the function and morpholog on guinea pigs
Li Shengli Zhu Hongliang Shen Weidong
(Department of Otolaryngology,Second Affiliated Hospital, Xi′an Medical University, Xi′an 710004,China)
ABSTRACT Objective To observe the effects of chroni infusion of drugs into the cochlea using mini-osmotic pump (MOP) on the function and morpholog in normal and defened guinea pigs by gentamycin(GM),infusion drugs were epidermal growth factor(EGF) and artifical perilymph (AP).Methods MOP stainless steel tube were surgically implanted into the basal turn of the experiment guinea pigs cochlea.EGF were infused into 10 of the experimental guinea pigs GMAP was into 10 normal and GM .After MOP implaned 1,2, 3 and 4 weeks, auditory brainatem response(ABR) threshold and cochlea morphology were examined.Results 10 normal guinea pig with AP infused cochlea,ABR threshold were kept in the normal level and no hair cell loss was found.In GM groups with EGF infusion cochleas,ABR thresholds showed vecovery.Conclusion This study suggests that long term and quickly EGF infusing into cochlea can recovery hearing function and repair the hair cell trauma.
KEY WORDS cochlea mini-osmotic pump infusion epidermal growth factor
耳蜗深隐于颅骨的颞骨之中 , 具有血-脑和血-迷路等多重屏障, 致使某些蛋白类生长因子和神经细胞营养药物难以充分到达内耳组织[1],给内耳疾病的治疗造成一定困难。人们正积极探索将药物直接灌流入内耳的技术[2],以有效治疗感音神经性耳聋,我们应用微量渗透泵(Mini-Osmotic pump, MOP)将人工外淋巴液和表皮生长因子(Epidermal growth factor,EGF),恒速持续灌注入庆大霉素(Gentamycin, GM)致聋豚鼠耳蜗,观察MOP埋植后动物ABR反应阈值的改变,以及对耳蜗Corti器组织形态的影响。以评价耳蜗直接给药的可行性。 1 材料与方法
1.1 动物 选用体重300~400g健康青年豚鼠30只,雌雄不拘,动物由西安医科大学实验动物中心提供。随机选取20只按80mg/(kd*d)肌注庆大霉素10~14d,动物ABR反应阈值升在90~105BSPL范围内,造成感音神经性耳聋动物模型后,再随机分B、C两组埋植MOP,C组MOP灌装EGF为治疗组,B组MOP灌装人工外淋巴液为治疗对照组。余10只A组MOP灌装人工外淋巴液的为正常对照组。
1.2 ABR反应阈值测定方法 对3组动物MOP埋植前后在体1、2、3和4周时进行ABR反应阈值测定。实验动物用硫喷妥钠按40mg/kg剂量腹腔注射麻醉,固定于自制动物固定架上,颅顶正中为记录电极,同侧乳突为参考电极,鼻尖为接地电极,用Dantec Neuromatic-2000c诱发电位仪测试。用短声极性交替刺激,扫描时间10ms,重复率11.1次/s,带通滤波,叠250~500次。以Ⅰ、Ⅲ、Ⅴ波出现的最低刺激强度为反应阈值。
1.3 耳蜗灌注液配方 生理性人工外淋巴液(按解放军总医院于宁等方法配制)NaCl 125mmol/L, KCl 3.5mmol/L, NaHCO3 25mmol/L,NGGL2 1.20mmol/L,NaH2PO4 0.75mmol/L,CaCl2 1.3mmol/L。葡萄糖5.0mmol/L,配好后调pH 为7.4,过滤消毒后分装待用。
EGF 1g/支系粉剂(Sigma, USA)用无菌人工外淋巴溶解为4ng/μl的溶液。
1.4 微量渗透泵 应用加拿大Alzet公司生产Model-2004型Mini-Osmotic pump (MOP)。泵速度(0.25±0.05)μl/h,使用有效期28d,施药量200μl。
MOP灌装药液方法详见说明。在无菌状态将贮药池垂直放置,用充液管将人工外淋巴和EGF溶液充装在MOP贮液池中,将导液管用相同溶液充满,随后将导液管缓慢地垂直插入贮药池内,可看到多余溶液由针尖溢出。将灌装好的MOP置于无菌生理盐水中过夜,以保证MOP在植入前能正常工作。
1.5 耳蜗埋植MOP手术方法 实验动物用硫喷妥钠按40mg/kg腹腔注射麻醉,利多卡因右侧耳后局麻,耳后背腹侧进路暴露听泡,用尖刀削破听泡骨壁,扩大骨孔,暴露出耳蜗底回,手术显微镜下,在耳蜗底回鼓阶处骨壁钻一小骨孔,作为灌注针入路,将MOP导液管细钢针尖由骨孔刺入鼓阶,深约0.2mm,当进入鼓阶后,用骨胶粘封骨孔固定针头。听泡骨孔用调和好的自凝牙托粉粘堵,钢管出听泡向后背打90~120°弯角,以使导液塑料避免打折,保证MOP灌流畅通。手术完成后再沿切口向耳背部皮下钝性分离,造成一纵贯条形囊袋,将MOP泵体埋植其中,疏通导液管畅流入耳蜗后缝合切口并包扎,随后每天给手术动物肌注20万单位青霉素抗感染。各组动物灌注药物及分组见表1。
表1 各组动物MOP灌注数目及埋植期
组 别
耳蜗灌药
分 类
动物数
(只)
MOP基值
年数(年)
灌注时
期(d)
A组正常动物
人工外淋巴
10
10
28
B组GM致聋动物
人工外淋巴
10
10
28
C组GM致聋动物
EGF
10
10
29
1.6 耳蜗Corti器组织形态观察 在MOP埋植28d后,测定ABR反应阈值后动物断头,取出MOP泵体,从听泡外剪断导液管,分离颞骨取出听泡,暴露出耳蜗,在手术显微镜下观察导液管钢针在耳蜗底回固定及与周围组织结构的关系,将园窗和卵园窗开放,在蜗顶挑一小孔,用2.5% PBS戊二醛固定液固定耳蜗10h,PSB冲洗后入1%锇酸后固定,梯度乙醇脱水,临界干燥,喷金后Kyky 2000型扫描电镜下观察手术侧Corti器组织形态。
2 结 果
2.1 MOP埋植后各组动物ABR反应阈值变化
正常动物右侧耳埋植充装人工外淋巴MOP后1到4周的ABR反应阈值无明显改变,基本在正常的听阈范围内;GM致聋豚鼠在MOP埋植前ABR阈值在93~105dB之间,埋植后充装人工外淋巴液组ABR逐渐升高,而充装EGF动物组灌注3~4周ABR阈值有一定下降,与人工外淋巴组相比有显著性差异。说明EGF可帮助恢复GM损害的耳蜗功能。结果见表2。
2.2 MOP埋植后中耳和内耳组织形态改变
MOP埋植后正常组和GM组灌流人工外淋巴液动物各有1只中耳感染,有粘脓性分泌物充满听泡,听泡骨壁增厚,耳蜗骨壳有骨质侵蚀和钙质沉着;GM组灌注EGF的10只动物中2只动物中耳有轻度感染,可见中耳粘膜充血水肿,其余动物均见耳蜗底回灌流孔周围有上皮增生并覆盖于蜗壳骨壁上,其上有蔓生的血管明显分布。另一只动物可见听泡骨孔处长出的表皮攀附在导液管上,并已形成一皮管桥接在耳蜗底回上,可能系EGF由接口浸出促进组织增生所致。其余动物未见明显病理改变。表2 各组动物MOP埋植前后ABR反应阈值(
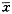 ±s
±s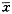 ,dB) 组 别
,dB) 组 别MOP
灌药组别
MOP
埋植前
MOP埋植后
1周
2周
3周
4周
A组正常动物
人工外淋巴
43.6±2.4
44.5±3.6
44.8±2.9
43.8±2.5
43.8±1.8
B组GM致聋组
人工外淋巴
94.3±5.4
86.7±9.8
87.2±8.3
95.4±6.2
99.2±5.7
C组GM致聋组
EGF
93.6±6.8
94.7±8.4
91.5±5.9
90.4±10.2
88.8±8.4
B、C组与A组比较*P<0.01

图1 应用MOP向正常豚鼠耳蜗灌注人工外淋巴液4周后,Corti器无内外毛细胞损害消失

图2 GM致聋豚鼠耳蜗第三回内外毛细胞严重损害消失。用MOP向耳蜗灌注EGF未见毛细胞修复及再生出现

图3 GM致聋后EGF灌流4周后
正常动物MOP埋植向耳蜗灌液人工外淋巴4周后,SEM观察未见明显的内外毛细胞损害消失,无静纤毛束散乱,倒伏及消失现象,Corti器组织形态基本正常(图1)。GM致聋后豚鼠耳蜗底回到第三回内外毛细胞严重损害消失(图2)。可 见有广泛的Corti器消失和萎缩,外毛细胞静纤毛束消失,表皮板消失后邻近指状突充添其位,其上有微绒毛丛生(图3)。MOP埋植灌流人工外淋巴液可见病理变化同GM致聋所见。而MOP埋植灌流EGF组动物可见底回的内外毛细胞损害程度减轻,内外毛细胞消失数目减少。萎缩Corti器组织很少见到,说明EGF对Corti器有治疗作用。
3 讨 论
内耳由于具有血-脑和血-迷路双重屏障作用,可能使某些蛋白类生长因子和神经营养药物难以充分到达内耳[1],故给许多内耳疾病治疗带来极大的困难。近几年许多研究证明,体外培养的耳蜗Corti器用生长因子类药物可以促进毛细胞再生和修复[3,4],给耳聋治疗带来了极大的希望,但在体研究至今尚未取得突破。目前国内外耳科学者在耳蜗给药途径上进行积极探索,已在进行转基因给药、中耳载体渗透给药和耳蜗直接给药诸方法的研究[5]。Brown JN等1993年开始应用微型渗透泵耳蜗灌流给药[2]。胡博华等1998年用微型渗透泵进行耳蜗灌流Hank液认为不会对耳蜗产生明显影响[6]。本实验表明MOP埋植向耳蜗灌流人工外淋巴对内耳组织形态无明显影响,与上述研究结论相同。但在长期向GM致聋豚鼠耳蜗灌流EGF后,能促进受损的Corti器修复。ABR测定EGF灌流组的听阈值亦有一定的恢复(表2)。所以应用MOP向耳蜗直接给药能对GM致感音神经性耳聋起到一定的治疗作用。但应在技术方法进行完善后,方可应用于人类。
微渗透泵是一种崭新的持续长久给药的方法,泵体由3个同心层—贮药池、渗透性套筒及控制渗透泵药物释放速度的半透膜外层构成。其原理为组织渗出液由半透膜进入渗透性套筒内,其内置有高浓度的NaCl结晶的驱动物质,该物质膨胀压迫贮药池囊壁,使囊内药液沿内导液管流入灌注部位。优点是局部给药浓度高,避免全身副作用,另外对价值昂贵的珍稀药品用量少,而靶效应高。我们应用的是加拿大Alzet公司的2004型微量渗透泵,可持续内耳给药28d。避免了血脑和血迷路等多重屏障,从本实验看MOP泵的导管接口要严密,消毒要充分, 一般未发现组织排异。以往国外有关报道证实MOP可直接植入不同动物皮下腹腔,再通过导管支达膀胱、胃肠、子宫、静脉、动脉等空脏器,或局部组织(脑室、脑内局部核团、外周神经等)[7]。MOP在内耳的应用才起步,有必要进行深入研究。
许多研究证明生长因子类物质可促进内耳受损的神经和细胞修复再生[3,4],但有关哺乳动物的在体试验尚未获得成功。国内翟所强等直接给耳蜗打孔灌入αFGF和βFGF显示对爆震性聋豚鼠CAP反应阈恢复有促进作用,在耳蜗声损伤过程中有保护和修复功能[8]。王锦玲等也同样发现EGF对爆震性聋豚鼠耳蜗毛细胞损伤修复可能有关[9]。Kopke根据近几年的研究对神经营养因子对内耳的作用进行临床推断显示诱人的前景[1]。本研究初步证明耳蜗直接灌注EGF对庆大霉素致聋豚鼠的受损耳蜗Corti器有一定的帮助恢复作用,能提高听力功能。但尚需探讨更有特效的内耳灌注治疗药物,以推广应用于人类感音神经性耳聋的防治。此项研究具有一定的应用前景。
国家自然科学基金(39400145)和卫生部科学研究基金项目(320,4100-024)
参考文献
1,Kopke R,Staecker H,Lefebvre P et al.Effect of neurotrophic factor the inner ear clincal implications[J].Acta Otolaryngol(Stockh),1996;116(2)∶248
2,Brwn JN,Miller JM,Altschuler RA et al.Osmotic pump implant for chronic infusion of drugs into the inner ear[J].Hear Res,1993,70∶167
3,Lefebrre PP,Malgrange B, Staecker H et al.Retinoic acid stimulates regeneration of mammalian auditory hair cell[J].Science, 1993;260∶692
4,Lambert PR.Inner ear hair cell regeneration in a mammal :Identification of a rtifggering factor[J].Laryngscpe,1994;104∶701
5 十行宽.第16届世界耳鼻咽喉—头颈外科大会有关听力学及噪音医学内容简介[J].听力学及言语疾病杂志,1997;5(3)∶162
6,胡博华,Salvi RJ,Henderson D.应用微型渗透泵进行耳蜗慢性灌流的方法.中华耳鼻喉科杂志[J],1998;33(3)∶169
7,陈紫薇,李冬冬,史向党等.一种体内恒速持续给药的方法微量渗透泵.中国应用生理学杂志[J],1997;13∶278
8,翟所强,成晋川,王嘉陵等.成纤维细胞生长因子耳蜗内灌注防治爆震性聋的实验研究.中华耳鼻咽喉科杂志[J],1997;32(6)∶354
9,王锦玲,姜鸿彦,刘顺利等.表皮生长因子及地塞米松对爆震性聋治疗作用的实验研究.中华耳鼻咽喉科杂志[J].1996;31(3)∶136
(1999-10-20收稿 1999-12-12修回)
您现在查看是摘要介绍页,详见PDF附件(206kb)。