络病与心脑血管疾病相关性及治疗研究进展 通心络对大鼠脑缺血再灌注损伤后神经干细胞增殖分化的影响(三)
 |
(续7月6日第17版)
讨 论
越来越多的证据表明,神经再生出现在成年脑内不连续的区域,主要包括海马齿状回(DG)、侧脑室室管膜及室管膜下区(SVZ)两个主要聚集区域。SVZ区新生的神经元可通过嘴侧迁徙流(RMS)移至嗅球和皮层。DG新生的神经元可移至海马颗粒层。这些区域神经干细胞(NSC)的再生可由一些生理性因素调节,如肾上腺皮质激素[2]、性激素[3]、生长因子[4]、兴奋性神经传递[5]、学习[6]、应激[7]等所调节。一些病理因素如海马齿状回的机械性损伤[8]、癫痫发作[9]、缺血缺氧等因素均可诱导上述区域的神经再生。
本实验以BrdU标记神经再生,β-Tubulin标记成熟神经元,GFAP标记成熟胶质细胞,观察局灶性脑缺血再灌注损伤后增生的神经干细胞分化为哪类细胞及通心络的影响。既往研究表明,局灶性成年大鼠脑缺血损伤后脑内均有明显的神经再生现象。BrdU是胸腺嘧啶脱氧核苷类似物,可掺入DNA复制的S期,被用于细胞增殖的标记物[10]。Kulin Jin J[11]等以成年大鼠MCA模型缺血90 min,分别再灌注第1、2、3周后,发现各时间段双侧半球DG的颗粒下层和SVZ均有BrdU阳性细胞表达,但以缺血侧的DG颗粒下层表达最为显著;在双侧DG区再灌注第1周、SVZ区再灌注第2周BrdU阳性细胞数最多,仍以缺血侧为多,随时间延长,至第3周BrdU阳性细胞数渐减少。BrdU标记细胞同时还表达了未成熟神经元标志物(double cortin)和增殖细胞核抗原(PCNA),但没有表达更为成熟神经元标志物NeuN和HU蛋白,提示BrdU阳性细胞是新生的神经元。从治疗角度来讲,如何诱导脑缺血损伤后内源性神经干细胞的增殖和分化,亦是研究的重点。
, http://www.100md.com
体内外研究证实,表皮生长因子(EGF)、成纤维细胞生长因子(bFGF)、胞外基质的成份神经细胞粘附分子、神经营养因子(如睫状神经营养因子)、白血病生长因子、甲状腺素T3、骨形成蛋白、血小板源性生长因子、胰岛素样生长因子Ⅰ、脑源性生长因子等对NSC的增殖分化均有作用。
中医药促进脑缺血后神经功能的恢复作用,是否与其诱导脑缺血后NSC的增殖分化有关?这为我们阐明中药促进脑缺血损伤后脑功能重建和再生的机制,开发具有诱导脑缺血后内源性NSC的增殖分化的中药提出了新的问题与研究思路。
国内高唱[15]等观察了益气活血中药复方HD02对慢性前脑缺血大鼠神经干细胞增殖分化的影响。结扎双侧颈总动脉制备慢性前脑缺血大鼠模型,采用免疫单标和免疫荧光双标法,以BrdU标记干细胞的增殖,神经丝蛋白-200(NF200)、NeuroD、GFAP分别标记成熟神经元、幼稚神经元和星形胶质细胞,给予模型大鼠HD02水煎剂灌胃,分别于给药后第15、30天观察上述指标的表达。结果显示,造模后第30天,HD02 组BrdU阳性细胞数和BrdU+NF200、 BrdU+NeuroD、BrdU+GFAP免疫荧光双标细胞数较慢性前脑缺血组明显增多(P<0.01)。从而证明,中药HD02可显著增加慢性前脑缺血大鼠神经干细胞的增殖分化。
, 百拇医药
我们应用通心络干预大鼠局灶性脑缺血后神经干细胞增殖分化的实验研究证实了前人的研究结果。表明通心络对脑缺血再灌注损伤后NSC的增殖分化有显著的促进作用,而且该作用与用药时间有关,即给药第7天后促进NSC增殖分化的作用才开始出现,并可持续到第21天,这提示我们中药的治疗作用是缓慢、长期的。为进一步研究通心络对脑缺血再灌注损伤后NSC的增殖分化奠定了基础。
从中医药学角度讲,我们认为脑缺血后产生的痰瘀热毒、害络损髓是抑制NSC增殖分化的关键性病理因素,而解毒通络是治疗大法。通心络具有益气化瘀、解毒通络、搜风解痉之功效,从而祛除了抑制NSC增殖分化的病理因素,促进脑缺血后NSC的增殖和分化。
结合现代医学有关神经干细胞增殖分化的研究成果,我们推测,通心络是以虫类药为主的中药复方制剂,含有人参总皂甙、芍药甙、龙脑及多种蛋白质、维生素、微量元素等60余种成分。给药后可能其中某些成分或各组分相互作用后产生的新代谢产物直接通过血脑屏障,通过调节脑内影响NSC增殖分化的生长因子、神经营养因子及Notch和bHLH家族蛋白等的变化,诱导内源性NSC的增殖分化。但到底是一种或几种有效成分单独或协同作用的结果及哪类因子表达、信号通路产生了变化,都需要进一步深入研究。
, http://www.100md.com
本研究只证实了通心络对脑缺血后内源性NSC增殖分化的作用,有关机制在本人承担的国家自然科学基金项目研究中,将从体内、体外两方面进行全面深入的研究。
参考文献:
[1] 吴以岭主编 络病学,北京. 中国科学技术出版社. 2004年10月第1版, 10454-1072.
[2] Cameron HA, Tanapat P, Gould E. Adrenal hormones suppress cell division in the adult rat dentate gyrus . J. Neurosci, 1992, 12: 3642-3650.
[3] Patima Tanapat, Nicholas B. Hastings, Alison J. Reeves, and Elizabeth Gould.Estrogen Stimulates a Transient Increase in the Number of New Neurons in the Dentate Gyrus of the Adult Female Rat J. Neurosci, 1999, 19: 5792-5801
, 百拇医药
[4] Barry Kirschenbaum, Fiona Doetsch, Carlos Lois, and Arturo Alvarez-Buylla.Adult Subventricular Zone Neuronal Precursors Continue to Proliferate and Migrate in the Absence of the Olfactory Bulb J. Neurosci, 1999, 19: 2171-2180.
[5] Cameron HA, Tanapat P, Gould E. Adrenal steroids and N-methyl-D-aspartate receptor activation regulate neurogenesis in the dentate gyrus of adult rats through a common pathway. Neuroscience, 1998, 82(2): 349-354.
, http://www.100md.com
[6] Leuner,B Mendolia-Loffredo,S , Kozorovitskiy, Y, etal. Learning Enhances the Survival of New Neurons beyond the Time when the Hippocampus Is Required for Memory J. Neurosci, 2004, 24: 7477-7481.
[7] 19. Gould, E. Tanapat, P. E. Neurogenesis in the dentate gyrus of the adult tree shrew is regulated by psychosocial stress and NMDA receptor activation. (J) Biol. Psychiatry, 1999,46: 1472-1479.
[8] Gould E, Tanapat P. Lesion-induced proliferation of neuronal progenitors in the dentate gyrus of the adult rat. Neuroscience, 1997, 80(2): 427-436
, http://www.100md.com
[9] Parent JM, Yu TW, Leibowitz RT, et al. Dentate granule cell neurogenesis is increased by seizures and contributes to aberrant network reorganization in the adult rat hippocampus. J Neurosci, 1997, 17(10): 3727-3738.
[10] Gould E, Gross CG. Neurogenesis in adult mammalas: some progress and problems. J Neurosci, 2002, 22(3):619-23
[11] Kulin Jin, Mandabu Minami, Jing Q, et al. Neurogenesis in dentate subgrandular zone and rostral subventricular zone after focal cerebral ischemia in the rat. Proc Natl Acad Sci USA, 2001, 98(8): 4710-4715.
, http://www.100md.com
[12] R,L,Zhang, Z,G,Zhang, L,Zhang,et al. Proliferation and differentiation of progenitor cells in the cortex and the subventricular zone in the adult rat after focal cerebral ischemia. J Neurosci, 2001, 105(1):33-41.
[13] 高唱,吴伟康,王景周,等.HD02对慢性前脑缺血大鼠神经干细胞增殖分化的影响.中国临床康复, 2003, 7(28):3796-3797.
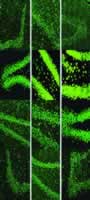
图4 缺血再灌注对照组与通心络治疗组DG BrdU免疫组化荧光标记图片(10×40)
A、B、C、D分别为缺血再灌后第3、7、14、21天的DG BrdU荧光标记图片。control为对照组,TX为通心络小剂量组,TD为通心络大剂量组。(图4所涉及内容见7月6日第17版), 百拇医药