“中国籍”单抗新药集体上阵
 |
 |
日前,美国财政部外国资产管理办公室(OFAC)宣布,批准尼妥珠单抗(Nimotuzumab,h-R3)进口美国,以用于儿童脑桥胶质瘤临床试验。
尼妥珠单抗是由古巴分子免疫学中心(CIM)研发的世界上第一个用于治疗EGFR过度表达的晚期肿瘤的人源化单抗药物。由于众所周知的政治原因,古巴的这一研发成果欲进入美国市场其难度可想而知。因此,外界把这一重大进展看作是以单克隆抗体药物为代表的分子靶向治疗手段攻克癌症的胜利。
单克隆抗体(MAB)是近年来复合年增长率最大的一蛋白类药物,主要用于癌症和自身免疫性疾病,以及抗感染、心血管疾病、器官移植排斥反应等。据了解,全球抗体药物市场销售额在2002年时接近40亿美元,2004年已达到105亿美元,增幅非常大,预计到2010年全球市场将达到300多亿美元的规模。
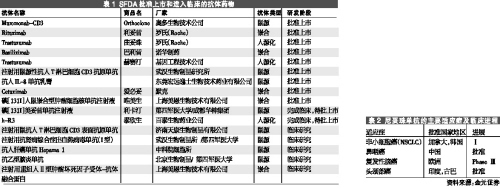
经过20多年的发展,我国的抗体药物市场也已经起步,并实现了从基础研究到产业化的跨越。迄今,SFDA共批准了11个单抗药物上市。在国内形成了北京、上海、西安三大研发及产业化基地。
, http://www.100md.com
2007年,中国具有自主知识产权的3个一类单抗新药或将陆续上市,他们的“出线”无疑预示着中国抗体药物市场竞争版图的重新划分。
三个一类新药
欧美一直是世界单抗药物的研发中心和最大的市场。到目前为止,美国FDA共批准了24个抗体药物上市,预计今后几年将在世界7个主要市场惊人增长。
国内已上市的抗体药物市场也以进口产品为最。如2001年罗氏公司上市的利妥昔单抗(美罗华)和PDL生物制药公司上市的抗Tac单抗、2002年奥多生物技术公司上市的鼠抗人T淋巴细胞CD3单抗、2003年罗氏公司上市的曲妥珠单抗和诺华制药的巴利昔单抗。据统计,利妥昔单抗和抗Tac单抗上市后,销售额一直在大幅增长,曲妥珠单抗和巴利昔单抗在上市第一年的增长速度缓慢,但到第二年开始就迅速增长。从季度变化来看,各产品2005年前三季度的销售额均呈上扬趋势。
, 百拇医药
“相信再过一两个月,我们的产品也可以上市了。”白先宏是北京百泰生物药业公司的董事长。他的公司以研发和生产治疗恶性肿瘤的人源化单克隆抗体和疫苗为主要方向。2005年4月,百泰生物与古巴合作开发的单抗药物h-R3(商品名“泰欣生”)获得SFDA颁发的生物一类新药证书。
这是我国获得批准的第一个人源化抗体药物,是继美国基因泰克公司研发的曲妥珠单抗(赫赛汀)之后又一个面世的单抗实体瘤治疗药物。可用于头颈部、食管、肺部、乳腺和结直肠等部位的上皮源性肿瘤的治疗,目前在中国主要用于治疗鼻咽癌,疗程费用约在8万~9万元人民币。
金元证券医药分析师李朝认为:“h-R3与美国免疫克隆公司(ImClone)的西妥昔单抗Erbitux(爱必妥)类似,都是针对HER1的单抗。但人源化程度高于Erbitux,市场前景毋庸置疑。Erbitux2005年销售额为6.73亿美元,预计2007年的销售额将突破10亿美元大关。”
, 百拇医药
与此同时,上海美恩生物技术公司开发的碘[131I]人鼠嵌合型肿瘤细胞核单抗注射液将于本月上市。该药是继Zevalin和Bexxar之后全球第3个放射免疫药物,其主要作用于变性坏死肿瘤细胞的核蛋白,该靶点存在于所有肿瘤细胞中,不受肿瘤生长部位和病理类型的限制,为晚期肺癌患者提供了新的分子靶向治疗选择,其疗程费用在5万~6万元之间,目前还在进行神经胶质瘤的临床研究。
另外,由华神集团与第四军医大学共同开发的碘[131I]美妥昔单抗注射液有望于近期上市。据了解,美妥昔单抗是全球第一个专用于治疗原发性肝癌的单抗导向同位素药物,临床试验表明,该药两周期临床有效率为27%,临床控制率为86%;中晚期肝癌患者两年生存率为42%,32个月生存率为31%。目前价格尚不明确,但据称“和治疗其他癌症的进口药物相比,便宜一些”。
技术差距明显
据悉,全球目前有超过200家公司正在研发治疗用单抗药物,约有335个产品正在研发中,其中100多个已进入临床研究。我国除上述已经成熟的单抗药物外,亦由十几个品种在研,并形成了北京(以北京百泰生物技术公司和北京天广实生物技术有限公司等为主体)、上海(以上海中信国健药业有限公司等为主体)、西安(由第四军医大学和成都华神集团合作形成)等抗体药物的中试及产业化基地。
, 百拇医药
“但目前,国内抗体药物市场尚未形成,年销售额只有几千万元。‘十一五’期间,我们的首要任务是形成抗体及抗体药物产业,预计到2010年,中国抗体药物市场将达到50亿元人民币的销售额,这也是我们的基本目标。”第四军医大学细胞工程中心主任陈志南教授在描述我国抗体药物的发展前景的同时夹杂着些许隐忧。
李朝告诉记者,尽管抗体药物的发展如火如荼,但我国抗体药物的研发却举步维艰:现有产品开发项目多数原始性创新不够,且大多数抗体仍是以鼠源性为主;很多项目处于实验室阶段,距离产业化还有相当大的距离。而“大规模生产一直是中国抗体药物发展的瓶颈”。
白先宏分析原因时说,我国基因重组治疗性抗体上游构建技术严重落后,而且大量生产抗体的动物细胞大规模培养技术仍处于实验室制备技术的层面。
以动物细胞大规模培养技术为例,尽管EPO和乙肝疫苗的使用剂量只有微克级水平,但是我国批准上市的、仅有的以CHO细胞表达的这两种产品的生产还处于非常原始和初级的状态,许多厂家甚至还是用转瓶培养生产,可以说虽有20多家EPO生产商,但无一家年生产能力达到20~30g/年这种实验室规模的产量,就更不用提剂量在克级/人的抗体类药物了,这在中国几乎是不可能生产的。下游技术的落后直接制约着抗体药物产业化的进程乃至整个生物制药产业的发展。
, 百拇医药
中国还未解决产业化难题时,国外抗体的生产技术则已日臻成熟。除传统的“嵌合体法”和“人源化法”两大技术外,美国公司已开发出利用转基因动物与转基因植物生产人用单克隆抗体的新技术,这将大大拓展了抗体产品的来源,并为产品的降价奠定基础。
“抗体药物开发应受到进一步重视,应加快步伐。如人源化技术、上游工程抗体重构、以及大规模表达等一些瓶颈技术必须打破,才能实现产业的快速发展。” 白先宏说。
链接
单抗档案
单克隆抗体药物具有特异的靶向性,具有副作用小、疗效好的特点,主要用来治疗肿瘤、哮喘、牛皮癣、类风湿性关节炎、红斑狼疮、急性心梗、脓毒症、多发性硬化症及其他自身免疫性疾病以及器官移植排斥反应的逆转。
单克隆抗体药物的技术开发经历了鼠源单克隆抗体、人-鼠嵌合抗体、人源化抗体、全人源化抗体。有3种治疗性的单克隆抗体已经在美国上市。鼠源性单克隆抗体由于副反应大、代谢快,已经逐渐退出市场。不过,由于这一特点,目前放射性元素标记的单克隆抗体药物主要使用鼠源性单克隆抗体。近年来国际上开发的单克隆抗体主要是人源化的单克隆抗体,人源化及全人源化单克隆抗体由于副反应小,在体内停留时间长,更有利于治疗。
●1986年,由Ortho开发、用于治疗器官移植出现的排斥反应的世界上首个单克隆药物——抗CD3单抗OKT3在美国上市;
●1994年,第一个嵌合抗体ReoPro上市;
●1997年,由Genentech开发的Rituxan(美罗华)上市,成为了第一个重磅炸弹的单克隆药物;
●2002年,第一个全人源化单克隆抗体Humira(赫赛汀)上市。
●2004年乃至未来几年内最重要的单克隆抗体药物Avastin(阿瓦斯丁)上市。(李朝), 百拇医药(赖强)