三磷酸腺苷的抗癌作用
作者:王钦南 江虎军
单位:100083北京 国家自然科学基金委员会生命科学部
关键词:
中华医学杂志930720 最近我国学者首先发现,外源性ATP对数种癌细胞增殖有抑制作用,有一定浓度范围内对癌细胞的生长抑制,在此同时恶性表型向正常分化,细胞内cAMP水平升高。还证明ATP的抑癌作用依赖于细胞表面受体P2y的活化。上述提示ATP可能通过次级信使cAMP系统和P2y活化IP3/Ca2+双信使途径调节癌细胞的增殖与分化。它可望成为有前景的抑癌剂。
ATP抑制癌细胞增殖
吕桂芝等〔1〕用ATP(最终浓度0.32mg/ml)处理人胃腺癌SGC-7901细胞,则其增殖受抑制,4天后抑制率达80%以上。方伟岗〔2〕发现ATP及其类似物对人肺巨细胞癌PG细胞明显抑制,以100μmol/L ATP(≈0.055mg/ml)处理后第7天PG细胞生长被抑制56.6%,当浓度为lmmol/L时(0.55mg/ml),则生长被抑制90%以上。这种抑制现象在用ATP处理前列腺癌细胞的实验中得到证实〔3〕。同样,浓度0.16~0.23mg/ml的ATP对人胃腺癌MGC-803细胞也明显抑制,处理后第1天对细胞生长的抑制率为13%,第2天为43%,第4天则达80%以上〔4,5〕。其作用程度均受时间和剂量变化的影响。此外,在上述剂量范围内ATP对小鼠艾氏腹水癌和实体瘤的抑制率分别为70%和50%。
, http://www.100md.com
ATP促使癌细胞恶性表型向正常分化
实验资料表明〔1,2,4,5〕,ATP的浓度在100μmol/L~lmmol/L(0.055~0.55mg/ml)范围内,使其受处理的癌细胞恶性表型向正常分化的标志得以明显改善。
1.对癌细胞微绒毛的影响:癌细胞表面密布微绒毛和伪足。微绒毛与细胞增殖呈正相关〔6〕。当癌细胞经ATP连续处理则微绒毛缩短,数目减少以至消失,细胞表面变得平滑,附着力增加〔1〕。
2.对细胞核仁类型的影响:正常分化的细胞核仁呈环状,恶化细胞致密或呈网状,有较淡的染色纤维中心。许多因素都可使核仁类型发生变化〔5〕。Wachtler等以植物凝集素(PHA)处理外周血淋巴细胞则核仁由环状向网状或致密型过渡,表明核仁与细胞代谢和增殖启动有关。以丁酸钠诱导人胃癌细胞分化发现核仁由网状向环状过渡。ATP抑制细胞增殖的同时核仁银染蛋白量减少,银染颗粒的数目和面积锐减〔1,7〕。若连续处理,则核仁逐渐规则化,出现纤维和颗粒状组成的中心和环状表型。嗜银染色强弱可代表核仁rRNA基因转录活性的高低,用药后核仁银染蛋白量和面积减少暗示细胞增殖抑制是由于rDNA转录活性抑制的结果〔5〕。
, 百拇医药
3.对癌细胞粘连蛋白纤维(fibronectin,FN)的影响FN是分布在细胞表面的粘着性糖蛋白,是胞外基质的重要成分,与细胞附着和增殖分化的信息传导有关,并调控细胞运动和微丝束组装。免疫荧光技术证实人和鸡胚细胞有FN,主要分布在粗面内质网和高尔基体上,G1期出现,M期消失〔8〕。恶性转化细胞含FN的量下降甚至消失,细胞变圆,附着力下降〔9〕。也有转化的乳腺细胞、膀胱细胞的FN并不减少的报道〔10,11〕。人胃癌细胞质内和细胞膜外表面FN呈弱阳性,经丁酸钠转化和ATP抑制增殖的癌细胞都导致细胞质和细胞膜表面的FN免疫荧光的强度显著增加〔1〕。表明FN增加与癌细胞增殖抑制和趋向分化有关。
4.对细胞骨架系统的影响:
(1)对微管的影响:正常间期细胞有完整的微管网架。癌细胞的微管减少、组装不良〔12〕。双丁酰3’,5’cAMP和cAMP使癌细胞逆转,微管组装改善〔13〕,表明微管变化与癌细胞逆转密切相关。若把外源微管蛋白加入到抽去微管蛋白的细胞内,正常细胞重组微管比以SV40病毒转化的细胞组装微管的量增加2~3倍〔14〕。Moitchison发现ATP可使着丝点延伸。受ATP抑制的胃癌细胞其微管系统从中央向边缘延伸,细胞质铺展〔4〕,说明ATP使微管系统组装改善与细胞形态正常分化有紧密关系。
, http://www.100md.com
(2)对微丝的影响:癌细胞的微丝束不发达,微丝染色呈斑点状,分布在细胞质外围〔15〕,转化的成纤维细胞微丝束减少,变细,膜-微丝复合物下降,细胞呈圆形,伸展性差。经肿瘤病毒转化细胞的微丝束和粘着斑的数目减少〔16〕。小儿包皮成纤维细胞的微丝束和FN都经肿瘤细胞多〔17〕。ATP处理人胃癌细胞则细胞质周边肌动蛋白的荧光斑消失,微丝束加粗、增长,纵横交织布满细胞质内,组装明显改善〔4〕。Bershadky证实,当细胞内ATP含量降至临界水平以下时微丝系统解聚,也表明ATP在维持微丝系统的形态和结构中所起的作用。
ATP抑制细胞增殖有关的信号传导
ATP抑制环腺苷酸磷酸二酯酶(cAMP-PDEase),阻止cAMP降解,维持细胞内cAMP水平。cAMP是细胞膜上朱苷酸环化酶水解ATP的产物,是细胞内重要的第二信使,活化cAMP依赖性蛋白激酶,并借助细胞内Na+、Ca2+浓度调控细胞增殖、分化和恶性表型逆转等〔6〕。Mulle证明cAMP通过磷蛋白抑制减数分裂。cAMP促使核蛋白磷酸化,影响基因转录的速度〔18〕。有资料证明cAMP对哺乳动物肿瘤的抑制伴随V-rasH基因的表达被阻断〔19〕。上述结果说明cAMP在分子水平上对细胞增殖的负调作用。王代树等以cAMP处理艾氏腹水癌发现癌基因c-myc、c-fos、c-sis、c-H-ras、P53表达改变,膜蛋白分子侧向运动变化,表明了cAMP运转膜蛋白分子扩散以及癌基因表达程度和癌细胞去恶化或再恶化有紧密关系。应指出的是:细胞表型变化晚于基因表达的改变。Shen等〔20〕证实基因表达改变后,细胞再经过几个周期才出现增殖的变化。
, 百拇医药
吕桂芝等〔21〕证明在癌细胞膜上依赖Na+、K+ATP酶的活性受抑制时,ATP积累,cAMP-PDEase活性降低。ATP转化3T3细胞则改变细胞膜的透性和K+/Na+的比率,影响细胞内蛋白质合成。ATP处理胃癌细胞则降低膜表面的cAMP-PEDase活性,提高胞内cAMP的含量〔22〕。这一结果被认为是ATP对细胞增殖、分化调控的重要机理,而细胞内Na+、K+比率的改变是细胞增殖〔23〕和分化〔24〕的重要原因。
ATP对肿瘤细胞生长抑制具有受体特异性,主要为P2y亚型所识别〔2,25〕。ATP与P2嘌呤受体结合激活磷酯酶C(PLC)使膜上肌醇磷脂(PIP2)降解产生二乙酰基甘油(DG)和三磷酸肌醇(IP3),也可通过另一种途径生成花生四烯酸。IP3与细胞内钙库的特异受体结合介导释放内源性Ca2+,调节细胞内游离钙〔Ca2+〕i的变化。实验证明IP3是释放细胞内源性〔Ca2+〕i的促进因素,因此可以认为TPA通过激活磷酯酰肌醇/钙离子信号传导途径对癌细胞增殖施加影响。一般情况下受体介导细胞内〔Ca2+〕i是刺激细胞分裂的信号。然而当细胞内〔Ca2+〕i调控机制遭受破坏,Ca2+浓度继续升高将导致:(1)细胞骨架结构改变丧失固有功能〔2,6〕;(2)激活磷酸酯酶,催化膜磷酯降解,产生炎症因子〔27〕;(3)激活蛋白酶,降解细胞内蛋白质,如骨架蛋白、膜蛋白(Chien R.R.1979);(4)激活内切酶,切断DNA链,解聚核小体〔28〕。所以细胞内钙离子代谢的失调和紊乱可能是抑制细胞增殖的重要原因。
, http://www.100md.com
总之,ATP抑制癌细胞增殖及其恶性表型逆转是极其复杂的生化过程。可从原癌基因突变及过度表达产生有转化活性的癌基因蛋白最终导致肿瘤〔29〕。从抗癌基因突变和缺乏多步骤变化引起癌变的事实〔30〕可归结出:基因突变是癌变的起因。
研究表明,许多癌基因产物是细胞内信号传导途径的重要的组成部分。例如V-sis基因产物与PDGF的β链相同,int-2基因编码蛋白质与FGF相同。Steeg发现癌转移抑制基因nM23的产物是一种三磷酸核苷激酶,它可将二磷酸核苷转换成三磷酸核苷,参与细胞内信号传导。而对ATP抑制癌细胞增殖及伴随的恶性逆转,我们应进一步查明:膜受体将ATP刺激信号经细胞内第二信使传入细胞核内的途径?ATP引起哪些特定基因的启动和表达合成相应蛋白质调节细胞的代谢活动。
参考文献
1 吕桂芝,高 燕,黄衍川,等。外源性三磷酸腺苷对人胃腺癌SGC-7901细胞的生物学效应。解剖学报,1988,19:278.
, http://www.100md.com
2 方伟岗。转移性人肺巨细胞癌生长调节中的信号传导研究。1991,北京医科大学学位研究生(博士)论文。
3 Fang WG,Pirnia ,F,Bang Y,et al.P2-purinergic receptor agonists inhibit growth of androgen-indepen-dent prostate carcinoma cells.J Clin Invest Inc.1992,89:191.
4 吕桂芝,林仲翔,周立新,等。外源性三磷酸腺苷对人胃腺癌MGC-803细胞增殖和细胞骨架的影响。解剖学报,1990,21:274.
5 吕桂芝,高 燕,孟松娘,等。外源性ATP调控细胞的增殖和分化与cAMP-PDE酶、(Na+/K+)-ATP酶活性及核仁类型改变的相互关系的研究。解剖学报,1992,23:246.
, 百拇医药
6 Gina BK.Microvilli:a major difference between normal and cancer cell?Science,1975,188:819.
7 吕桂芝,高 燕,周立新,等。丁酸钠对人胃腺癌MGC-803细胞核仁纤维中心和银染蛋白的影响。实验生物学报,1991,24:317.
8 Hedman K.Intercellular localization of fibronectin using immunoperoxidase cytochemistry in light and elec-tron microscop.J Histochem Cytochem,1980,28:1233.
9 Hynes RO.Cell surface proteins and malignant transfor-mation.Biochem Biophys Acta,1976,458:73.
, 百拇医药
10 Taylor-paradimitrion J,Joy B,Jackie H.Production of fibronectin by normal and malignant human mamary epithelial cells.Cancer Res,1981,41:2491.
11 Wigley C B,Summerhayes IC.Loss of LETS protein is not a marder for salirary gland or bladder epithelial cell transformation.Exp Cell Res,1979,118:394.
12 Rubin R W,Warren R H.Organization of tubulin in normal and transformed rat kidney Cells.J Cell Biol,1979,82:103.
, 百拇医药
13 Puck T T.Cyclic AMP,the microtubul-microfilament system,and cancer,Proc Natl Acad Sci U S A,1977,74:4491.
14 Brinkley B R,Cox S M,Pepper D A,et al.Tubulin assembly sites and the organization of cytoplasmic microtubules in cultured mammalian cells.J Cell Biol,1981,90:554.
15 Pollack R,Osborn M,Weber K.Patterns and organiza-tion of action and myosin in normal and transformed cultured cells.Proc Natl Acad Sci USA,1975,72:994.
, 百拇医药
16 McNutt N S,Culp L A,Black PH.Cantact-inhibited revertant cell lines isolated from SV40-transformed cells.Ⅱ.Ultrastructural study.J Cell Biol,1971,50:691.
17 王代树,高 燕,石永进,第。三种细胞系膜表面ConA受体的再分布和侧向扩散的研究,生物物理学报,1991,7:64.
18 Juara,M.G,Maria T M,Pilar E.Biological roles of cylic AMP.TIBS,1985,10(5):210.
19 Najam N,Clair T,Bassin RH,et al,Cyclic AMP suppresses expression of v-ras H oncogene linked to the mouse mammary tumor virus promoter.Biochem Biophys Res Commun,1986,143:436.
, http://www.100md.com
20 Shen D W,Real FX,Deleo AB,et al.Protein P53 and inducer-mediated erythroleudemia cell commitment to terminal cell division.Proc Natl Acad Sci U S A,1983,80:5919.
21 吕桂芝,高 燕,黄衍川,等。外源性3’、5’环腺苷酸对人胃癌细胞学的影响。解剖学报,1987,18:391.
22 Kitagawa T.Protein synthesis in transformed 3T3 cells permeabilized by exogenous ATP.J Cell Physiol,1980,102:37.
23 Lubin M.Control of growth by intracellular potassium and sodium concentration is relaxed in transformed 3T3 cells.Bilchem Biophys Res Commun,1980,97:1060.
, 百拇医药
24 Lannigan D A,Knauf PA,MaCara IG.Relationship of the decreases in protein systhesis and intracellular Na+ during friend murine erytholeukemic cell diffe-rentiation.J Biol Chem,1986,261:14430.
25 王代树,梁云燕,汪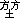 仁。3’,5’-cAMP对艾氏腹水癌细胞膜功能的作用。实验生物学报,1985,18:171.
仁。3’,5’-cAMP对艾氏腹水癌细胞膜功能的作用。实验生物学报,1985,18:171.
26 Putney J W Jr,Takemura H,Hughes AR,et al.How do inositol phosphates regulate calcium signaling?FASEBJ,1989,3:1899.
, 百拇医药
27 Mirabelli F,Salis A,Vairette M,et al.Cytoskeletal altera-tions in human platelets exposed to oxidative stress are mediated by oxidative and Ca2+-dependent mechan-isms.Arch Biochem Biophys,1989,270:478.
28 Kosower N S,Glaser T,Kosower EM.Membrane-mo-bility agent promoted fusion of erythrocytes:fusibility is correlated with attack by calcium-activated cyto-plasmic proteases on membrane proteins.Proc Natl Acad Sci U S A,1983,80:7542.
29 Harold EV.Form and function of retroviral proviruses.Science,1990,216:812.
30 Tumor suppressors.A new arena in the war against can-cer.J NIH Res,1990,2:62.
(收稿:1992-08-20 修回:1993-04-13), 百拇医药
单位:100083北京 国家自然科学基金委员会生命科学部
关键词:
中华医学杂志930720 最近我国学者首先发现,外源性ATP对数种癌细胞增殖有抑制作用,有一定浓度范围内对癌细胞的生长抑制,在此同时恶性表型向正常分化,细胞内cAMP水平升高。还证明ATP的抑癌作用依赖于细胞表面受体P2y的活化。上述提示ATP可能通过次级信使cAMP系统和P2y活化IP3/Ca2+双信使途径调节癌细胞的增殖与分化。它可望成为有前景的抑癌剂。
ATP抑制癌细胞增殖
吕桂芝等〔1〕用ATP(最终浓度0.32mg/ml)处理人胃腺癌SGC-7901细胞,则其增殖受抑制,4天后抑制率达80%以上。方伟岗〔2〕发现ATP及其类似物对人肺巨细胞癌PG细胞明显抑制,以100μmol/L ATP(≈0.055mg/ml)处理后第7天PG细胞生长被抑制56.6%,当浓度为lmmol/L时(0.55mg/ml),则生长被抑制90%以上。这种抑制现象在用ATP处理前列腺癌细胞的实验中得到证实〔3〕。同样,浓度0.16~0.23mg/ml的ATP对人胃腺癌MGC-803细胞也明显抑制,处理后第1天对细胞生长的抑制率为13%,第2天为43%,第4天则达80%以上〔4,5〕。其作用程度均受时间和剂量变化的影响。此外,在上述剂量范围内ATP对小鼠艾氏腹水癌和实体瘤的抑制率分别为70%和50%。
, http://www.100md.com
ATP促使癌细胞恶性表型向正常分化
实验资料表明〔1,2,4,5〕,ATP的浓度在100μmol/L~lmmol/L(0.055~0.55mg/ml)范围内,使其受处理的癌细胞恶性表型向正常分化的标志得以明显改善。
1.对癌细胞微绒毛的影响:癌细胞表面密布微绒毛和伪足。微绒毛与细胞增殖呈正相关〔6〕。当癌细胞经ATP连续处理则微绒毛缩短,数目减少以至消失,细胞表面变得平滑,附着力增加〔1〕。
2.对细胞核仁类型的影响:正常分化的细胞核仁呈环状,恶化细胞致密或呈网状,有较淡的染色纤维中心。许多因素都可使核仁类型发生变化〔5〕。Wachtler等以植物凝集素(PHA)处理外周血淋巴细胞则核仁由环状向网状或致密型过渡,表明核仁与细胞代谢和增殖启动有关。以丁酸钠诱导人胃癌细胞分化发现核仁由网状向环状过渡。ATP抑制细胞增殖的同时核仁银染蛋白量减少,银染颗粒的数目和面积锐减〔1,7〕。若连续处理,则核仁逐渐规则化,出现纤维和颗粒状组成的中心和环状表型。嗜银染色强弱可代表核仁rRNA基因转录活性的高低,用药后核仁银染蛋白量和面积减少暗示细胞增殖抑制是由于rDNA转录活性抑制的结果〔5〕。
, 百拇医药
3.对癌细胞粘连蛋白纤维(fibronectin,FN)的影响FN是分布在细胞表面的粘着性糖蛋白,是胞外基质的重要成分,与细胞附着和增殖分化的信息传导有关,并调控细胞运动和微丝束组装。免疫荧光技术证实人和鸡胚细胞有FN,主要分布在粗面内质网和高尔基体上,G1期出现,M期消失〔8〕。恶性转化细胞含FN的量下降甚至消失,细胞变圆,附着力下降〔9〕。也有转化的乳腺细胞、膀胱细胞的FN并不减少的报道〔10,11〕。人胃癌细胞质内和细胞膜外表面FN呈弱阳性,经丁酸钠转化和ATP抑制增殖的癌细胞都导致细胞质和细胞膜表面的FN免疫荧光的强度显著增加〔1〕。表明FN增加与癌细胞增殖抑制和趋向分化有关。
4.对细胞骨架系统的影响:
(1)对微管的影响:正常间期细胞有完整的微管网架。癌细胞的微管减少、组装不良〔12〕。双丁酰3’,5’cAMP和cAMP使癌细胞逆转,微管组装改善〔13〕,表明微管变化与癌细胞逆转密切相关。若把外源微管蛋白加入到抽去微管蛋白的细胞内,正常细胞重组微管比以SV40病毒转化的细胞组装微管的量增加2~3倍〔14〕。Moitchison发现ATP可使着丝点延伸。受ATP抑制的胃癌细胞其微管系统从中央向边缘延伸,细胞质铺展〔4〕,说明ATP使微管系统组装改善与细胞形态正常分化有紧密关系。
, http://www.100md.com
(2)对微丝的影响:癌细胞的微丝束不发达,微丝染色呈斑点状,分布在细胞质外围〔15〕,转化的成纤维细胞微丝束减少,变细,膜-微丝复合物下降,细胞呈圆形,伸展性差。经肿瘤病毒转化细胞的微丝束和粘着斑的数目减少〔16〕。小儿包皮成纤维细胞的微丝束和FN都经肿瘤细胞多〔17〕。ATP处理人胃癌细胞则细胞质周边肌动蛋白的荧光斑消失,微丝束加粗、增长,纵横交织布满细胞质内,组装明显改善〔4〕。Bershadky证实,当细胞内ATP含量降至临界水平以下时微丝系统解聚,也表明ATP在维持微丝系统的形态和结构中所起的作用。
ATP抑制细胞增殖有关的信号传导
ATP抑制环腺苷酸磷酸二酯酶(cAMP-PDEase),阻止cAMP降解,维持细胞内cAMP水平。cAMP是细胞膜上朱苷酸环化酶水解ATP的产物,是细胞内重要的第二信使,活化cAMP依赖性蛋白激酶,并借助细胞内Na+、Ca2+浓度调控细胞增殖、分化和恶性表型逆转等〔6〕。Mulle证明cAMP通过磷蛋白抑制减数分裂。cAMP促使核蛋白磷酸化,影响基因转录的速度〔18〕。有资料证明cAMP对哺乳动物肿瘤的抑制伴随V-rasH基因的表达被阻断〔19〕。上述结果说明cAMP在分子水平上对细胞增殖的负调作用。王代树等以cAMP处理艾氏腹水癌发现癌基因c-myc、c-fos、c-sis、c-H-ras、P53表达改变,膜蛋白分子侧向运动变化,表明了cAMP运转膜蛋白分子扩散以及癌基因表达程度和癌细胞去恶化或再恶化有紧密关系。应指出的是:细胞表型变化晚于基因表达的改变。Shen等〔20〕证实基因表达改变后,细胞再经过几个周期才出现增殖的变化。
, 百拇医药
吕桂芝等〔21〕证明在癌细胞膜上依赖Na+、K+ATP酶的活性受抑制时,ATP积累,cAMP-PDEase活性降低。ATP转化3T3细胞则改变细胞膜的透性和K+/Na+的比率,影响细胞内蛋白质合成。ATP处理胃癌细胞则降低膜表面的cAMP-PEDase活性,提高胞内cAMP的含量〔22〕。这一结果被认为是ATP对细胞增殖、分化调控的重要机理,而细胞内Na+、K+比率的改变是细胞增殖〔23〕和分化〔24〕的重要原因。
ATP对肿瘤细胞生长抑制具有受体特异性,主要为P2y亚型所识别〔2,25〕。ATP与P2嘌呤受体结合激活磷酯酶C(PLC)使膜上肌醇磷脂(PIP2)降解产生二乙酰基甘油(DG)和三磷酸肌醇(IP3),也可通过另一种途径生成花生四烯酸。IP3与细胞内钙库的特异受体结合介导释放内源性Ca2+,调节细胞内游离钙〔Ca2+〕i的变化。实验证明IP3是释放细胞内源性〔Ca2+〕i的促进因素,因此可以认为TPA通过激活磷酯酰肌醇/钙离子信号传导途径对癌细胞增殖施加影响。一般情况下受体介导细胞内〔Ca2+〕i是刺激细胞分裂的信号。然而当细胞内〔Ca2+〕i调控机制遭受破坏,Ca2+浓度继续升高将导致:(1)细胞骨架结构改变丧失固有功能〔2,6〕;(2)激活磷酸酯酶,催化膜磷酯降解,产生炎症因子〔27〕;(3)激活蛋白酶,降解细胞内蛋白质,如骨架蛋白、膜蛋白(Chien R.R.1979);(4)激活内切酶,切断DNA链,解聚核小体〔28〕。所以细胞内钙离子代谢的失调和紊乱可能是抑制细胞增殖的重要原因。
, http://www.100md.com
总之,ATP抑制癌细胞增殖及其恶性表型逆转是极其复杂的生化过程。可从原癌基因突变及过度表达产生有转化活性的癌基因蛋白最终导致肿瘤〔29〕。从抗癌基因突变和缺乏多步骤变化引起癌变的事实〔30〕可归结出:基因突变是癌变的起因。
研究表明,许多癌基因产物是细胞内信号传导途径的重要的组成部分。例如V-sis基因产物与PDGF的β链相同,int-2基因编码蛋白质与FGF相同。Steeg发现癌转移抑制基因nM23的产物是一种三磷酸核苷激酶,它可将二磷酸核苷转换成三磷酸核苷,参与细胞内信号传导。而对ATP抑制癌细胞增殖及伴随的恶性逆转,我们应进一步查明:膜受体将ATP刺激信号经细胞内第二信使传入细胞核内的途径?ATP引起哪些特定基因的启动和表达合成相应蛋白质调节细胞的代谢活动。
参考文献
1 吕桂芝,高 燕,黄衍川,等。外源性三磷酸腺苷对人胃腺癌SGC-7901细胞的生物学效应。解剖学报,1988,19:278.
, http://www.100md.com
2 方伟岗。转移性人肺巨细胞癌生长调节中的信号传导研究。1991,北京医科大学学位研究生(博士)论文。
3 Fang WG,Pirnia ,F,Bang Y,et al.P2-purinergic receptor agonists inhibit growth of androgen-indepen-dent prostate carcinoma cells.J Clin Invest Inc.1992,89:191.
4 吕桂芝,林仲翔,周立新,等。外源性三磷酸腺苷对人胃腺癌MGC-803细胞增殖和细胞骨架的影响。解剖学报,1990,21:274.
5 吕桂芝,高 燕,孟松娘,等。外源性ATP调控细胞的增殖和分化与cAMP-PDE酶、(Na+/K+)-ATP酶活性及核仁类型改变的相互关系的研究。解剖学报,1992,23:246.
, 百拇医药
6 Gina BK.Microvilli:a major difference between normal and cancer cell?Science,1975,188:819.
7 吕桂芝,高 燕,周立新,等。丁酸钠对人胃腺癌MGC-803细胞核仁纤维中心和银染蛋白的影响。实验生物学报,1991,24:317.
8 Hedman K.Intercellular localization of fibronectin using immunoperoxidase cytochemistry in light and elec-tron microscop.J Histochem Cytochem,1980,28:1233.
9 Hynes RO.Cell surface proteins and malignant transfor-mation.Biochem Biophys Acta,1976,458:73.
, 百拇医药
10 Taylor-paradimitrion J,Joy B,Jackie H.Production of fibronectin by normal and malignant human mamary epithelial cells.Cancer Res,1981,41:2491.
11 Wigley C B,Summerhayes IC.Loss of LETS protein is not a marder for salirary gland or bladder epithelial cell transformation.Exp Cell Res,1979,118:394.
12 Rubin R W,Warren R H.Organization of tubulin in normal and transformed rat kidney Cells.J Cell Biol,1979,82:103.
, 百拇医药
13 Puck T T.Cyclic AMP,the microtubul-microfilament system,and cancer,Proc Natl Acad Sci U S A,1977,74:4491.
14 Brinkley B R,Cox S M,Pepper D A,et al.Tubulin assembly sites and the organization of cytoplasmic microtubules in cultured mammalian cells.J Cell Biol,1981,90:554.
15 Pollack R,Osborn M,Weber K.Patterns and organiza-tion of action and myosin in normal and transformed cultured cells.Proc Natl Acad Sci USA,1975,72:994.
, 百拇医药
16 McNutt N S,Culp L A,Black PH.Cantact-inhibited revertant cell lines isolated from SV40-transformed cells.Ⅱ.Ultrastructural study.J Cell Biol,1971,50:691.
17 王代树,高 燕,石永进,第。三种细胞系膜表面ConA受体的再分布和侧向扩散的研究,生物物理学报,1991,7:64.
18 Juara,M.G,Maria T M,Pilar E.Biological roles of cylic AMP.TIBS,1985,10(5):210.
19 Najam N,Clair T,Bassin RH,et al,Cyclic AMP suppresses expression of v-ras H oncogene linked to the mouse mammary tumor virus promoter.Biochem Biophys Res Commun,1986,143:436.
, http://www.100md.com
20 Shen D W,Real FX,Deleo AB,et al.Protein P53 and inducer-mediated erythroleudemia cell commitment to terminal cell division.Proc Natl Acad Sci U S A,1983,80:5919.
21 吕桂芝,高 燕,黄衍川,等。外源性3’、5’环腺苷酸对人胃癌细胞学的影响。解剖学报,1987,18:391.
22 Kitagawa T.Protein synthesis in transformed 3T3 cells permeabilized by exogenous ATP.J Cell Physiol,1980,102:37.
23 Lubin M.Control of growth by intracellular potassium and sodium concentration is relaxed in transformed 3T3 cells.Bilchem Biophys Res Commun,1980,97:1060.
, 百拇医药
24 Lannigan D A,Knauf PA,MaCara IG.Relationship of the decreases in protein systhesis and intracellular Na+ during friend murine erytholeukemic cell diffe-rentiation.J Biol Chem,1986,261:14430.
25 王代树,梁云燕,汪
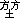 仁。3’,5’-cAMP对艾氏腹水癌细胞膜功能的作用。实验生物学报,1985,18:171.
仁。3’,5’-cAMP对艾氏腹水癌细胞膜功能的作用。实验生物学报,1985,18:171.26 Putney J W Jr,Takemura H,Hughes AR,et al.How do inositol phosphates regulate calcium signaling?FASEBJ,1989,3:1899.
, 百拇医药
27 Mirabelli F,Salis A,Vairette M,et al.Cytoskeletal altera-tions in human platelets exposed to oxidative stress are mediated by oxidative and Ca2+-dependent mechan-isms.Arch Biochem Biophys,1989,270:478.
28 Kosower N S,Glaser T,Kosower EM.Membrane-mo-bility agent promoted fusion of erythrocytes:fusibility is correlated with attack by calcium-activated cyto-plasmic proteases on membrane proteins.Proc Natl Acad Sci U S A,1983,80:7542.
29 Harold EV.Form and function of retroviral proviruses.Science,1990,216:812.
30 Tumor suppressors.A new arena in the war against can-cer.J NIH Res,1990,2:62.
(收稿:1992-08-20 修回:1993-04-13), 百拇医药