动脉粥样硬化病变为P53基因的实验研究
作者:杨和平 傅爱华 姚阿卿 杨亚东 张晨辉 周 洪 周爱儒 顾健人 陈伯荣 汤健
单位:100083北京医科大学心血管基础研究所(杨和平,傅爱华,姚阿卿,杨亚东,张晨辉,周 洪,周爱儒,汤 健),上海肿瘤研究所(顾健人)北京医科大学第一医院心内科(陈伯荣)
关键词:动脉粥样硬化;基因表达;实验,动物
中华医学杂志931112 摘要 对家兔行高脂、高胆固醇膳食和内皮细胞剥脱,对斑块组织内泡沫细胞进行了P53免疫组化和分子杂交研究。结果显示,泡沫细胞有P53基因的突变和低表达。这些变化可能与动脉粥样硬化的细胞异常增殖有关。
动脉粥样硬化斑块形成过程中,平滑肌细胞和单核巨噬细胞可转变成泡沫细胞〔1,2〕。原癌基因〔3,4〕与抗癌基因在调节细胞增殖和表型转变方面起重要作用〔5〕。本实验的目的在于检测动脉粥样硬化斑泡沫细胞中P53基因甲基化和表达。
, http://www.100md.com
材料和方法
1.动物模型:新西兰纯系雄性白兔12只,体重2.5~3.0kg。喂20%胆固醇饮食(胆固醇系荷兰进口,广州分装)1周时,用2%巴比妥钠0.4ml/kg耳缘静脉注入麻醉,4Fr Fogarty导管自右侧股动脉逆行插入腹主动脉约达膈水平,球囊内充以0.5~0.7ml生理盐水,缓慢回拉导管(5cm/s)至股动脉切口处,重复3次后移出导管,结扎股动脉,继续喂2%胆固醇加6%花生油饮食。6周后经内皮剥脱的血管形成粥样硬化病变。空气检塞处死家兔,分离斑块和斑块下中膜组织。
2.DNA提取和转膜:将12只兔主动脉斑块和斑块下中膜组织置于液氮速冻,研磨后置于10ml DNA抽提液〔10mmol/LTris-HCL,(pH8.0);0.1mmol/L乙二胺四乙酸二钠(pH8.0);20μg/ml RNase(RNA酶);0.5%十二烷基硫酸钠〕37℃孵育‘小时,加蛋白酶K至终浓度100μg/ml,用玻璃棒轻轻搅动,使酶充分混合,置于50℃孵育1小时,用酚和氯仿抽提DNA,取15μgDNA分别用MspI和HpaⅡ消化。经0.7%琼脂糖电泳12小时后,转移至尼龙膜上,于真空干燥器(80℃)烤2小时。
, 百拇医药
3.P53基因探针标记和Southern杂交:用碱变性法抽提野生型P53(P53-wt)基因片段C2.1kb(由上海市肿瘤研究所提供),低溶点琼脂糖回收P53基因片段,以α-32PdCTP按随机引物或缺口平移探针标记,按试剂盒说明书标记P53-wt基因。预杂交和杂交条件件按文献〔6〕。经2×SSC、1%SDS和0.1×SSC、0.1%SDS各洗2次(每次10分钟),于-70℃自显影。
4.组织细胞内RNA原位杂交:取12只兔(经内皮剥脱的主动脉病变)一小段血管,连续冰冻切片,每10片选一个切片,用作RNA原位杂交和免疫组化研究。组织细胞RNA原位杂交的操作流程如下:冰冻切片复温→系列乙醇复水→磷酸缓冲液内含5mmol/L的氯化镁洗10分钟→0.2mol/L盐酸洗20分钟→磷酸缓冲液内含5mmol/L氯化镁洗5分钟(2次)→适量的蛋白酶K孵育(37℃)15分钟→0.2%甘氨酸孵育15分钟→磷酸缓冲液内含5mmol/L MgCI2洗5分钟→4%多聚甲醛固定10分钟→磷酸缓冲液内含5mmol/L氯化镁洗10分钟,乙醇梯度脱水、空气干燥→杂交和免疫检测按地高辛药盒(Boehringer Mannheim)操作。
, 百拇医药
5.组织细胞免疫组化:P53单克隆抗体PAb240购于Promage公司。免抗辣根过氧化物酶购于华美生物工程公司。免疫组化参照文献〔7〕。
6.电镜观察按常规方法。
结 果
内皮剥脱加喂高脂高胆固醇6周时,内膜面均显示不同程度的动脉管腔狭窄,1只兔右股动脉完全闭塞。光镜下可见中膜平滑肌细胞向内腔转移(图1),并转变成泡沫细胞(图2);电镜下可见平滑肌源性泡沫细胞内富含粗面内质网、线粒体、核糖体,高尔基复合体发达,并可见细胞内含大小不等的脂滴,肌丝较少。在斑块表层里,可见单核/巨噬细胞积聚,并转变成泡沫细胞;胞质中含有发达的高尔基复合体,丰富的线粒体、数量不等溶酶体和脂滴。在血管壁靠内膜面,有大量的单核/巨噬细胞附着内膜,细胞表面伸出许多伪足(图3)。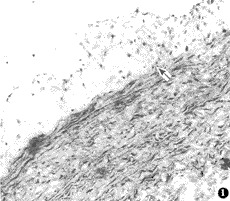

, 百拇医药
图1 中膜平滑肌细胞向内膜转移(箭头所示),×10,HE 染色
图2 肌源性泡沫细胞,靠核极的胞质中有丰富的内质网和大小不等的脂滴.N代表核,L为脂滴,R为网质网,×4000,透射电镜
图3 单核/巨噬细胞附着内膜面,细胞表面有大量伪足,×3000扫描电镜
对斑块和斑块下中膜组织DNA进行MspI和HpaII酶切,以α-32PdcTP标记的P53-wt进行Southern杂交。发现在12只兔中用MspI酶切的斑块组织和斑块下中膜组织均出现6条带。12只兔斑块下组织用HpaII酶切均出现3条高分子量和1条低分子量的带型;12只斑块组织用HpaII酶切后有9只与斑块旁相同,另有3只出现了1条高分子量和1条低分子量的带型(图4),说明这3只兔斑块组织出现了P53-wt基因的甲基化。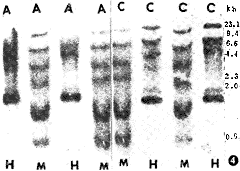
, 百拇医药
图4 斑块内P53蛋白CCGG序列中部分HpaII酶切点消失,A为斑块,C为斑块下中膜,H=HpaII,M=MspI
P53单克隆抗体PAB240只能和突变型P53蛋白产生反应。用免疫组化方法显示12只兔斑块中有3只出现了P53突变蛋白的表达(图5)。用地高辛标记的P53探针对12只兔斑块泡沫细胞进行原位杂交,未见阳性信号,但斑块下中膜平滑肌细胞有颗粒状反应产物(图6)。

图5 斑块泡沫细胞有突变型P53蛋白(箭头所示),×10
图6 斑块内泡沫细胞内无野生型P53“反应颗粒”,斑块下中膜平滑肌细胞有少量“反应颗粒”(箭头所示),×10
, 百拇医药
讨 论
在DNA分子中,除含有A、T、G、C四种碱基外,还普遍地发现有5-甲基胞嘧啶(5-mC)。在真核生物中,5-mC主要出现在5′-CpG-3′序列。大部分真核生物DNA中的5-mC残基(大约90%)发现于二核苷酸5′-CpG-3′中。HpaII和MspI都能切割5′-C↓CGG-3′部位,若序列内部的C残基被甲基化为5′-CC*GG-3′时,则HpaII不能切割它,而MspI仍能切割这个部位,因此可作为检查甲基化的一个方便而有效的手段。William等〔8〕用MspI和HpaII消化白细胞DNA,检查LDL受体基因和P53基因甲基化状态:MspI消化的DNA出现小分子量的DNA片段,HpaII消化的DNA出现一条高分子量的带型(~13.6kb),表明CCGG序列出现了明显的甲基化。他们还用序列分析方法发现LDL受体基因中,构成密码子407和408的CpG二核苷酸序列以及密码子409和410序列都有DNA甲基化。Lubbert等用MspI和HpaII消化白细胞DNA,以P53cDNA作探针,结果显示五个酶切位点出现了甲基化。本实验在家兔动脉粥样硬化斑块组织观察到:12例斑块中有3例发生P53-wt基因甲基化。
, http://www.100md.com
据估计,35%的点突变发生在CpG二核苷酸序列,约90%的点突变由C变为T,或者由C变为A。CpG序列是P53基因突变频发部位,约40%的点突变发生在CpG序列。因此,CpG甲基化能增加其突变的发生〔9〕。利用单克隆抗体PAb240只能和突变型P53蛋白产生反应的特点对斑块内泡沫细胞进行了免疫组化分析,结果表明12只兔中有3只斑块中的泡沫细胞内有阳性反应。推测可能有P53基因的突变。目前我们正在对斑块内P53DNA序列进行测定。
众多的研究表明DNA甲基化与基因表达多呈负相关〔10〕。本实验用原位杂交技术显示斑块内泡沫细胞几乎无阳性颗粒存在,而在斑块旁中膜平滑肌细胞有P53-wt基因表达,这说明斑块内泡沫细胞可能有P53基因的失活。P53-wt为细胞增殖抑制基因,P53-wt基因的失活可引起细胞增殖。
, http://www.100md.com
参考文献
1 杨和平,胡恒山,杨永宗等。内皮细胞、单核细胞与动脉粥样硬化形成和消退。心肺血管学报,1990,9∶36。
2 杨和平,杨永宗。动脉粥样硬化形成和消退中平滑肌细胞定量研究。心肺血管学报,1990,9∶66。
3 杨和平,张 敏,杨永宗,等。动脉粥样硬化斑块内泡沫细胞c-sis和c-myc基因表达的研究。中国病理生理杂志,1992,8∶622。
4 杨和平,张 敏,刘革修等。动脉粥样硬化斑块和斑块旁中膜平滑肌细胞c-sis基因表达的比较研究。中华病理学杂志,1992,21∶349。
5 Sager R,Tumor suppressor genes:the puzzle and the promise.Science,1989,246∶1406。
, 百拇医药
6 Wahl GD,Stern M,Stark GR.Efficient tranfer of large DNA from agarose gels to diazobenzyloxymethyl-paper and rapid hybridization by using detran sulfate.Proc Natl Acad Sci USA,1979,76∶3683。
7 Midgley CA,Fisher CJ,BartekJ,et al.Analysisof P53expression in human tumours.an antibody raised against human P53expressed in Escherichia Coli.Joural of Cell Science,1992,101∶183。
8 William M,Rideout III,Gerhard A,et al.5-methlcytosine as an endogenous mutagen in the human LDL receptor and P53genes.Science,1990,249∶1288。
9 Jones PA,Rideout WM,Shen JC et al.Methylation,mu-tation and cancer.Bioessays,1992,14∶33。
10 Sakai T,Toguchida J,Ohtani N,et al.Allele-specific hypermethylation of the retinoblastoma tumor-sup-pressor gene.Am JHum Genet,1991,48∶880。
(收稿:1993-01-28 修回:1993-08-10), http://www.100md.com
单位:100083北京医科大学心血管基础研究所(杨和平,傅爱华,姚阿卿,杨亚东,张晨辉,周 洪,周爱儒,汤 健),上海肿瘤研究所(顾健人)北京医科大学第一医院心内科(陈伯荣)
关键词:动脉粥样硬化;基因表达;实验,动物
中华医学杂志931112 摘要 对家兔行高脂、高胆固醇膳食和内皮细胞剥脱,对斑块组织内泡沫细胞进行了P53免疫组化和分子杂交研究。结果显示,泡沫细胞有P53基因的突变和低表达。这些变化可能与动脉粥样硬化的细胞异常增殖有关。
动脉粥样硬化斑块形成过程中,平滑肌细胞和单核巨噬细胞可转变成泡沫细胞〔1,2〕。原癌基因〔3,4〕与抗癌基因在调节细胞增殖和表型转变方面起重要作用〔5〕。本实验的目的在于检测动脉粥样硬化斑泡沫细胞中P53基因甲基化和表达。
, http://www.100md.com
材料和方法
1.动物模型:新西兰纯系雄性白兔12只,体重2.5~3.0kg。喂20%胆固醇饮食(胆固醇系荷兰进口,广州分装)1周时,用2%巴比妥钠0.4ml/kg耳缘静脉注入麻醉,4Fr Fogarty导管自右侧股动脉逆行插入腹主动脉约达膈水平,球囊内充以0.5~0.7ml生理盐水,缓慢回拉导管(5cm/s)至股动脉切口处,重复3次后移出导管,结扎股动脉,继续喂2%胆固醇加6%花生油饮食。6周后经内皮剥脱的血管形成粥样硬化病变。空气检塞处死家兔,分离斑块和斑块下中膜组织。
2.DNA提取和转膜:将12只兔主动脉斑块和斑块下中膜组织置于液氮速冻,研磨后置于10ml DNA抽提液〔10mmol/LTris-HCL,(pH8.0);0.1mmol/L乙二胺四乙酸二钠(pH8.0);20μg/ml RNase(RNA酶);0.5%十二烷基硫酸钠〕37℃孵育‘小时,加蛋白酶K至终浓度100μg/ml,用玻璃棒轻轻搅动,使酶充分混合,置于50℃孵育1小时,用酚和氯仿抽提DNA,取15μgDNA分别用MspI和HpaⅡ消化。经0.7%琼脂糖电泳12小时后,转移至尼龙膜上,于真空干燥器(80℃)烤2小时。
, 百拇医药
3.P53基因探针标记和Southern杂交:用碱变性法抽提野生型P53(P53-wt)基因片段C2.1kb(由上海市肿瘤研究所提供),低溶点琼脂糖回收P53基因片段,以α-32PdCTP按随机引物或缺口平移探针标记,按试剂盒说明书标记P53-wt基因。预杂交和杂交条件件按文献〔6〕。经2×SSC、1%SDS和0.1×SSC、0.1%SDS各洗2次(每次10分钟),于-70℃自显影。
4.组织细胞内RNA原位杂交:取12只兔(经内皮剥脱的主动脉病变)一小段血管,连续冰冻切片,每10片选一个切片,用作RNA原位杂交和免疫组化研究。组织细胞RNA原位杂交的操作流程如下:冰冻切片复温→系列乙醇复水→磷酸缓冲液内含5mmol/L的氯化镁洗10分钟→0.2mol/L盐酸洗20分钟→磷酸缓冲液内含5mmol/L氯化镁洗5分钟(2次)→适量的蛋白酶K孵育(37℃)15分钟→0.2%甘氨酸孵育15分钟→磷酸缓冲液内含5mmol/L MgCI2洗5分钟→4%多聚甲醛固定10分钟→磷酸缓冲液内含5mmol/L氯化镁洗10分钟,乙醇梯度脱水、空气干燥→杂交和免疫检测按地高辛药盒(Boehringer Mannheim)操作。
, 百拇医药
5.组织细胞免疫组化:P53单克隆抗体PAb240购于Promage公司。免抗辣根过氧化物酶购于华美生物工程公司。免疫组化参照文献〔7〕。
6.电镜观察按常规方法。
结 果
内皮剥脱加喂高脂高胆固醇6周时,内膜面均显示不同程度的动脉管腔狭窄,1只兔右股动脉完全闭塞。光镜下可见中膜平滑肌细胞向内腔转移(图1),并转变成泡沫细胞(图2);电镜下可见平滑肌源性泡沫细胞内富含粗面内质网、线粒体、核糖体,高尔基复合体发达,并可见细胞内含大小不等的脂滴,肌丝较少。在斑块表层里,可见单核/巨噬细胞积聚,并转变成泡沫细胞;胞质中含有发达的高尔基复合体,丰富的线粒体、数量不等溶酶体和脂滴。在血管壁靠内膜面,有大量的单核/巨噬细胞附着内膜,细胞表面伸出许多伪足(图3)。


, 百拇医药
图1 中膜平滑肌细胞向内膜转移(箭头所示),×10,HE 染色
图2 肌源性泡沫细胞,靠核极的胞质中有丰富的内质网和大小不等的脂滴.N代表核,L为脂滴,R为网质网,×4000,透射电镜

图3 单核/巨噬细胞附着内膜面,细胞表面有大量伪足,×3000扫描电镜
对斑块和斑块下中膜组织DNA进行MspI和HpaII酶切,以α-32PdcTP标记的P53-wt进行Southern杂交。发现在12只兔中用MspI酶切的斑块组织和斑块下中膜组织均出现6条带。12只兔斑块下组织用HpaII酶切均出现3条高分子量和1条低分子量的带型;12只斑块组织用HpaII酶切后有9只与斑块旁相同,另有3只出现了1条高分子量和1条低分子量的带型(图4),说明这3只兔斑块组织出现了P53-wt基因的甲基化。

, 百拇医药
图4 斑块内P53蛋白CCGG序列中部分HpaII酶切点消失,A为斑块,C为斑块下中膜,H=HpaII,M=MspI
P53单克隆抗体PAB240只能和突变型P53蛋白产生反应。用免疫组化方法显示12只兔斑块中有3只出现了P53突变蛋白的表达(图5)。用地高辛标记的P53探针对12只兔斑块泡沫细胞进行原位杂交,未见阳性信号,但斑块下中膜平滑肌细胞有颗粒状反应产物(图6)。


图5 斑块泡沫细胞有突变型P53蛋白(箭头所示),×10
图6 斑块内泡沫细胞内无野生型P53“反应颗粒”,斑块下中膜平滑肌细胞有少量“反应颗粒”(箭头所示),×10
, 百拇医药
讨 论
在DNA分子中,除含有A、T、G、C四种碱基外,还普遍地发现有5-甲基胞嘧啶(5-mC)。在真核生物中,5-mC主要出现在5′-CpG-3′序列。大部分真核生物DNA中的5-mC残基(大约90%)发现于二核苷酸5′-CpG-3′中。HpaII和MspI都能切割5′-C↓CGG-3′部位,若序列内部的C残基被甲基化为5′-CC*GG-3′时,则HpaII不能切割它,而MspI仍能切割这个部位,因此可作为检查甲基化的一个方便而有效的手段。William等〔8〕用MspI和HpaII消化白细胞DNA,检查LDL受体基因和P53基因甲基化状态:MspI消化的DNA出现小分子量的DNA片段,HpaII消化的DNA出现一条高分子量的带型(~13.6kb),表明CCGG序列出现了明显的甲基化。他们还用序列分析方法发现LDL受体基因中,构成密码子407和408的CpG二核苷酸序列以及密码子409和410序列都有DNA甲基化。Lubbert等用MspI和HpaII消化白细胞DNA,以P53cDNA作探针,结果显示五个酶切位点出现了甲基化。本实验在家兔动脉粥样硬化斑块组织观察到:12例斑块中有3例发生P53-wt基因甲基化。
, http://www.100md.com
据估计,35%的点突变发生在CpG二核苷酸序列,约90%的点突变由C变为T,或者由C变为A。CpG序列是P53基因突变频发部位,约40%的点突变发生在CpG序列。因此,CpG甲基化能增加其突变的发生〔9〕。利用单克隆抗体PAb240只能和突变型P53蛋白产生反应的特点对斑块内泡沫细胞进行了免疫组化分析,结果表明12只兔中有3只斑块中的泡沫细胞内有阳性反应。推测可能有P53基因的突变。目前我们正在对斑块内P53DNA序列进行测定。
众多的研究表明DNA甲基化与基因表达多呈负相关〔10〕。本实验用原位杂交技术显示斑块内泡沫细胞几乎无阳性颗粒存在,而在斑块旁中膜平滑肌细胞有P53-wt基因表达,这说明斑块内泡沫细胞可能有P53基因的失活。P53-wt为细胞增殖抑制基因,P53-wt基因的失活可引起细胞增殖。
, http://www.100md.com
参考文献
1 杨和平,胡恒山,杨永宗等。内皮细胞、单核细胞与动脉粥样硬化形成和消退。心肺血管学报,1990,9∶36。
2 杨和平,杨永宗。动脉粥样硬化形成和消退中平滑肌细胞定量研究。心肺血管学报,1990,9∶66。
3 杨和平,张 敏,杨永宗,等。动脉粥样硬化斑块内泡沫细胞c-sis和c-myc基因表达的研究。中国病理生理杂志,1992,8∶622。
4 杨和平,张 敏,刘革修等。动脉粥样硬化斑块和斑块旁中膜平滑肌细胞c-sis基因表达的比较研究。中华病理学杂志,1992,21∶349。
5 Sager R,Tumor suppressor genes:the puzzle and the promise.Science,1989,246∶1406。
, 百拇医药
6 Wahl GD,Stern M,Stark GR.Efficient tranfer of large DNA from agarose gels to diazobenzyloxymethyl-paper and rapid hybridization by using detran sulfate.Proc Natl Acad Sci USA,1979,76∶3683。
7 Midgley CA,Fisher CJ,BartekJ,et al.Analysisof P53expression in human tumours.an antibody raised against human P53expressed in Escherichia Coli.Joural of Cell Science,1992,101∶183。
8 William M,Rideout III,Gerhard A,et al.5-methlcytosine as an endogenous mutagen in the human LDL receptor and P53genes.Science,1990,249∶1288。
9 Jones PA,Rideout WM,Shen JC et al.Methylation,mu-tation and cancer.Bioessays,1992,14∶33。
10 Sakai T,Toguchida J,Ohtani N,et al.Allele-specific hypermethylation of the retinoblastoma tumor-sup-pressor gene.Am JHum Genet,1991,48∶880。
(收稿:1993-01-28 修回:1993-08-10), http://www.100md.com