硒对体外培养小鼠心脏心肌缺血损伤的影响
作者:朱天义 彭 麟 李光芝 徐 军 李 明 张吉文
单位:110005沈阳,辽宁省基础医学研究所病理室、电镜室
关键词:硒;心脏损伤;缺氧;缺血;动物,实验
中华医学杂志931104 摘要 应用体外培养小鼠整体心脏模型,研究了硒对实验性缺血、缺氧和缺血缺氧心肌的影响。结果表明,硒能延长实验性缺血、缺氧和缺血缺氧条件下培养心脏的存活和自主性搏动的时间;镧探针电镜技术和酸性磷酸电镜组化技术证明,硒有维持实验性缺血、缺氧和缺血缺氧条件下培养心脏的细胞膜、线粒体膜、溶酶体膜和高尔基体膜通透功能的作用;常规电镜观察表明,硒在一定限度内能稳定心肌细胞膜系统结构的完整性,推迟不可逆性损伤的发生,根据加硒和未加硒组培养心脏的心肌细胞内核糖体、多聚核糖体和短段粗面内质网数量存在的明显差异,提示硒可能在蛋白质合成和促进细胞修复过程中起作用。
, 百拇医药 为了进一步探讨硒对缺血性心脏病的防治作用,自1987下以来,我们用器官培养的心脏模型,较系统地从心脏功能、膜系统功能、超微结构和蛋白质合成等方面研究了硒对实验性缺血、缺氧和缺血缺氧心肌的影响。现将结果报道如下。
材料和方法
一、整体心脏培养
采用我们建立的方法〔1〕,对孕龄16~18天小鼠胎鼠,在无菌条件下,剖取整体心脏,修去心包和过长的血管,然后把搏动的心脏放入培养瓶内气体和液体交界面的不锈钢支持网上。心脏的底部浸入到培养液中,心尖部要暴露于气体中。培养瓶口用胶塞密封。37±0.5C温箱中培养。
二、实验方法
将整体培养的心脏,随机分为两组,对照组用无葡萄糖的低限量Eagle培养基(即MEM液,北京生物物理所生物制品厂产品)+5%小牛血清,在95%O2+5%CO2中培养心脏,建立实验性缺血条件;以MEM液+5%小牛血清,在95%N2+5%CO2中培养心脏,建立缺氧条件;采用无葡萄糖的MEM液+5%小牛血清,在95%N2+5%CO2中培养心脏,建立缺血缺氧条件。加硒实验组培养液中另加亚硒酸纳0.5μg/ml。刚取下的心脏分别用加硒和未加硒的MEM液,在95%O2+5%CO2中常规培养24小时,以使加硒组心脏蓄积一定量硒,并测定不同培养时间心脏组织内硒含量。
, 百拇医药
实验开始后,每组各培养14~17个心脏,用作观察心室搏动的时间,并分别在实验开始后10、15、20、30、40、60分钟,2、4、6、8小时,各取6个心脏,于心尖部切取带有心外膜的组织块,分别按常规电镜、镧探针标记心肌细胞膜通透性〔2〕、酸性磷酸酶组化电镜标本制备程序处理。用H-600-4型电镜观察。
结 果
一、心脏组织内硒含量
实验开始时,未加硒组心脏组织内硒含量为0.43±0.04μg/g湿重,加硒者为1.90±0.06μg/g湿重。
二、心室搏动的时间
在实验性缺血条件下,加硒组17个心脏培养到30小时,仅有6个心脏心室停止搏动,而未加硒组17个心脏全部停止搏动。在缺氧条件下,加硒组14个心脏心室搏动持续时间平均为150±9分钟,未加硒者为100±9分钟,两者差异有显著意义(P〈0.05)。在缺血缺氧条件下,加硒组15个心脏心室搏动时间平均为93±7分钟,未加硒者为54±6分钟,两者差异有显著意义(P〈0.05)。
, 百拇医药
三、膜系统通透功能变化
镧探针电镜技术证明,实验性缺血60分钟,缺氧20分钟,缺血缺氧15分钟,加硒组培养的心脏,镧颗粒仅沉积在细胞外间隙及横管内,有的可见基底膜被染色(图1)。未加硒组培养的心脏,镧颗粒则进入细胞内,在线粒体的外膜上呈结节状沉积(图2)。值得注意的是,缺血缺氧到20分钟,加硒组心脏镧颗粒只见于细胞浆内,未加硒者可见细胞内细小的镧颗粒进入线粒体过程的各种形态(图3),以及有选择性的沉积在肿胀或轻度空泡变性的线粒体内(图4)。实验性缺血2小时,缺氧和缺血缺氧到30分钟,加硒和未加硒各组心脏细胞浆内镧颗粒沉积的强度难以区别,但线粒体内镧颗粒沉积的强度尚有差异。
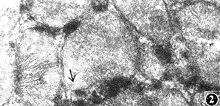
图1 加硒组心脏缺血缺氧15分种,细胞超微结构正常,镧颗粒只沉积在细胞间隙和T管内 ×17000
, 百拇医药
图2 未加硒组心脏缺氧20分种,进入细胞内的镧颗粒呈结节状,沉积于线粒体的外膜上 ×24000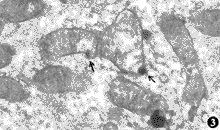
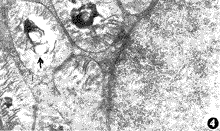
图3 未加硒组心脏缺血缺氧20分种,可见细胞内的镧颗粒进入线粒体内的各个形态 ×17000
图4 未加硒组心脏缺血缺氧20分种,可见细胞内的镧颗粒有选择性地沉积在肿胀的线粒体内 ×24000
酸性磷酸酶电镜组化技术证明,缺氧20分钟,加硒组心脏细胞内酸性磷酸酶反应物仅见于核周区溶酶体和高尔基体内。未加硒组心脏细胞内酶反应物显著增多,位于核周区的胞浆内,形态呈不规整的粗大团块、絮状或细小颗粒状。并可见反应物周围胞浆成分被酶水解而呈空亮区。缺氧到30分钟,除未加硒组心脏细胞高尔基体内酶反应物消失外,两组心脏细胞浆内酶反应物的数量、分布无差异。
, 百拇医药
四、早期超微结构变化
常规电镜观察表明,实验性缺血60分钟,缺氧20分钟,缺血缺氧15分钟,未加硒组心脏有细胞水肿,糖原颗粒灶状消失,肌浆网扩张,部分线粒体肿胀,基质有小的透光区。加硒组心脏细胞呈正常的超微形态(图5)。实验性缺血2小时,缺氧到40分钟,缺血缺氧30分钟,未加硒组心脏最明显的普通化是细胞膜和膜性细胞器的变化。主要有细胞膜电子密度不均,结构模糊,有节段性结构丧失或断续性袭隙,严重者质膜和基底膜完全破坏。线粒体高度肿胀,嵴断裂和消失,基质有大小不等的空泡,部分线粒体膜单层化或整个线粒体崩解。核双膜结构不清,有的外膜呈锯齿状或囊状膨出(图6)。肌原纤维呈高度收缩状,I带肌丝排列松散,有断裂,透光度增强。Z线多呈S形。细胞浆中因糖原消失而呈大片空亮区(图7)。核染色质有周边凝聚现象。加硒组心脏除线粒体肿胀,嵴排列松散,部分线粒体基质有小的空泡外,细胞的超微结构基本正常(图8)。实验性缺血4小时,缺和缺血缺氧到1小时,细胞膜和膜性细胞器及收缩结构损伤的程度与未加硒组心脏相比,仍有差异。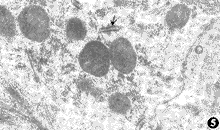

, 百拇医药
图5 加硒组心脏缺血缺氧15分种,细胞超微结构正常,有丰富核糖体,短段粒面内质网 ×17000
图6 未加硒组心脏缺血缺氧30分种,细胞膜有节段性结构消失,线粒体嵴消失,基质空泡变,核外膜呈锯齿状 ×24000

图7 未加硒组心脏缺血缺氧30分种,有的线粒体崩解,肌源纤维呈高度收缩状,Ⅰ带透光度增加,Z线多呈S形 ×24000
图8 加硒组心脏缺血缺氧30分种,线粒体肿胀,部分嵴有断裂,基质透光度增加 ×24000
值得注意的是,本项研究发现,加硒组培养的心脏细胞内,核糖体、多聚核糖体和短段粗面内质网极为丰富,与未加硒组心脏相比,形成明显的对照(图1,5,8)。
, 百拇医药
讨 论
本研究建立起培养心脏实验性缺血、缺氧和缺血缺氧模型,其超微结构变化与Kloner等〔3〕报道对缺血心肌所规定的标准相一致。用该模型研究微量元素硒对缺血心肌的影响,不仅实验条件易控制,而且可排除神经体液因素的复杂影响,获得的信息是实验因素对心肌的直接效应。
我们的观察结果表明,在上述三种实验条件下,加硒组心脏心室搏动时间明显长于未加硒者,差异有显著意义(P〈0.05)。根据心脏组织内硒测定的结果及严格控制的培养条件,认为硒有维持实验性缺血、缺氧和缺血缺氧条件下培养心脏存活和自主性搏动的作用。
硝酸镧颗粒大小平均约4nm,能穿过相当于2nm的间隙〔4〕。在正常情况下,这种微粒不能穿过无损伤的细胞膜进入细胞内,因此可作为标记膜通透性变化的“探针”〔5〕。从本实验结果看,在三种实验性条件下,加硒组和未加硒组心脏细胞内和线粒体内镧颗粒沉积的差异,说明硒对维持细胞膜和线粒体膜通透功能有一定的效果。电镜酸性磷酸酶组化技术也证明,硒具有维持溶酶体膜和高尔基体膜的通透功能。
, 百拇医药
常规电镜观察表明,实验性缺血、缺氧和缺血缺氧心肌细胞发生的早期超微结构改变是从膜系统开始的。随着实验时间的延长,主要的结构损伤是细胞膜和膜性细胞器,这些反映了膜系统病变的广泛性和进展性,其病理过程是从膜系统功能改变到膜系统结构损伤破坏的发展过程。对加硒组心脏观察结果可以看出,在损伤的早期,硒有保护心肌细胞膜系统通透功能的作用,从而维持细胞的正常代谢。当病变发展到结构破坏时,硒能稳定膜系统结构的完整性,推迟不可逆性损伤的发生。
本研究发现,加硒组培养的心脏细胞内含有极为丰富的粗面内质网和核糖体,与未加硒组相比有明显的差异,揭示硒可能在蛋白质合成和细胞修复中起重要作用。
据文献报道〔6〕,硒可能作为谷胱甘肽过氧化物酶的活性中心,通过该酶清除实验性缺血、缺氧和缺血缺氧时心肌细胞内产生的过多氧自由基,抑制脂质过氧化反应对质膜的破坏〔7〕,以及促进蛋白质合成,加速 细胞修复而发挥保护作用。
, 百拇医药
参考文献
1.朱天议,张吉文,任宏造,等。小鼠胎心器官培养方法的研究。中华心血管病杂志,1984,12∶302
2.朱天义,任宏造。硝酸镧显示心肌细胞通透性变化的电镜技术。中华物理医学杂志,1983,5∶231
3.Kloner RA,Ingwall JS.The cultured fetal mouse heart asa model for studying myocardial ischemic necrosis.Exp MolPathol,1980,2∶317
4.Bruton KP,Hagler HK,Templeton GH,et al.lanthanum probe studies of cellular pathophysiology induced by hypoxia in isolated cardiac muscle,J Clin Invest,1977,60∶1289
, http://www.100md.com
5.Revel JP.Hexagonal array of subunits in intercellular junction of the mouse heart and liver,J Cell Biol,1967,33∶7
6.Rotruck JT.Selenium biochemical role as component of glutathione petoxidase,Science,1973179∶583
7.Meerson FI.Kagan VE,Kozlok YUP,et al.The role of lipid peroxidationin pathogenesis of ischenic damage and the antioxidant protection of the heart.Basic Res Cardiol,1982,77∶465
(收稿:1993-06-01 修回:1993-07-25), 百拇医药
单位:110005沈阳,辽宁省基础医学研究所病理室、电镜室
关键词:硒;心脏损伤;缺氧;缺血;动物,实验
中华医学杂志931104 摘要 应用体外培养小鼠整体心脏模型,研究了硒对实验性缺血、缺氧和缺血缺氧心肌的影响。结果表明,硒能延长实验性缺血、缺氧和缺血缺氧条件下培养心脏的存活和自主性搏动的时间;镧探针电镜技术和酸性磷酸电镜组化技术证明,硒有维持实验性缺血、缺氧和缺血缺氧条件下培养心脏的细胞膜、线粒体膜、溶酶体膜和高尔基体膜通透功能的作用;常规电镜观察表明,硒在一定限度内能稳定心肌细胞膜系统结构的完整性,推迟不可逆性损伤的发生,根据加硒和未加硒组培养心脏的心肌细胞内核糖体、多聚核糖体和短段粗面内质网数量存在的明显差异,提示硒可能在蛋白质合成和促进细胞修复过程中起作用。
, 百拇医药 为了进一步探讨硒对缺血性心脏病的防治作用,自1987下以来,我们用器官培养的心脏模型,较系统地从心脏功能、膜系统功能、超微结构和蛋白质合成等方面研究了硒对实验性缺血、缺氧和缺血缺氧心肌的影响。现将结果报道如下。
材料和方法
一、整体心脏培养
采用我们建立的方法〔1〕,对孕龄16~18天小鼠胎鼠,在无菌条件下,剖取整体心脏,修去心包和过长的血管,然后把搏动的心脏放入培养瓶内气体和液体交界面的不锈钢支持网上。心脏的底部浸入到培养液中,心尖部要暴露于气体中。培养瓶口用胶塞密封。37±0.5C温箱中培养。
二、实验方法
将整体培养的心脏,随机分为两组,对照组用无葡萄糖的低限量Eagle培养基(即MEM液,北京生物物理所生物制品厂产品)+5%小牛血清,在95%O2+5%CO2中培养心脏,建立实验性缺血条件;以MEM液+5%小牛血清,在95%N2+5%CO2中培养心脏,建立缺氧条件;采用无葡萄糖的MEM液+5%小牛血清,在95%N2+5%CO2中培养心脏,建立缺血缺氧条件。加硒实验组培养液中另加亚硒酸纳0.5μg/ml。刚取下的心脏分别用加硒和未加硒的MEM液,在95%O2+5%CO2中常规培养24小时,以使加硒组心脏蓄积一定量硒,并测定不同培养时间心脏组织内硒含量。
, 百拇医药
实验开始后,每组各培养14~17个心脏,用作观察心室搏动的时间,并分别在实验开始后10、15、20、30、40、60分钟,2、4、6、8小时,各取6个心脏,于心尖部切取带有心外膜的组织块,分别按常规电镜、镧探针标记心肌细胞膜通透性〔2〕、酸性磷酸酶组化电镜标本制备程序处理。用H-600-4型电镜观察。
结 果
一、心脏组织内硒含量
实验开始时,未加硒组心脏组织内硒含量为0.43±0.04μg/g湿重,加硒者为1.90±0.06μg/g湿重。
二、心室搏动的时间
在实验性缺血条件下,加硒组17个心脏培养到30小时,仅有6个心脏心室停止搏动,而未加硒组17个心脏全部停止搏动。在缺氧条件下,加硒组14个心脏心室搏动持续时间平均为150±9分钟,未加硒者为100±9分钟,两者差异有显著意义(P〈0.05)。在缺血缺氧条件下,加硒组15个心脏心室搏动时间平均为93±7分钟,未加硒者为54±6分钟,两者差异有显著意义(P〈0.05)。
, 百拇医药
三、膜系统通透功能变化
镧探针电镜技术证明,实验性缺血60分钟,缺氧20分钟,缺血缺氧15分钟,加硒组培养的心脏,镧颗粒仅沉积在细胞外间隙及横管内,有的可见基底膜被染色(图1)。未加硒组培养的心脏,镧颗粒则进入细胞内,在线粒体的外膜上呈结节状沉积(图2)。值得注意的是,缺血缺氧到20分钟,加硒组心脏镧颗粒只见于细胞浆内,未加硒者可见细胞内细小的镧颗粒进入线粒体过程的各种形态(图3),以及有选择性的沉积在肿胀或轻度空泡变性的线粒体内(图4)。实验性缺血2小时,缺氧和缺血缺氧到30分钟,加硒和未加硒各组心脏细胞浆内镧颗粒沉积的强度难以区别,但线粒体内镧颗粒沉积的强度尚有差异。


图1 加硒组心脏缺血缺氧15分种,细胞超微结构正常,镧颗粒只沉积在细胞间隙和T管内 ×17000
, 百拇医药
图2 未加硒组心脏缺氧20分种,进入细胞内的镧颗粒呈结节状,沉积于线粒体的外膜上 ×24000


图3 未加硒组心脏缺血缺氧20分种,可见细胞内的镧颗粒进入线粒体内的各个形态 ×17000
图4 未加硒组心脏缺血缺氧20分种,可见细胞内的镧颗粒有选择性地沉积在肿胀的线粒体内 ×24000
酸性磷酸酶电镜组化技术证明,缺氧20分钟,加硒组心脏细胞内酸性磷酸酶反应物仅见于核周区溶酶体和高尔基体内。未加硒组心脏细胞内酶反应物显著增多,位于核周区的胞浆内,形态呈不规整的粗大团块、絮状或细小颗粒状。并可见反应物周围胞浆成分被酶水解而呈空亮区。缺氧到30分钟,除未加硒组心脏细胞高尔基体内酶反应物消失外,两组心脏细胞浆内酶反应物的数量、分布无差异。
, 百拇医药
四、早期超微结构变化
常规电镜观察表明,实验性缺血60分钟,缺氧20分钟,缺血缺氧15分钟,未加硒组心脏有细胞水肿,糖原颗粒灶状消失,肌浆网扩张,部分线粒体肿胀,基质有小的透光区。加硒组心脏细胞呈正常的超微形态(图5)。实验性缺血2小时,缺氧到40分钟,缺血缺氧30分钟,未加硒组心脏最明显的普通化是细胞膜和膜性细胞器的变化。主要有细胞膜电子密度不均,结构模糊,有节段性结构丧失或断续性袭隙,严重者质膜和基底膜完全破坏。线粒体高度肿胀,嵴断裂和消失,基质有大小不等的空泡,部分线粒体膜单层化或整个线粒体崩解。核双膜结构不清,有的外膜呈锯齿状或囊状膨出(图6)。肌原纤维呈高度收缩状,I带肌丝排列松散,有断裂,透光度增强。Z线多呈S形。细胞浆中因糖原消失而呈大片空亮区(图7)。核染色质有周边凝聚现象。加硒组心脏除线粒体肿胀,嵴排列松散,部分线粒体基质有小的空泡外,细胞的超微结构基本正常(图8)。实验性缺血4小时,缺和缺血缺氧到1小时,细胞膜和膜性细胞器及收缩结构损伤的程度与未加硒组心脏相比,仍有差异。


, 百拇医药
图5 加硒组心脏缺血缺氧15分种,细胞超微结构正常,有丰富核糖体,短段粒面内质网 ×17000
图6 未加硒组心脏缺血缺氧30分种,细胞膜有节段性结构消失,线粒体嵴消失,基质空泡变,核外膜呈锯齿状 ×24000


图7 未加硒组心脏缺血缺氧30分种,有的线粒体崩解,肌源纤维呈高度收缩状,Ⅰ带透光度增加,Z线多呈S形 ×24000
图8 加硒组心脏缺血缺氧30分种,线粒体肿胀,部分嵴有断裂,基质透光度增加 ×24000
值得注意的是,本项研究发现,加硒组培养的心脏细胞内,核糖体、多聚核糖体和短段粗面内质网极为丰富,与未加硒组心脏相比,形成明显的对照(图1,5,8)。
, 百拇医药
讨 论
本研究建立起培养心脏实验性缺血、缺氧和缺血缺氧模型,其超微结构变化与Kloner等〔3〕报道对缺血心肌所规定的标准相一致。用该模型研究微量元素硒对缺血心肌的影响,不仅实验条件易控制,而且可排除神经体液因素的复杂影响,获得的信息是实验因素对心肌的直接效应。
我们的观察结果表明,在上述三种实验条件下,加硒组心脏心室搏动时间明显长于未加硒者,差异有显著意义(P〈0.05)。根据心脏组织内硒测定的结果及严格控制的培养条件,认为硒有维持实验性缺血、缺氧和缺血缺氧条件下培养心脏存活和自主性搏动的作用。
硝酸镧颗粒大小平均约4nm,能穿过相当于2nm的间隙〔4〕。在正常情况下,这种微粒不能穿过无损伤的细胞膜进入细胞内,因此可作为标记膜通透性变化的“探针”〔5〕。从本实验结果看,在三种实验性条件下,加硒组和未加硒组心脏细胞内和线粒体内镧颗粒沉积的差异,说明硒对维持细胞膜和线粒体膜通透功能有一定的效果。电镜酸性磷酸酶组化技术也证明,硒具有维持溶酶体膜和高尔基体膜的通透功能。
, 百拇医药
常规电镜观察表明,实验性缺血、缺氧和缺血缺氧心肌细胞发生的早期超微结构改变是从膜系统开始的。随着实验时间的延长,主要的结构损伤是细胞膜和膜性细胞器,这些反映了膜系统病变的广泛性和进展性,其病理过程是从膜系统功能改变到膜系统结构损伤破坏的发展过程。对加硒组心脏观察结果可以看出,在损伤的早期,硒有保护心肌细胞膜系统通透功能的作用,从而维持细胞的正常代谢。当病变发展到结构破坏时,硒能稳定膜系统结构的完整性,推迟不可逆性损伤的发生。
本研究发现,加硒组培养的心脏细胞内含有极为丰富的粗面内质网和核糖体,与未加硒组相比有明显的差异,揭示硒可能在蛋白质合成和细胞修复中起重要作用。
据文献报道〔6〕,硒可能作为谷胱甘肽过氧化物酶的活性中心,通过该酶清除实验性缺血、缺氧和缺血缺氧时心肌细胞内产生的过多氧自由基,抑制脂质过氧化反应对质膜的破坏〔7〕,以及促进蛋白质合成,加速 细胞修复而发挥保护作用。
, 百拇医药
参考文献
1.朱天议,张吉文,任宏造,等。小鼠胎心器官培养方法的研究。中华心血管病杂志,1984,12∶302
2.朱天义,任宏造。硝酸镧显示心肌细胞通透性变化的电镜技术。中华物理医学杂志,1983,5∶231
3.Kloner RA,Ingwall JS.The cultured fetal mouse heart asa model for studying myocardial ischemic necrosis.Exp MolPathol,1980,2∶317
4.Bruton KP,Hagler HK,Templeton GH,et al.lanthanum probe studies of cellular pathophysiology induced by hypoxia in isolated cardiac muscle,J Clin Invest,1977,60∶1289
, http://www.100md.com
5.Revel JP.Hexagonal array of subunits in intercellular junction of the mouse heart and liver,J Cell Biol,1967,33∶7
6.Rotruck JT.Selenium biochemical role as component of glutathione petoxidase,Science,1973179∶583
7.Meerson FI.Kagan VE,Kozlok YUP,et al.The role of lipid peroxidationin pathogenesis of ischenic damage and the antioxidant protection of the heart.Basic Res Cardiol,1982,77∶465
(收稿:1993-06-01 修回:1993-07-25), 百拇医药