TIMP-2基因转染对高转移性人巨细胞肺癌细胞系生物学行为的影响
作者:李红梅 方伟岗 时 峥 郑 杰 由江峰 吴秉铨
单位:100083 北京医科大学病理学系
关键词:金属蛋白酶类;肿瘤转移
中华医学杂志970906 目的 探讨金属蛋白酶组织抑制因子TIMP-2对肿瘤恶性表型的逆转作用及其在肿瘤基因治疗上的意义。方法 利用基因重组技术构建了含全长TIMP-2 cDNA的真核表达载体,用脂质体法转染高转移性人肺癌细胞(PG),检测转染后PG细胞的金属蛋白酶(MMPs)活性、体外侵袭、裸鼠体内成瘤性及转移能力等多项生物学行为的变化。并以TIMP-2基因转染前后PG细胞的裸鼠皮下移植瘤为研究对象,利用免疫组织化学和原位杂交方法,研究在整体环境下MMP-2、MMP-9和TIMP-1、TIMP-2的mRNA及蛋白表达情况。结果 转染细胞较母系细胞TIMP-2 mRNA表达增强,MMP-2、MMP-9的产生及活性无明显变化,体外增殖能力增强,但体外侵袭和软琼脂集落形成能力以及裸鼠体内成瘤性及自发转移能力下降。此外,MMP-2、MMP-9和TIMP-1、TIMP-2在PG细胞之裸鼠皮下移植瘤的间质细胞及肿瘤细胞均有表达,阳性的肿瘤细胞主要位于肿瘤和间质交界处。结论 特异性上调TIMP-2基因的表达可在一定程度上逆转PG细胞的恶性表型。
, 百拇医药
Effects of TIMP-2 gene transfection on biological behaviors of a metastatic human lung carcinoma cell line Li Hongmei, Fang Weigang, Shi Zheng, et al. Department of Pathology, Beijing Medical University, Beijing 100083
Objectives To explore the suppressive effects of tissue inhibitor of metalloproteinase 2 (TIMP-2) on malignant phenotype of human carcinoma cells and to evaluate its potential application in cancer gene therapy. Methods A mammalian expression vector containing TIMP-2 cDNA was constructed and transfected into a metastatic human lung carcinoma cell line PG. In vitro and in vivo tests such as Northern blotting, immunohistochemistry as well as x enografting in nude mice experiment were used to analyse expression levels of TIMPs and MMPs, in vitro and in vivo behaviors of the tumor cells before and after the gene transfection. Results After transfection, the TIMP-2 mRNA expression was upregulated significantly. Changes in some malignant phenotypes of the transfectants were seen. For instance, the abilities of in vitro invasion through Matrigel, colony formation on soft agar, tumorigenecity as well as spontaneous metastasis in nude mice were remarkably decreased. Immunohistochemical staining and in situ hybrydization showed that MMP2, MMP9, TIMP-1 and TIMP-2 were expressed by both tumor cells and stromal cells, with stronger staining at the site of tumor invasion. Conclusion Up-regulation of TIMP-2 in tumor cells could suppress their expression of malignant phenotype and could be used for cancer therapy.
, 百拇医药
Key words Metalloproteinases Neoplasm metastasis
(Natl Med J China, 1997,77:652-656)
金属蛋白酶(MMPs)和金属蛋白酶组织抑制因子(TIMPs)之间的相互作用及平衡状态是恶性肿瘤侵袭转移分子生物学机制中的重要环节,已成为当前癌转移研究的热点[1]。我们将TIMP-2基因转入高转移性人肿瘤细胞株,观察TIMP-2表达增强对肿瘤细胞生物学行为的影响,进而探讨MMPs和TIMPs与肿瘤恶性表型表达的相关性及其在恶性肿瘤基因治疗上的意义。
材料与方法
一、细胞培养
PG细胞为人巨细胞肺癌,由本实验室建立[2],用含10%热灭活新鲜小牛血清的RPMI 1640培养液于37℃,5% CO2条件下培养。
, 百拇医药
二、真核表达载体构建与基因转染
pcDNA3(美国Vector公司产品)是在巨细胞病毒(CMV)启动子调控下的真核表达载体,含有EcoRI/XbaI多克隆位点。人全长TIMP-2 cDNA用EcoRI和XbaI双酶从原核载体pGEM-1(加拿大多伦多大学Mac Dougall博士惠赠)上切下,用T4 DNA连接酶正向插入pcDNA3表达载体的EcoRI/XbaI多克隆位点之间,以重组载体转化JM109大肠杆菌,筛选阳性克隆,并用EcoRI/XbaI双酶切鉴定。基因转染用脂质体Lipofecta MINE(美国GIBCOBRL公司产品),根据制造商推荐方法进行。
三、RNA杂交分析
细胞RNA提取采用异硫氰酸胍一步法。α-32P-DNA探针标记采用美国Promega公司提供的随机引物标记试剂盒。Northern印记杂交方法参照文献[3]。
, 百拇医药
四、蛋白酶活性分析
在原方法基础上加以改进[4]。条件培养基的制备:对数生长期细胞计数后接种于6孔培养板中,常规培养24小时后弃上清,以无血清RPMI 1640再培养24小时,收集上清液,以Centricon浓缩柱(美国Amicon公司)离心浓缩6倍,-70℃保存备用。配制10% SDS聚丙烯酰胺凝胶(含1.0 mg/ml明胶),每个待测样品以20 μl上样,电泳后凝胶于2.5% Triton X-100中浸泡3小时,在Tris-HCl缓冲液37℃孵育过夜,考马斯亮蓝R250染色,乙酸∶甲醇∶水(1∶3∶6)脱色,干燥封胶。
五、体外生长实验
1.生长曲线测定:细胞起始浓度为1×105/瓶,每24小时分别取3瓶消化计数,取平均值,共8天,绘制生长曲线。
2.MTT掺入法:细胞1×104/孔接种于96孔板中,培养8天,每孔加入20 μl MTT液(5 mg/ml溶于生理盐水),4小时后弃上清液,加入二甲基亚砜150 μl/孔,37℃避光摇动10分钟,30分钟内ELISA读板机于波长570 nm测定光密度,每种细胞至少做4个平行孔。
, 百拇医药
3.3H-TdR掺入实验:1×104/孔细胞接种于96孔板中,培养36~48小时,加入3H-TdR(中国科学院原子能研究所)37 kBq/孔,培养4~6小时,收集细胞于玻璃纤维滤纸上,烤干,用液闪计数仪测定3H-TdR掺入量。
六、软琼脂集落形成实验
用含0.6%琼脂及10%胎牛血清的DMEM培养基铺低层,凝固后,用含0.3%琼脂及10%胎牛血清的DMEM培养基铺上层,其中加入0.2 ml细胞悬液(2×103细胞)混匀,培养2周,显微镜下集落计数,每组设3个平行样本。
七、体外侵袭实验
NIH 3T3细胞培养液上清作为趋化因子,Boyden小室上下室之间用孔径8 μm的无PVP聚碳酸酯膜(美国Neuro Probe公司)分开,在膜上铺50 μl 1∶1稀释的人工基底膜(Matrigel美国Collaborative Res公司),上室内加入细胞悬液,常规培养6小时,显微镜下计穿膜的细胞数。每组设3个平行样本[5]。
, 百拇医药
八、裸鼠异种接种及自发转移实验
取BALB/C裸小鼠,每只背部皮下注射1×106细胞,自接种日起观察9周,记录一般状况及成瘤情况,9周后统一处死,取肿瘤测大小并详尽解剖,取所有脏器、体表及纵隔淋巴结,常规固定切片染色,显微镜下观察。
九、免疫组织化学染色
小鼠抗人MMP-2、MMP-9、TIMP-1和TIMP-2单克隆抗体,美国Oncogen science公司生产,采用SP法对冰冻切片进行染色,LSAB试剂盒为丹麦DAKO公司生产。
十、原位杂交分析
cDNA探针标记采用PCR掺入法,地高辛-dUTP及地高辛抗体均为德国BM公司产品。杂交液(探针400 mg/ml,50%甲酰胺,鲑精DNA 10 mg/L,1×Denhardt's液,2×SSC)95℃变性5分钟,冰水骤冷,每张冰冻切片滴加25 ml杂交液,42℃杂交18小时后显色。
, http://www.100md.com
结果
一、TIMP-2高表达阳性细胞克隆的分离
pcDNA3-TIMP-2重组载体构建成功后用脂质体法转染PG细胞,500 μg/ml G418连续筛选2周后可见抗药性细胞形成小集落,4周左右克隆明显可辨,随机挑取TIMP-2转染克隆18株,同时挑取pcDNA3空载体转染克隆6株。经Northern印记杂交鉴定分析,将表达TIMP-2基因最高的pcDNA3-TIMP-2转染克隆L2-2-4、L2-4-4、L2-11-5用于进一步分析。Northern印记杂交分析发现,PG及各转染克隆中均有TIMP-2基因表达,但L2-2-4、L2-4-4、L2-11-5的表达量明显高于PG细胞和空载体转染对照细胞PC-5(图1)。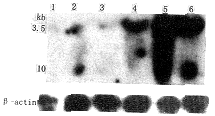
1:PG细胞;3:PC-5细胞;2、4、5及6:分别为TIMP-2转染细胞L2-2-4、L2-4-4、L2-11-6及L2-11-5;3.5Kb及1.0Kb杂交带为TIMP-2基因;β-actin为内参照
, 百拇医药
图1 Northern杂交分析
二、转染细胞的体内外生物学行为
1.形态学:转染细胞体积变大,突起变长,呈明显叠落生长,贴壁较紧。
2.细胞增殖能力:如图2生长曲线所示,L2-2-4、L2-4-4、L2-11-5细胞生长速度快于对照组PG和PC-5细胞,且差异有显著意义(P<0.05)。对以上5种细胞分别用MTT法测活细胞数及3H-TdR法测DNA含量均提示:L2-2-4、L2-4-4、L2-11-5细胞的增殖强于对照组PG和PC-5细胞,且差异有显著意义(P<0.05)。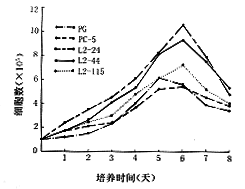
图2 生长曲线
3.软琼脂集落形成能力:常规软琼脂培养2周后,TIMP-2基因转染细胞软琼脂集落形成数低于对照组PG和PC-5细胞。
, http://www.100md.com
4.体外侵袭实验:L2-2-4、L2-4-4、L2-11-5细胞穿越Matrigel的细胞数分别为:48±17,26±10和20±10,明显低于PG和PC-5细胞(分别为230±71和182±24),且差异有显著意义(P<0.05)。
5.裸鼠体内成瘤性和自发转移能力比较:PG细胞成瘤率为6/6,潜伏期短,瘤体大,有明显出血坏死,淋巴结转移率为5/6,肺转移率3/6,TIMP-2转染细胞成瘤率(10/18)和转移率(淋巴结5/18、肺2/18)均明显低于PG和PC-5(附表)。
附表 TIMP-2基因转染前后肿瘤细胞在裸鼠体内成瘤情况及转移能力 细胞
裸鼠数
成瘤率
淋巴结转移
, http://www.100md.com 肺转移
PG
6
6/6
5/6
3/6
PC-5
6
5/6
3/6
3/6
L2-115
18
, http://www.100md.com 10/18
5/18
2/18
6.蛋白酶活性分析:在SDS-聚丙烯酰胺凝胶中加入明胶作为明胶酶的底物,用于检测细胞条件培养基中的明胶酶(MMP-2和MMP-9),电泳后凝胶经复性处理,使酶充分发挥其活性,再用考马斯亮蓝染色,胶中未着色区域表明有明胶酶的存在。在电泳条件下明胶酶-TIMP复合体会自动解体,并且明胶酶原也发生自动活化,因而酶原及活化形式的明胶酶均能检测到。如图3示,转染细胞L2-2-4、L2-4-4、L2-11-5和PG细胞及空载体转染细胞PC-5的培养液中,均有MMP-2(分子量为72 000,明胶酶A)和MMP-9(分子量为92 000,明胶酶B)的存在,并以MMP-2为主,转染细胞和对照细胞之间未见明显差别。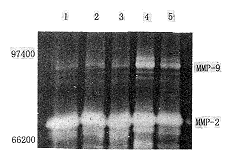
, 百拇医药 1~3:分别代表TIMP-2转染细胞L2-44,L2-24,L2-115;4:PC-5细胞;5:PG细胞
图3 蛋白酶活性分析
三、原位杂交和免疫组织化学
取TIMP-2基因转染前后PG细胞之裸鼠皮下移植瘤切片,进行MMP-2、MMP-9和TIMP-1、TIMP-2免疫组织化学及MMP-2、TIMP-2原位杂交分析,发现MMPs和TIMPs在肿瘤细胞及间质细胞均有表达,且间质细胞强于肿瘤细胞,表达阳性的肿瘤细胞主要位于浸润前沿靠近间质处,转染前后未见明显差异。
讨论
大量研究证实,肿瘤侵袭转移的潜能与其产生或诱导产生MMPs的能力有密切关系,TIMP以1∶1的共价形式与激活状态的MMP结合并抑制其活性,因而被看成是一类肿瘤转移抑制因子[6]。我们曾将TIMP-1 cDNA转入高转移性人巨细胞肺癌细胞PG,明显抑制了其侵袭转移能力[7]。随着研究的深入,发现TIMP-2较TIMP-1有着更广泛更强的生物学活性,故而本实验试图将TIMP-
, 百拇医药
2 cDNA转入PG细胞,来研究TIMP-2的抑癌机理。结果表明转染细胞具有较高的TIMP-2表达水平,其体外侵袭能力、软琼脂集落形成能力及裸鼠体内的转移性和成瘤性均受到不同程度的抑制。但蛋白酶活性分析表明,转染细胞的MMP-2和MMP-9表达及活性无明显改变,提示,以上各种生物学行为的改变并非由MMP产生减少所致,很可能是由于TIMP和MMP之间相互作用的结果。
有研究表明TIMP除了蛋白酶抑制功能外,还是多种细胞,包括人血管平滑肌细胞、皮肤上皮细胞、造血红细胞等细胞的生长刺激因子[8]。本研究发现,TIMP-2基因转染的PG细胞体外增殖能力增强,但体内成瘤能力下降,从表面看似乎矛盾,其实正好从一个方面提示TIMP-2在体内的生物学作用还受到其它因素的调节。TIMP的生长刺激活性和蛋白酶抑制功能的关系及其在肿瘤侵袭转移过程中的具体作用机制,目前尚不十分清楚,但Stetler-Stevenson等[6]提出,这两个功能区位于TIMP蛋白分子的不同部位,从而可接受不同机制的调节。
, 百拇医药
在不同的肿瘤,MMP/TIMP来源于不同的细胞,瘤细胞和宿主间质细胞可分别表达或共同表达[9]。我们发现,在PG细胞的裸鼠皮下移植瘤,MMPs和TIMPs在肿瘤细胞和间质细胞均有表达,表达阳性的肿瘤细胞主要位于浸润前沿与间质交界处。膜型金属蛋白酶(MT-MMP)是一类新型的MMP,不同于其它的MMP,在其羧基端有一段穿膜区,使其表达于细胞膜上。Sato等[10]研究表明,MT-MMP是MMP前体的特异性活化因子,主要表达在癌巢侵袭前沿的肿瘤细胞表面,而MMP蛋白酶原则由肿瘤间质细胞产生,其活化需要结合于肿瘤细胞表面的MT-MMP,这样MT-MMP通过活化间质细胞分泌的MMP前体,促进基质的降解。在我们的研究模型中,MT-MMP的存在及其作用还有待进一步研究。
总之,经TIMP-2基因转染特异性上调肿瘤细胞TIMP-2的表达,改变MMP和TIMP之间的平衡,对肿瘤细胞的多项生物学行为可产生显著影响,在一定程度上逆转肿瘤细胞的恶性表型,对肿瘤的基因治疗具有重要意义。
, 百拇医药
本课题为国家自然科学基金及国家教委跨世纪优秀人才计划基金资助项目
参考文献
1 Liotta LA, Stetler-Stevenson WG. Tumor invasion and metastasis: an imbalance of positive and negative regulation. Cancer Res, 1991,51(Suppl):5054.
2 吴秉铨,孙毓恺,郑 杰,等.裸鼠体内建立的人类高转移癌系.中华肿瘤学杂志,1985,7:324.
3 萨姆布鲁克,弗里奇,曼尼阿蒂斯.分子克隆实验指导.第二版,北京:科学出版社.1992,24-372.
4 Kleiner DE, Stetler-Stevenson WG. Quantitive zymography: detection of picogram quantities of gelatinase. Anal Biochem, 1994,21:325.
, 百拇医药
5 Albini A, Iwamoto Y, Kleinman HK, et al. A rapid in vitro assay for quantiating the invasion potential of tumor cells. Cancer Res, 1987,49:3239.
6 Stetler-Stevenson WG, Liotta LA, Kleiner DE. Extracellular matrix Role of matrix metalloproteinase in tumor invasion and metastasis. The FASEB Journal, 1993,7:1434.
7 周可祥,吴秉铨,郑 杰,等.TIMP-1基因转染对人肺巨细胞癌系生物学行为的影响.中华医学杂志,1994,74:402.
8 Nemeth JA, Goolsby CL. TIMP-2, a growth-stimulatory protein from SV40-transformed human fibroblasts. Exp Cell Res, 1993,207:376.
, 百拇医药
9 Yoshiji H, Gomez DE and Thorgeirsson UP. Enhanced RNA expression of tissue inhibitor of metalloproteinase-1 (TIMP-1) in human breast cancer. Int J Cancer, 1996,69:131.
10 Sato H, Takino T, Okada Y, et al. A matrix metalloproteinase expressed on the surface of invasive tumor cells. Nature, 1994,370:61.
(收稿:1997-03-24 修回:1997-06-05), 百拇医药
单位:100083 北京医科大学病理学系
关键词:金属蛋白酶类;肿瘤转移
中华医学杂志970906 目的 探讨金属蛋白酶组织抑制因子TIMP-2对肿瘤恶性表型的逆转作用及其在肿瘤基因治疗上的意义。方法 利用基因重组技术构建了含全长TIMP-2 cDNA的真核表达载体,用脂质体法转染高转移性人肺癌细胞(PG),检测转染后PG细胞的金属蛋白酶(MMPs)活性、体外侵袭、裸鼠体内成瘤性及转移能力等多项生物学行为的变化。并以TIMP-2基因转染前后PG细胞的裸鼠皮下移植瘤为研究对象,利用免疫组织化学和原位杂交方法,研究在整体环境下MMP-2、MMP-9和TIMP-1、TIMP-2的mRNA及蛋白表达情况。结果 转染细胞较母系细胞TIMP-2 mRNA表达增强,MMP-2、MMP-9的产生及活性无明显变化,体外增殖能力增强,但体外侵袭和软琼脂集落形成能力以及裸鼠体内成瘤性及自发转移能力下降。此外,MMP-2、MMP-9和TIMP-1、TIMP-2在PG细胞之裸鼠皮下移植瘤的间质细胞及肿瘤细胞均有表达,阳性的肿瘤细胞主要位于肿瘤和间质交界处。结论 特异性上调TIMP-2基因的表达可在一定程度上逆转PG细胞的恶性表型。
, 百拇医药
Effects of TIMP-2 gene transfection on biological behaviors of a metastatic human lung carcinoma cell line Li Hongmei, Fang Weigang, Shi Zheng, et al. Department of Pathology, Beijing Medical University, Beijing 100083
Objectives To explore the suppressive effects of tissue inhibitor of metalloproteinase 2 (TIMP-2) on malignant phenotype of human carcinoma cells and to evaluate its potential application in cancer gene therapy. Methods A mammalian expression vector containing TIMP-2 cDNA was constructed and transfected into a metastatic human lung carcinoma cell line PG. In vitro and in vivo tests such as Northern blotting, immunohistochemistry as well as x enografting in nude mice experiment were used to analyse expression levels of TIMPs and MMPs, in vitro and in vivo behaviors of the tumor cells before and after the gene transfection. Results After transfection, the TIMP-2 mRNA expression was upregulated significantly. Changes in some malignant phenotypes of the transfectants were seen. For instance, the abilities of in vitro invasion through Matrigel, colony formation on soft agar, tumorigenecity as well as spontaneous metastasis in nude mice were remarkably decreased. Immunohistochemical staining and in situ hybrydization showed that MMP2, MMP9, TIMP-1 and TIMP-2 were expressed by both tumor cells and stromal cells, with stronger staining at the site of tumor invasion. Conclusion Up-regulation of TIMP-2 in tumor cells could suppress their expression of malignant phenotype and could be used for cancer therapy.
, 百拇医药
Key words Metalloproteinases Neoplasm metastasis
(Natl Med J China, 1997,77:652-656)
金属蛋白酶(MMPs)和金属蛋白酶组织抑制因子(TIMPs)之间的相互作用及平衡状态是恶性肿瘤侵袭转移分子生物学机制中的重要环节,已成为当前癌转移研究的热点[1]。我们将TIMP-2基因转入高转移性人肿瘤细胞株,观察TIMP-2表达增强对肿瘤细胞生物学行为的影响,进而探讨MMPs和TIMPs与肿瘤恶性表型表达的相关性及其在恶性肿瘤基因治疗上的意义。
材料与方法
一、细胞培养
PG细胞为人巨细胞肺癌,由本实验室建立[2],用含10%热灭活新鲜小牛血清的RPMI 1640培养液于37℃,5% CO2条件下培养。
, 百拇医药
二、真核表达载体构建与基因转染
pcDNA3(美国Vector公司产品)是在巨细胞病毒(CMV)启动子调控下的真核表达载体,含有EcoRI/XbaI多克隆位点。人全长TIMP-2 cDNA用EcoRI和XbaI双酶从原核载体pGEM-1(加拿大多伦多大学Mac Dougall博士惠赠)上切下,用T4 DNA连接酶正向插入pcDNA3表达载体的EcoRI/XbaI多克隆位点之间,以重组载体转化JM109大肠杆菌,筛选阳性克隆,并用EcoRI/XbaI双酶切鉴定。基因转染用脂质体Lipofecta MINE(美国GIBCOBRL公司产品),根据制造商推荐方法进行。
三、RNA杂交分析
细胞RNA提取采用异硫氰酸胍一步法。α-32P-DNA探针标记采用美国Promega公司提供的随机引物标记试剂盒。Northern印记杂交方法参照文献[3]。
, 百拇医药
四、蛋白酶活性分析
在原方法基础上加以改进[4]。条件培养基的制备:对数生长期细胞计数后接种于6孔培养板中,常规培养24小时后弃上清,以无血清RPMI 1640再培养24小时,收集上清液,以Centricon浓缩柱(美国Amicon公司)离心浓缩6倍,-70℃保存备用。配制10% SDS聚丙烯酰胺凝胶(含1.0 mg/ml明胶),每个待测样品以20 μl上样,电泳后凝胶于2.5% Triton X-100中浸泡3小时,在Tris-HCl缓冲液37℃孵育过夜,考马斯亮蓝R250染色,乙酸∶甲醇∶水(1∶3∶6)脱色,干燥封胶。
五、体外生长实验
1.生长曲线测定:细胞起始浓度为1×105/瓶,每24小时分别取3瓶消化计数,取平均值,共8天,绘制生长曲线。
2.MTT掺入法:细胞1×104/孔接种于96孔板中,培养8天,每孔加入20 μl MTT液(5 mg/ml溶于生理盐水),4小时后弃上清液,加入二甲基亚砜150 μl/孔,37℃避光摇动10分钟,30分钟内ELISA读板机于波长570 nm测定光密度,每种细胞至少做4个平行孔。
, 百拇医药
3.3H-TdR掺入实验:1×104/孔细胞接种于96孔板中,培养36~48小时,加入3H-TdR(中国科学院原子能研究所)37 kBq/孔,培养4~6小时,收集细胞于玻璃纤维滤纸上,烤干,用液闪计数仪测定3H-TdR掺入量。
六、软琼脂集落形成实验
用含0.6%琼脂及10%胎牛血清的DMEM培养基铺低层,凝固后,用含0.3%琼脂及10%胎牛血清的DMEM培养基铺上层,其中加入0.2 ml细胞悬液(2×103细胞)混匀,培养2周,显微镜下集落计数,每组设3个平行样本。
七、体外侵袭实验
NIH 3T3细胞培养液上清作为趋化因子,Boyden小室上下室之间用孔径8 μm的无PVP聚碳酸酯膜(美国Neuro Probe公司)分开,在膜上铺50 μl 1∶1稀释的人工基底膜(Matrigel美国Collaborative Res公司),上室内加入细胞悬液,常规培养6小时,显微镜下计穿膜的细胞数。每组设3个平行样本[5]。
, 百拇医药
八、裸鼠异种接种及自发转移实验
取BALB/C裸小鼠,每只背部皮下注射1×106细胞,自接种日起观察9周,记录一般状况及成瘤情况,9周后统一处死,取肿瘤测大小并详尽解剖,取所有脏器、体表及纵隔淋巴结,常规固定切片染色,显微镜下观察。
九、免疫组织化学染色
小鼠抗人MMP-2、MMP-9、TIMP-1和TIMP-2单克隆抗体,美国Oncogen science公司生产,采用SP法对冰冻切片进行染色,LSAB试剂盒为丹麦DAKO公司生产。
十、原位杂交分析
cDNA探针标记采用PCR掺入法,地高辛-dUTP及地高辛抗体均为德国BM公司产品。杂交液(探针400 mg/ml,50%甲酰胺,鲑精DNA 10 mg/L,1×Denhardt's液,2×SSC)95℃变性5分钟,冰水骤冷,每张冰冻切片滴加25 ml杂交液,42℃杂交18小时后显色。
, http://www.100md.com
结果
一、TIMP-2高表达阳性细胞克隆的分离
pcDNA3-TIMP-2重组载体构建成功后用脂质体法转染PG细胞,500 μg/ml G418连续筛选2周后可见抗药性细胞形成小集落,4周左右克隆明显可辨,随机挑取TIMP-2转染克隆18株,同时挑取pcDNA3空载体转染克隆6株。经Northern印记杂交鉴定分析,将表达TIMP-2基因最高的pcDNA3-TIMP-2转染克隆L2-2-4、L2-4-4、L2-11-5用于进一步分析。Northern印记杂交分析发现,PG及各转染克隆中均有TIMP-2基因表达,但L2-2-4、L2-4-4、L2-11-5的表达量明显高于PG细胞和空载体转染对照细胞PC-5(图1)。

1:PG细胞;3:PC-5细胞;2、4、5及6:分别为TIMP-2转染细胞L2-2-4、L2-4-4、L2-11-6及L2-11-5;3.5Kb及1.0Kb杂交带为TIMP-2基因;β-actin为内参照
, 百拇医药
图1 Northern杂交分析
二、转染细胞的体内外生物学行为
1.形态学:转染细胞体积变大,突起变长,呈明显叠落生长,贴壁较紧。
2.细胞增殖能力:如图2生长曲线所示,L2-2-4、L2-4-4、L2-11-5细胞生长速度快于对照组PG和PC-5细胞,且差异有显著意义(P<0.05)。对以上5种细胞分别用MTT法测活细胞数及3H-TdR法测DNA含量均提示:L2-2-4、L2-4-4、L2-11-5细胞的增殖强于对照组PG和PC-5细胞,且差异有显著意义(P<0.05)。

图2 生长曲线
3.软琼脂集落形成能力:常规软琼脂培养2周后,TIMP-2基因转染细胞软琼脂集落形成数低于对照组PG和PC-5细胞。
, http://www.100md.com
4.体外侵袭实验:L2-2-4、L2-4-4、L2-11-5细胞穿越Matrigel的细胞数分别为:48±17,26±10和20±10,明显低于PG和PC-5细胞(分别为230±71和182±24),且差异有显著意义(P<0.05)。
5.裸鼠体内成瘤性和自发转移能力比较:PG细胞成瘤率为6/6,潜伏期短,瘤体大,有明显出血坏死,淋巴结转移率为5/6,肺转移率3/6,TIMP-2转染细胞成瘤率(10/18)和转移率(淋巴结5/18、肺2/18)均明显低于PG和PC-5(附表)。
附表 TIMP-2基因转染前后肿瘤细胞在裸鼠体内成瘤情况及转移能力 细胞
裸鼠数
成瘤率
淋巴结转移
, http://www.100md.com 肺转移
PG
6
6/6
5/6
3/6
PC-5
6
5/6
3/6
3/6
L2-115
18
, http://www.100md.com 10/18
5/18
2/18
6.蛋白酶活性分析:在SDS-聚丙烯酰胺凝胶中加入明胶作为明胶酶的底物,用于检测细胞条件培养基中的明胶酶(MMP-2和MMP-9),电泳后凝胶经复性处理,使酶充分发挥其活性,再用考马斯亮蓝染色,胶中未着色区域表明有明胶酶的存在。在电泳条件下明胶酶-TIMP复合体会自动解体,并且明胶酶原也发生自动活化,因而酶原及活化形式的明胶酶均能检测到。如图3示,转染细胞L2-2-4、L2-4-4、L2-11-5和PG细胞及空载体转染细胞PC-5的培养液中,均有MMP-2(分子量为72 000,明胶酶A)和MMP-9(分子量为92 000,明胶酶B)的存在,并以MMP-2为主,转染细胞和对照细胞之间未见明显差别。

, 百拇医药 1~3:分别代表TIMP-2转染细胞L2-44,L2-24,L2-115;4:PC-5细胞;5:PG细胞
图3 蛋白酶活性分析
三、原位杂交和免疫组织化学
取TIMP-2基因转染前后PG细胞之裸鼠皮下移植瘤切片,进行MMP-2、MMP-9和TIMP-1、TIMP-2免疫组织化学及MMP-2、TIMP-2原位杂交分析,发现MMPs和TIMPs在肿瘤细胞及间质细胞均有表达,且间质细胞强于肿瘤细胞,表达阳性的肿瘤细胞主要位于浸润前沿靠近间质处,转染前后未见明显差异。
讨论
大量研究证实,肿瘤侵袭转移的潜能与其产生或诱导产生MMPs的能力有密切关系,TIMP以1∶1的共价形式与激活状态的MMP结合并抑制其活性,因而被看成是一类肿瘤转移抑制因子[6]。我们曾将TIMP-1 cDNA转入高转移性人巨细胞肺癌细胞PG,明显抑制了其侵袭转移能力[7]。随着研究的深入,发现TIMP-2较TIMP-1有着更广泛更强的生物学活性,故而本实验试图将TIMP-
, 百拇医药
2 cDNA转入PG细胞,来研究TIMP-2的抑癌机理。结果表明转染细胞具有较高的TIMP-2表达水平,其体外侵袭能力、软琼脂集落形成能力及裸鼠体内的转移性和成瘤性均受到不同程度的抑制。但蛋白酶活性分析表明,转染细胞的MMP-2和MMP-9表达及活性无明显改变,提示,以上各种生物学行为的改变并非由MMP产生减少所致,很可能是由于TIMP和MMP之间相互作用的结果。
有研究表明TIMP除了蛋白酶抑制功能外,还是多种细胞,包括人血管平滑肌细胞、皮肤上皮细胞、造血红细胞等细胞的生长刺激因子[8]。本研究发现,TIMP-2基因转染的PG细胞体外增殖能力增强,但体内成瘤能力下降,从表面看似乎矛盾,其实正好从一个方面提示TIMP-2在体内的生物学作用还受到其它因素的调节。TIMP的生长刺激活性和蛋白酶抑制功能的关系及其在肿瘤侵袭转移过程中的具体作用机制,目前尚不十分清楚,但Stetler-Stevenson等[6]提出,这两个功能区位于TIMP蛋白分子的不同部位,从而可接受不同机制的调节。
, 百拇医药
在不同的肿瘤,MMP/TIMP来源于不同的细胞,瘤细胞和宿主间质细胞可分别表达或共同表达[9]。我们发现,在PG细胞的裸鼠皮下移植瘤,MMPs和TIMPs在肿瘤细胞和间质细胞均有表达,表达阳性的肿瘤细胞主要位于浸润前沿与间质交界处。膜型金属蛋白酶(MT-MMP)是一类新型的MMP,不同于其它的MMP,在其羧基端有一段穿膜区,使其表达于细胞膜上。Sato等[10]研究表明,MT-MMP是MMP前体的特异性活化因子,主要表达在癌巢侵袭前沿的肿瘤细胞表面,而MMP蛋白酶原则由肿瘤间质细胞产生,其活化需要结合于肿瘤细胞表面的MT-MMP,这样MT-MMP通过活化间质细胞分泌的MMP前体,促进基质的降解。在我们的研究模型中,MT-MMP的存在及其作用还有待进一步研究。
总之,经TIMP-2基因转染特异性上调肿瘤细胞TIMP-2的表达,改变MMP和TIMP之间的平衡,对肿瘤细胞的多项生物学行为可产生显著影响,在一定程度上逆转肿瘤细胞的恶性表型,对肿瘤的基因治疗具有重要意义。
, 百拇医药
本课题为国家自然科学基金及国家教委跨世纪优秀人才计划基金资助项目
参考文献
1 Liotta LA, Stetler-Stevenson WG. Tumor invasion and metastasis: an imbalance of positive and negative regulation. Cancer Res, 1991,51(Suppl):5054.
2 吴秉铨,孙毓恺,郑 杰,等.裸鼠体内建立的人类高转移癌系.中华肿瘤学杂志,1985,7:324.
3 萨姆布鲁克,弗里奇,曼尼阿蒂斯.分子克隆实验指导.第二版,北京:科学出版社.1992,24-372.
4 Kleiner DE, Stetler-Stevenson WG. Quantitive zymography: detection of picogram quantities of gelatinase. Anal Biochem, 1994,21:325.
, 百拇医药
5 Albini A, Iwamoto Y, Kleinman HK, et al. A rapid in vitro assay for quantiating the invasion potential of tumor cells. Cancer Res, 1987,49:3239.
6 Stetler-Stevenson WG, Liotta LA, Kleiner DE. Extracellular matrix Role of matrix metalloproteinase in tumor invasion and metastasis. The FASEB Journal, 1993,7:1434.
7 周可祥,吴秉铨,郑 杰,等.TIMP-1基因转染对人肺巨细胞癌系生物学行为的影响.中华医学杂志,1994,74:402.
8 Nemeth JA, Goolsby CL. TIMP-2, a growth-stimulatory protein from SV40-transformed human fibroblasts. Exp Cell Res, 1993,207:376.
, 百拇医药
9 Yoshiji H, Gomez DE and Thorgeirsson UP. Enhanced RNA expression of tissue inhibitor of metalloproteinase-1 (TIMP-1) in human breast cancer. Int J Cancer, 1996,69:131.
10 Sato H, Takino T, Okada Y, et al. A matrix metalloproteinase expressed on the surface of invasive tumor cells. Nature, 1994,370:61.
(收稿:1997-03-24 修回:1997-06-05), 百拇医药