腺病毒伴随病毒载体介导的I型单纯疱疹病毒胸苷激酶基因转移及其杀肿瘤效应
作者:姚二梅 冯泽华 吴小兵 颜子颖 侯云德
单位:100052 北京 中国预防医学科学院病毒学研究所病毒基因工程国家重点实验室
关键词:重组腺病毒伴随病毒;胸苷激酶基因;I型单纯疱疹病毒;基因转移
中华实验和临床病毒学杂志980303 【摘要】 目的 研究腺病毒伴随病毒(AAV)载体介导杀肿瘤基因的转移及其在肿瘤治疗方面的应用。方法 应用作者构建的腺病毒伴随病毒载体,克隆I型单纯疱疹病毒胸苷激酶(HSVI-TK)基因,构建质粒pACTK-19。用pACTK-19转染5型腺病毒(Ad5)感染的重组AAV包装细胞系AE1201,获得重组病毒rAAV/ACTK。再用此重组病毒感染肺癌细胞系A549,并联合丙氧鸟苷(GCV)作用,研究其体外对肺癌细胞的杀伤作用。结果 重组rAAC/ACTK的滴度为3.4×105CFU/ml,感染肺癌细胞系A549,实现了TK基因的转移及与细胞染色体的整合和表达,对A549细胞具有杀伤作用。结论 腺病毒伴随病毒载体能成功地实施对肺癌细胞系A549的基因转移和介导杀肿瘤效应。
, http://www.100md.com
Adeno-associated virus vector mediated gene transfer of HSVI-TK and its effect on killing cancer cell Yao Ermei,Feng Zehua, Wu Xiao bing,et al. National Lab of Molecular Virology and Genetic Engineering, Beijing 100052
Abstract The plasmid pACTK-19 was constructed by insering HSVI-TK gene into the multiple cloning sites of the general adeno-associated virus(AAV)vector pACR-Neo.When plasmid pACTK-19 was transfected to recombinant AAV's packaging cell line AE1201,which was exposed to Adenovirus 5 for two hours before transfection,we got rAAV/ACTK at the titer of 3.4×105 CFU/ml.After infecting human lung cancer cell A549 with rAAV/ACTK,we extracted host cell's chromosome cDNA and amplified part of the HSVI-TK sequence by a pair of HSVI-TK's primers and then hybridized to digoxin labelled HSVI-TK gene probe.We got corresponding positive band and it proved the integration of HSVI-TK into host cell's choromosome cDNA.By reverse transcripting rAAV/ACR-Neo infected A549 total cell RNA, we amplified part of HSVI-TK sequence and hybridized to Neo gene probe.The corresponding positive band demonstraed the expression of HSVI-TK.So through rAAV/ACTK,HSVI-TK was transfered into host cells and was expressed in them,the rAAV's genome was integrated into host cell's choromosome DNA.Connecting with Ganciclovir (GCV),the HSVI-TK gene transfer mediated by rAAV/ACTK,could inhibit the synthesis of choromosome DNA and lead to the killing of the lung cancer cell. This work proved that recombinant AAV could be used as vector for gene transduction to cancer cell,and also laid foundation for further research and application of AAV vector.
, http://www.100md.com
Key words: Recombinant adeno-associated virus HSVI-TK gene Gene transfer
腺病毒伴随病毒(AAV)在病毒分类学上属细小病毒科依赖性病毒属,是一种缺陷病毒,其复制必须依赖于辅助病毒。它是迄今为止所发现的人类病毒中,唯一与人类疾病无任何相关性的病毒,也是唯一能将其基因组定点整合到宿主细胞染色体上的病毒。这些性质赋予AAV作为基因治疗载体时安全性的特点,从而成为人们发展AAV载体的主要原因。AAV载体的研究已受到基因治疗遗传学家的普遍关注,也取得了极大进展,有望用于遗传病、肿瘤和感染性疾病的基因治疗。目前,关于AAV载体应用的研究主要集中在遗传病的治疗方面〔1,2〕,对肿瘤的基因治疗研究,仅见一例用于体外杀伤肝癌细胞的报道〔3〕。我们用自行构建的重组AAV载体〔4〕介导TK基因的转移,并联合GCV药物治疗,观察其体外杀伤肺癌细胞的作用。
, http://www.100md.com
1 材料和方法
1.1 材料 质粒pTGCMV/HyTK和大肠杆菌DH5α由病毒基因工程国家重点实验室保存。载体质粒pACR-Neo和包装细胞系AE1201由作者构建〔4,5〕肺癌细胞系A549和5型人腺病毒株(Ad5)购自美国ATCC。潮霉素(Hygromycin B)购自德国Boehringer Mannheim公司,MTT购自Sigma公司,丙氧鸟苷(GCV)购自美国Syntax公司,碘化丙锭购自北京化学试剂厂,逆转录试剂盒购自美国Promega公司。其它试剂均同文献[5]。
1.2 DNA重组技术和分析方法 参照文献[6]进行。
1.3 真核细胞转染 参照真核细胞转染试剂Lipofectamine产品说明书进行。
1.4 重组AAV病毒的收获和滴定 参见文献[7]。
, http://www.100md.com
1.5 转HSVI-TK基因的A549细胞系的建立 用重组AAV病毒rAAV/ACTK感染人肺癌细胞A549细胞,加G418或潮霉素选择富集,胰酶消化,扩大培养后,置液氮中冻存备用。
1.6 HSVI-TK基因引物的设计和合成 根据文献〔8〕的HSVI-TK基因序列,设计了一对检测HSVI-TK基因的引物P1和P2,用来选择性扩增HSVI-TK基因编码区第544-938位核苷酸之间的片段(395bp),引物序列如下:P1,5′-GCGTCTGCGTTCGACCAGGC-3′;P2:5′-GGAGCCAGAACGGCGTCCGG-3′。引物的合成采用PE公司寡核苷酸合成仪进行,HPLC纯化,合成引物的最终浓度为25pmol/μl。
1.7 PCR-Southern杂交方法检测转导细胞中HSVI-TK基因的存在 HSVI-TK基因探针的Digoxin标记方法同文献[4]。其中模板DNA为AccⅠ酶切pTGCMV/HyTK质粒获得的920bp片段,该片段包括TK基因3′端在内的大部分编码区,也覆盖了引物P1,P2间区域。细胞染色体DNA提取方法参见文献[9],PCR反应体系和条件:染色体DNA1μl,10×PCR缓冲液5μl,2.5mmol/L dNTPs4μl,50pmmol/L引物P1、P2各2μl,Taq酶4U,补充水至50μl。94℃变性、60℃退火、73℃延伸各45秒,最后一个循环73℃延伸5分种,共30个循环。用pTGCMV/HyTK质粒DNA作PCR反应的阳性对照,用A549细胞DNA和pGEM-3Zf(+)质粒DNA作PCR反应的阴性对照。反应完成后,取10μl电泳,紫外灯下观察。Southern杂交方法同文献[4]。
, 百拇医药
1.8 RT-PCR Southern杂交检测转导细胞中HSVI-TK基因的表达 细胞总RNA的提取方法同文献[5]。反转录按试剂盒说明书进行。取细胞RNA 1μg,3′端引物1μl,2.5mmol/L dNTPs2μl,5×缓冲液4μl,RNasin 0.5μl,禽源性逆转录酶AMV1μl(10U/μl),补充DEPC水至20μl,42℃反应1小时。PCR反应和Southern杂交同上。
1.9 GCV对转导A549细胞的体外杀伤作用 细胞形态变化、不同剂量GCV对Hyr A549/ACTK细胞的杀伤作用参见文献[10],GCV对Hyr A549/ACTK细胞周期影响的流式细胞仪分析参见文献[11]。
2 结果
2.1 含HSVI-TK基因的AAV质粒载体pACTK-19的构建 用XhoⅠ和HindⅢ卸下质粒pTGCMV/HyTK中CMV启动子和HyTK基因,定向取代质粒pACR-Neo中的CMV-IE启动子部分,见图1。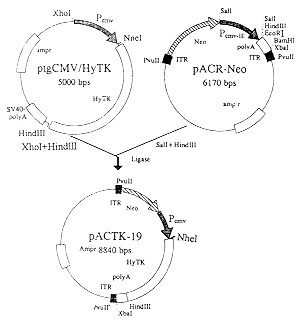
, http://www.100md.com
图 1 质粒pACTK-19的构建
Fig.1 Construction of plasmid pACTK-19
图 2 TK基因在重组AAV转导HyrA549/ACTK和G418rA549/ACTK细胞中的整合与表达分析
A:PCR与RT-PCR产物的琼脂糖凝胶电泳;B:PCR与RT-PCR产物的Southern杂交。1和14:DNA/HindⅢ;2,G418rA549/ACTK细胞总RNA的RT-PCR;3:HyrA549/ACTK细胞总RNA的RT-PCR;4:pGEM-3Zf(+);5,pTGCMV/HyTK/AccΙ的0.92kb片段;6:pGEM-3Zf(+)为模板的PCR;7:pTGCMV/HyTK为模板的PCR;8:A549细胞总RNA的RT-PCR;9和10:G418rA549/ACTK细胞染色体DNA的PCR;11:A549细胞染色体DNA的PCR;12和13:HyrA549/ACTK细胞染色体DNA的PCR
, http://www.100md.com
Fig.2 Integration and expression analysis of TK gene in recombinant AAV transducd HyrA549/ACTK and G418rA549/ACTK cells
A:analysis of products of PCR and RT-PCR through agarose gel electrophoresis;B:Southern blot hybridization of products of PCR and RT-PCR;1,14:λDNA/Hind Ⅲmarker;2:RT-PCR of totol RNA of G418r A549/ACTK;3:RT-PCR of total RNA of HyrA549/ACTK;4:pGEM-3Zf(+);5:pTGCMV/HyTK/AccΙfragment of 0.92kb;6:PCR of pGEM-3Zf(+);7:PCR of pTGCMV/HyTK;8:RT-PCR of total RNA of A549 cell;9,10:PCR of chromosomal cDNA of G418rA549 /ACTK;11:PCR of chromosomal DNA of A549 cell;12, 13:PCR of chromosomal DNA of HyrA549/ACTK
, 百拇医药
2.2 重组病毒rAAV/ACTK的收获和滴度测定 用质粒pACTK-19转染Ad5感染的包装细胞系AE1201,经一系列处理制备rAAV/ACTK病毒液。经测定其滴度为3.4×105 cfu/ml。
2.3 抗性细胞的获得 用rAAV/ACTK病毒感染A549细胞,48小时后,用潮霉素和G418分别加压筛选,2周后,长出抗性克隆,胰酶消化克隆灶,扩大培养,并分别命名为HyrA549/ACTK和G418rA549/ACTK细胞。
2.4 PCR-Southern杂交检测抗性细胞中TK基因 分别以HyrA549/ACTK和G418rA549/ACTK细胞染色体DNA作为模板,用P1和P2引物进行PCR扩增,扩增产物的琼脂糖凝胶电泳结果见图2A。用TK基因探针对其进行Southern杂交,结果见图2B。可见未转导的A549细胞染色体DNA其PCR扩增和Southern杂交结果均为阴性,而转导的HyrA549/ACTK和G418rA549/ACTK细胞染色体DNA均扩增出近400bp的阳性带,说明TK基因被整合到宿主细胞染色体上。
, 百拇医药
2.5 RT-PCR和Southern杂交检测抗性细胞中TK基因的转录 提取HyrA549/ACTK和G418rA549/ACTK细胞总RNA,经逆转录和PCR扩增,将其产物进行琼脂糖凝胶电泳,结果见图2A,为证明扩增产物的特异性,用Southern杂交实验检测,结果见图2B。可见未转导的A549细胞总RNA其RT-PCR和Southern杂交结果均为阴性,而转导的HyrA549/ACTK和G418rA549/ACTK细胞总RNA均扩增出近400bp的阳性带,其带形和大小均与染色体DNA扩增的结果一致,说明TK基因在转导细胞中发生了转录和表达。
2.6 GCV对HyrA549/ACTK细胞的体外杀伤作用
2.6.1 细胞形态观察 用20μmol/L GCV分别作用于A549细胞和Hyr A549/ACTK细胞,在倒置显微镜下进行活细胞观察,结果见图版ⅠA(封三)。图版ⅠA的B、C显示,GCV作用48~72小时后,Hyr A549/ACTK细胞大部分变大而扁平,细胞边缘模糊,细胞结构松散,形态不规则,核大而变圆,染色质致密,集结成团;少部分细胞变小变圆。5天后,Hyr A549/ACTK细胞全部漂浮死亡。A549细胞则无病变现象,5天后,细胞仍存活,仅仅是细胞更密集,发生堆集而已。说明GCV对HyrA549/ACTK细胞有明显地体外杀伤作用。
, 百拇医药
2.6.2 不同浓度GCV对HyrA 549/ACTK细胞的杀伤作用 A549细胞和Hyr A549/ACTK细胞培养24时小后,换成含不同浓度GCV的培养液(0~100μmol/L),再培养48小时,MTT比色法检测每孔细胞存活的情况。其中每一浓度GCV作用的细胞取3孔计算平均A值,细胞存活率用GCV各浓度平均A值除以相应对照孔平均A值所得百分率表示,结果见表1。可见,GCV在浓度很低时,就对HyrA549/ACTK细胞有明显的生长抑制作用,而对未转导的A549细胞则无抑制作用。
表 1 A549和HyrA549/ACTK细胞在不同浓度GCV作用48小时后的存活率(%)
Tab.1 Survival percentage of A549 and HyrA549/ACTK exposed to different concentrations of GCV for 48 hours 细胞
, http://www.100md.com
Cell
GCV浓度(μmol/L)
GCV concentration (μmol/L)
0
0.01
0.1
1
10
100
A549
100
102
102
, http://www.100md.com
103
102
101
HyrA549/ACTK
100
90
88
77
76
64
2.6.3 GCV杀伤HyrA549/ACTK细胞的流式细胞仪分析 20μmol/L GCV作用于HyrA549/ACTK细胞后,于0,24,48和72小时收细胞,经处理后,分别用流式细胞仪测定细胞群DNA含量分布,结果见图3。可以看出,随着时间的延长,细胞群DNA含量分布发生了明显的变化,0小时时,有明显的G2+M峰,加入GCV作用后,其G2+M峰不明显。比较各时间点细胞中G1,S和G2+M期细胞的比例,发现随着GCV作用时间的延长,G1期细胞比例相对减少,S期细胞比例明显增多,G2+M期细胞比例也减少且稳定在一个较低的水平上,见表2。这与HSVI-TK基因通过抑制细胞DNA合成(S期)而杀伤肿瘤细胞的机理是一致的。由此可见,重组病毒rAAV/ACTK成功地介导了HSVI-TK基因的转移。HSVI-TK基因联合GCV作用对A549肿瘤细胞有明显的抑制作用,并且这种作用预计发生在S期。
, 百拇医药
表 2 GCV作用于HyrA549/ACTK细胞不同时间各个细胞周期中的细胞比例(%)
Tab.2 Cell ratio of every cycling phase of HyrA549/ACTK cell when exposing to GCV for different times GCV作用时间(小时)
Exposing to GCV(hr)
细胞周期(%)
Cell cycling phase
G1
S
G2+M
, 百拇医药
0
48
40
12
24
50
48
2
48
35
62
3
72
22
, http://www.100md.com
76
2
3 讨论
HSVI-TK基因联合GCV作用杀伤肿瘤细胞的机理,是利用Ι型单纯疱疹病毒胸苷激酶对细胞胸苷激酶作用底物的广谱性,催化一些核苷类似物如丙氧鸟苷(Ganciclovir,GCV)等的磷酸化,而这些磷酸化产物能抑制细胞DNA聚合酶的活性,或者作为该酶的底物代替dGTP掺入到细胞DNA中,从而阻断了DNA合成,最终导致细胞死亡〔12〕。
我们用构建的载体质粒pACTK-19和包装细胞系AE1201获得了重组病毒rAAV/ACTK。此病毒感染人肺癌细胞系A549,经G418和潮霉素筛选均得到抗性克隆,对抗性细胞染色体DNA和总RNA进行PCR、RT-PCR和Southern杂交分析,表明TK基因整合在抗性细胞染色体上,并且获得了转录和表达。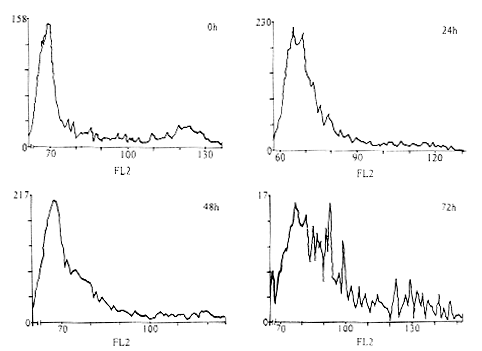
, 百拇医药
图 3 20μmol/L GCV作用HyrA549/ACTK细胞后不同时间的流式细胞仪分析
横坐标:荧光强度;纵坐标:相对细胞数
Fig.3 Flow cytometric analysis of HyrA549/ACTK cell exposed to 20μmol/L GCV for different times
Horizontal coordinate:fluorescence intensity.Vertical coordinate:relative cell number
在抗性细胞HyrA549/ACTK中加GCV,无论是对细胞形态的观察还是MTT法检测,都证明rAAV/ACTK转导的HSVI-TK基因抑制A549细胞生长,直至死亡。而未转导HSVI-TK基因的A549细胞对GCV作用不敏感。
, 百拇医药
关于AAV介导肿瘤自杀基因的转移和对细胞周期的影响,尚未见报道。我们用流式细胞仪检测HSVI-TK/GCV对细胞周期的影响,发现随着时间的延长,处于不同时期的细胞比例发生了明显变化,且变化现象与HSVI-TK诱导细胞自杀的机理的相一致的。这说明我们用重组AAV介导TK基因转移至肿瘤细胞是非常成功的,细胞有TK基因功能性产物表达,起到了抑制肿瘤细胞生长的作用。
重组AAV有希望成为基因治疗的良好载体除了具有非致病性、基因组能整合、在转导细胞中稳定表达和能转导非分裂细胞等优点外,还表现在,其ITRs不影响介导的目的基因表达和调控,使用细胞特异性启动子和/或增强子序列就能实现重组AAV病毒对特定组织细胞的基因转移和目的基因的表达调控,在这方面已有不少成功的例子〔13,14〕。我们在构建AAV通用型载体质粒pACR-Neo时,将多克隆位点上游的CMV立即早期启动子设计成活动状态(可用SalⅠ单酶卸下),就是考虑到应用时,可根据不同的需要代之以可控的特异性转录调控元件。这方面的工作我们实验室正在进一步研究之中。 参 考 文 献
参 考 文 献
, 百拇医药
1 Goodman S,Xiao X,Donahue R E,et al.Recombinant adeno-associated virus-mediated gene transfer into hematopoietic progenitor cells.Blood,1994,84:1492-1500.
2 Ponnazhagan S,Nallari M L,Srivastava A.Suppression of human α-globin gene expression mediated by recombinant adeno-associated virus 2-based antisense vectors.J Exp Med,1994,179:733-738.
3 Su H,Chang J C,Xu S M,et al.Selective killing of AFP-positive hepatocellular carcinoma cells by adeno-associated virus transfer of the herpes simplex virus thymidine kinase gene.Human Gene Therapy,1996,7:463-470.
, http://www.100md.com
4 姚二梅,冯泽华,郑毅,等. 通用型腺病毒伴随病毒载体的构建.中华实验和临床病毒学杂志,1998,12(2):147-150.
5 姚二梅,冯泽华,颜子颖,等.新型重组腺病毒伴随病毒包装细胞系的建立,待发表.
6 Sambrook J,Maniatis T.Molecular Cloning:A laboratory manual 2nd. ed, New York:Cold Spring Harbor Laboratory Press,1989.
7 Samulski R J,Chang L S,Shenk T.Helper-free stocks of adeno-associated viruses:Normal integration does not require viral gene expression.J Virol,1989,63:3822-3828.
, http://www.100md.com
8 Wagher M J,Sharp J A,Summers W C.Nucleotide sequence of the thymidine kinase gene of herpes simplex virus type l.Proc Natl Acad Sci USA,1981,78:1441-1444.
9 卢圣栋主编.现代分子生物学实验技术.北京:高等教育出版社,1993.
10 吴小兵.第四军医大学博士论文,1996.
11 宋平根,李素文,主编.流式细胞仪的原理和应用.北京:北京师范大学出版社,1992.
12 Eastham J A,Chen S H,Sehgal I,et al.Prostate cancer gene therapy:herpes simplex virus thymidine kinase gene transduction followed by ganciclovir in mouse and human prostate cancer models.Hum Gene Therapy,1996,7:515-523.
, 百拇医药
13 Wang X S,Yoder M C,Zhou S Z,et al.Parvovirus B19 promoter at map unit 6 confers autonomous replication competence and erythroid specificity to adeno-associated virus 2 in primary human hematopoiretic progenitor cells.Proc Natl Acad Sci USA,1995,92:12416-12420.
14 Bantel-Schaal U,Stohr M.lnfluence of adeno-associated virus on adherence and growth properties of normal cells.J Virol,1992,66:773-779.
本文为国家863高技术发展计划(863-BH03-02-05)和国家攀登计划资助课题
1997年10月13日收稿 1998年3月2日修回, 百拇医药
单位:100052 北京 中国预防医学科学院病毒学研究所病毒基因工程国家重点实验室
关键词:重组腺病毒伴随病毒;胸苷激酶基因;I型单纯疱疹病毒;基因转移
中华实验和临床病毒学杂志980303 【摘要】 目的 研究腺病毒伴随病毒(AAV)载体介导杀肿瘤基因的转移及其在肿瘤治疗方面的应用。方法 应用作者构建的腺病毒伴随病毒载体,克隆I型单纯疱疹病毒胸苷激酶(HSVI-TK)基因,构建质粒pACTK-19。用pACTK-19转染5型腺病毒(Ad5)感染的重组AAV包装细胞系AE1201,获得重组病毒rAAV/ACTK。再用此重组病毒感染肺癌细胞系A549,并联合丙氧鸟苷(GCV)作用,研究其体外对肺癌细胞的杀伤作用。结果 重组rAAC/ACTK的滴度为3.4×105CFU/ml,感染肺癌细胞系A549,实现了TK基因的转移及与细胞染色体的整合和表达,对A549细胞具有杀伤作用。结论 腺病毒伴随病毒载体能成功地实施对肺癌细胞系A549的基因转移和介导杀肿瘤效应。
, http://www.100md.com
Adeno-associated virus vector mediated gene transfer of HSVI-TK and its effect on killing cancer cell Yao Ermei,Feng Zehua, Wu Xiao bing,et al. National Lab of Molecular Virology and Genetic Engineering, Beijing 100052
Abstract The plasmid pACTK-19 was constructed by insering HSVI-TK gene into the multiple cloning sites of the general adeno-associated virus(AAV)vector pACR-Neo.When plasmid pACTK-19 was transfected to recombinant AAV's packaging cell line AE1201,which was exposed to Adenovirus 5 for two hours before transfection,we got rAAV/ACTK at the titer of 3.4×105 CFU/ml.After infecting human lung cancer cell A549 with rAAV/ACTK,we extracted host cell's chromosome cDNA and amplified part of the HSVI-TK sequence by a pair of HSVI-TK's primers and then hybridized to digoxin labelled HSVI-TK gene probe.We got corresponding positive band and it proved the integration of HSVI-TK into host cell's choromosome cDNA.By reverse transcripting rAAV/ACR-Neo infected A549 total cell RNA, we amplified part of HSVI-TK sequence and hybridized to Neo gene probe.The corresponding positive band demonstraed the expression of HSVI-TK.So through rAAV/ACTK,HSVI-TK was transfered into host cells and was expressed in them,the rAAV's genome was integrated into host cell's choromosome DNA.Connecting with Ganciclovir (GCV),the HSVI-TK gene transfer mediated by rAAV/ACTK,could inhibit the synthesis of choromosome DNA and lead to the killing of the lung cancer cell. This work proved that recombinant AAV could be used as vector for gene transduction to cancer cell,and also laid foundation for further research and application of AAV vector.
, http://www.100md.com
Key words: Recombinant adeno-associated virus HSVI-TK gene Gene transfer
腺病毒伴随病毒(AAV)在病毒分类学上属细小病毒科依赖性病毒属,是一种缺陷病毒,其复制必须依赖于辅助病毒。它是迄今为止所发现的人类病毒中,唯一与人类疾病无任何相关性的病毒,也是唯一能将其基因组定点整合到宿主细胞染色体上的病毒。这些性质赋予AAV作为基因治疗载体时安全性的特点,从而成为人们发展AAV载体的主要原因。AAV载体的研究已受到基因治疗遗传学家的普遍关注,也取得了极大进展,有望用于遗传病、肿瘤和感染性疾病的基因治疗。目前,关于AAV载体应用的研究主要集中在遗传病的治疗方面〔1,2〕,对肿瘤的基因治疗研究,仅见一例用于体外杀伤肝癌细胞的报道〔3〕。我们用自行构建的重组AAV载体〔4〕介导TK基因的转移,并联合GCV药物治疗,观察其体外杀伤肺癌细胞的作用。
, http://www.100md.com
1 材料和方法
1.1 材料 质粒pTGCMV/HyTK和大肠杆菌DH5α由病毒基因工程国家重点实验室保存。载体质粒pACR-Neo和包装细胞系AE1201由作者构建〔4,5〕肺癌细胞系A549和5型人腺病毒株(Ad5)购自美国ATCC。潮霉素(Hygromycin B)购自德国Boehringer Mannheim公司,MTT购自Sigma公司,丙氧鸟苷(GCV)购自美国Syntax公司,碘化丙锭购自北京化学试剂厂,逆转录试剂盒购自美国Promega公司。其它试剂均同文献[5]。
1.2 DNA重组技术和分析方法 参照文献[6]进行。
1.3 真核细胞转染 参照真核细胞转染试剂Lipofectamine产品说明书进行。
1.4 重组AAV病毒的收获和滴定 参见文献[7]。
, http://www.100md.com
1.5 转HSVI-TK基因的A549细胞系的建立 用重组AAV病毒rAAV/ACTK感染人肺癌细胞A549细胞,加G418或潮霉素选择富集,胰酶消化,扩大培养后,置液氮中冻存备用。
1.6 HSVI-TK基因引物的设计和合成 根据文献〔8〕的HSVI-TK基因序列,设计了一对检测HSVI-TK基因的引物P1和P2,用来选择性扩增HSVI-TK基因编码区第544-938位核苷酸之间的片段(395bp),引物序列如下:P1,5′-GCGTCTGCGTTCGACCAGGC-3′;P2:5′-GGAGCCAGAACGGCGTCCGG-3′。引物的合成采用PE公司寡核苷酸合成仪进行,HPLC纯化,合成引物的最终浓度为25pmol/μl。
1.7 PCR-Southern杂交方法检测转导细胞中HSVI-TK基因的存在 HSVI-TK基因探针的Digoxin标记方法同文献[4]。其中模板DNA为AccⅠ酶切pTGCMV/HyTK质粒获得的920bp片段,该片段包括TK基因3′端在内的大部分编码区,也覆盖了引物P1,P2间区域。细胞染色体DNA提取方法参见文献[9],PCR反应体系和条件:染色体DNA1μl,10×PCR缓冲液5μl,2.5mmol/L dNTPs4μl,50pmmol/L引物P1、P2各2μl,Taq酶4U,补充水至50μl。94℃变性、60℃退火、73℃延伸各45秒,最后一个循环73℃延伸5分种,共30个循环。用pTGCMV/HyTK质粒DNA作PCR反应的阳性对照,用A549细胞DNA和pGEM-3Zf(+)质粒DNA作PCR反应的阴性对照。反应完成后,取10μl电泳,紫外灯下观察。Southern杂交方法同文献[4]。
, 百拇医药
1.8 RT-PCR Southern杂交检测转导细胞中HSVI-TK基因的表达 细胞总RNA的提取方法同文献[5]。反转录按试剂盒说明书进行。取细胞RNA 1μg,3′端引物1μl,2.5mmol/L dNTPs2μl,5×缓冲液4μl,RNasin 0.5μl,禽源性逆转录酶AMV1μl(10U/μl),补充DEPC水至20μl,42℃反应1小时。PCR反应和Southern杂交同上。
1.9 GCV对转导A549细胞的体外杀伤作用 细胞形态变化、不同剂量GCV对Hyr A549/ACTK细胞的杀伤作用参见文献[10],GCV对Hyr A549/ACTK细胞周期影响的流式细胞仪分析参见文献[11]。
2 结果
2.1 含HSVI-TK基因的AAV质粒载体pACTK-19的构建 用XhoⅠ和HindⅢ卸下质粒pTGCMV/HyTK中CMV启动子和HyTK基因,定向取代质粒pACR-Neo中的CMV-IE启动子部分,见图1。

, http://www.100md.com
图 1 质粒pACTK-19的构建
Fig.1 Construction of plasmid pACTK-19

图 2 TK基因在重组AAV转导HyrA549/ACTK和G418rA549/ACTK细胞中的整合与表达分析
A:PCR与RT-PCR产物的琼脂糖凝胶电泳;B:PCR与RT-PCR产物的Southern杂交。1和14:DNA/HindⅢ;2,G418rA549/ACTK细胞总RNA的RT-PCR;3:HyrA549/ACTK细胞总RNA的RT-PCR;4:pGEM-3Zf(+);5,pTGCMV/HyTK/AccΙ的0.92kb片段;6:pGEM-3Zf(+)为模板的PCR;7:pTGCMV/HyTK为模板的PCR;8:A549细胞总RNA的RT-PCR;9和10:G418rA549/ACTK细胞染色体DNA的PCR;11:A549细胞染色体DNA的PCR;12和13:HyrA549/ACTK细胞染色体DNA的PCR
, http://www.100md.com
Fig.2 Integration and expression analysis of TK gene in recombinant AAV transducd HyrA549/ACTK and G418rA549/ACTK cells
A:analysis of products of PCR and RT-PCR through agarose gel electrophoresis;B:Southern blot hybridization of products of PCR and RT-PCR;1,14:λDNA/Hind Ⅲmarker;2:RT-PCR of totol RNA of G418r A549/ACTK;3:RT-PCR of total RNA of HyrA549/ACTK;4:pGEM-3Zf(+);5:pTGCMV/HyTK/AccΙfragment of 0.92kb;6:PCR of pGEM-3Zf(+);7:PCR of pTGCMV/HyTK;8:RT-PCR of total RNA of A549 cell;9,10:PCR of chromosomal cDNA of G418rA549 /ACTK;11:PCR of chromosomal DNA of A549 cell;12, 13:PCR of chromosomal DNA of HyrA549/ACTK
, 百拇医药
2.2 重组病毒rAAV/ACTK的收获和滴度测定 用质粒pACTK-19转染Ad5感染的包装细胞系AE1201,经一系列处理制备rAAV/ACTK病毒液。经测定其滴度为3.4×105 cfu/ml。
2.3 抗性细胞的获得 用rAAV/ACTK病毒感染A549细胞,48小时后,用潮霉素和G418分别加压筛选,2周后,长出抗性克隆,胰酶消化克隆灶,扩大培养,并分别命名为HyrA549/ACTK和G418rA549/ACTK细胞。
2.4 PCR-Southern杂交检测抗性细胞中TK基因 分别以HyrA549/ACTK和G418rA549/ACTK细胞染色体DNA作为模板,用P1和P2引物进行PCR扩增,扩增产物的琼脂糖凝胶电泳结果见图2A。用TK基因探针对其进行Southern杂交,结果见图2B。可见未转导的A549细胞染色体DNA其PCR扩增和Southern杂交结果均为阴性,而转导的HyrA549/ACTK和G418rA549/ACTK细胞染色体DNA均扩增出近400bp的阳性带,说明TK基因被整合到宿主细胞染色体上。
, 百拇医药
2.5 RT-PCR和Southern杂交检测抗性细胞中TK基因的转录 提取HyrA549/ACTK和G418rA549/ACTK细胞总RNA,经逆转录和PCR扩增,将其产物进行琼脂糖凝胶电泳,结果见图2A,为证明扩增产物的特异性,用Southern杂交实验检测,结果见图2B。可见未转导的A549细胞总RNA其RT-PCR和Southern杂交结果均为阴性,而转导的HyrA549/ACTK和G418rA549/ACTK细胞总RNA均扩增出近400bp的阳性带,其带形和大小均与染色体DNA扩增的结果一致,说明TK基因在转导细胞中发生了转录和表达。
2.6 GCV对HyrA549/ACTK细胞的体外杀伤作用
2.6.1 细胞形态观察 用20μmol/L GCV分别作用于A549细胞和Hyr A549/ACTK细胞,在倒置显微镜下进行活细胞观察,结果见图版ⅠA(封三)。图版ⅠA的B、C显示,GCV作用48~72小时后,Hyr A549/ACTK细胞大部分变大而扁平,细胞边缘模糊,细胞结构松散,形态不规则,核大而变圆,染色质致密,集结成团;少部分细胞变小变圆。5天后,Hyr A549/ACTK细胞全部漂浮死亡。A549细胞则无病变现象,5天后,细胞仍存活,仅仅是细胞更密集,发生堆集而已。说明GCV对HyrA549/ACTK细胞有明显地体外杀伤作用。
, 百拇医药
2.6.2 不同浓度GCV对HyrA 549/ACTK细胞的杀伤作用 A549细胞和Hyr A549/ACTK细胞培养24时小后,换成含不同浓度GCV的培养液(0~100μmol/L),再培养48小时,MTT比色法检测每孔细胞存活的情况。其中每一浓度GCV作用的细胞取3孔计算平均A值,细胞存活率用GCV各浓度平均A值除以相应对照孔平均A值所得百分率表示,结果见表1。可见,GCV在浓度很低时,就对HyrA549/ACTK细胞有明显的生长抑制作用,而对未转导的A549细胞则无抑制作用。
表 1 A549和HyrA549/ACTK细胞在不同浓度GCV作用48小时后的存活率(%)
Tab.1 Survival percentage of A549 and HyrA549/ACTK exposed to different concentrations of GCV for 48 hours 细胞
, http://www.100md.com
Cell
GCV浓度(μmol/L)
GCV concentration (μmol/L)
0
0.01
0.1
1
10
100
A549
100
102
102
, http://www.100md.com
103
102
101
HyrA549/ACTK
100
90
88
77
76
64
2.6.3 GCV杀伤HyrA549/ACTK细胞的流式细胞仪分析 20μmol/L GCV作用于HyrA549/ACTK细胞后,于0,24,48和72小时收细胞,经处理后,分别用流式细胞仪测定细胞群DNA含量分布,结果见图3。可以看出,随着时间的延长,细胞群DNA含量分布发生了明显的变化,0小时时,有明显的G2+M峰,加入GCV作用后,其G2+M峰不明显。比较各时间点细胞中G1,S和G2+M期细胞的比例,发现随着GCV作用时间的延长,G1期细胞比例相对减少,S期细胞比例明显增多,G2+M期细胞比例也减少且稳定在一个较低的水平上,见表2。这与HSVI-TK基因通过抑制细胞DNA合成(S期)而杀伤肿瘤细胞的机理是一致的。由此可见,重组病毒rAAV/ACTK成功地介导了HSVI-TK基因的转移。HSVI-TK基因联合GCV作用对A549肿瘤细胞有明显的抑制作用,并且这种作用预计发生在S期。
, 百拇医药
表 2 GCV作用于HyrA549/ACTK细胞不同时间各个细胞周期中的细胞比例(%)
Tab.2 Cell ratio of every cycling phase of HyrA549/ACTK cell when exposing to GCV for different times GCV作用时间(小时)
Exposing to GCV(hr)
细胞周期(%)
Cell cycling phase
G1
S
G2+M
, 百拇医药
0
48
40
12
24
50
48
2
48
35
62
3
72
22
, http://www.100md.com
76
2
3 讨论
HSVI-TK基因联合GCV作用杀伤肿瘤细胞的机理,是利用Ι型单纯疱疹病毒胸苷激酶对细胞胸苷激酶作用底物的广谱性,催化一些核苷类似物如丙氧鸟苷(Ganciclovir,GCV)等的磷酸化,而这些磷酸化产物能抑制细胞DNA聚合酶的活性,或者作为该酶的底物代替dGTP掺入到细胞DNA中,从而阻断了DNA合成,最终导致细胞死亡〔12〕。
我们用构建的载体质粒pACTK-19和包装细胞系AE1201获得了重组病毒rAAV/ACTK。此病毒感染人肺癌细胞系A549,经G418和潮霉素筛选均得到抗性克隆,对抗性细胞染色体DNA和总RNA进行PCR、RT-PCR和Southern杂交分析,表明TK基因整合在抗性细胞染色体上,并且获得了转录和表达。

, 百拇医药
图 3 20μmol/L GCV作用HyrA549/ACTK细胞后不同时间的流式细胞仪分析
横坐标:荧光强度;纵坐标:相对细胞数
Fig.3 Flow cytometric analysis of HyrA549/ACTK cell exposed to 20μmol/L GCV for different times
Horizontal coordinate:fluorescence intensity.Vertical coordinate:relative cell number
在抗性细胞HyrA549/ACTK中加GCV,无论是对细胞形态的观察还是MTT法检测,都证明rAAV/ACTK转导的HSVI-TK基因抑制A549细胞生长,直至死亡。而未转导HSVI-TK基因的A549细胞对GCV作用不敏感。
, 百拇医药
关于AAV介导肿瘤自杀基因的转移和对细胞周期的影响,尚未见报道。我们用流式细胞仪检测HSVI-TK/GCV对细胞周期的影响,发现随着时间的延长,处于不同时期的细胞比例发生了明显变化,且变化现象与HSVI-TK诱导细胞自杀的机理的相一致的。这说明我们用重组AAV介导TK基因转移至肿瘤细胞是非常成功的,细胞有TK基因功能性产物表达,起到了抑制肿瘤细胞生长的作用。
重组AAV有希望成为基因治疗的良好载体除了具有非致病性、基因组能整合、在转导细胞中稳定表达和能转导非分裂细胞等优点外,还表现在,其ITRs不影响介导的目的基因表达和调控,使用细胞特异性启动子和/或增强子序列就能实现重组AAV病毒对特定组织细胞的基因转移和目的基因的表达调控,在这方面已有不少成功的例子〔13,14〕。我们在构建AAV通用型载体质粒pACR-Neo时,将多克隆位点上游的CMV立即早期启动子设计成活动状态(可用SalⅠ单酶卸下),就是考虑到应用时,可根据不同的需要代之以可控的特异性转录调控元件。这方面的工作我们实验室正在进一步研究之中。
 参 考 文 献
参 考 文 献, 百拇医药
1 Goodman S,Xiao X,Donahue R E,et al.Recombinant adeno-associated virus-mediated gene transfer into hematopoietic progenitor cells.Blood,1994,84:1492-1500.
2 Ponnazhagan S,Nallari M L,Srivastava A.Suppression of human α-globin gene expression mediated by recombinant adeno-associated virus 2-based antisense vectors.J Exp Med,1994,179:733-738.
3 Su H,Chang J C,Xu S M,et al.Selective killing of AFP-positive hepatocellular carcinoma cells by adeno-associated virus transfer of the herpes simplex virus thymidine kinase gene.Human Gene Therapy,1996,7:463-470.
, http://www.100md.com
4 姚二梅,冯泽华,郑毅,等. 通用型腺病毒伴随病毒载体的构建.中华实验和临床病毒学杂志,1998,12(2):147-150.
5 姚二梅,冯泽华,颜子颖,等.新型重组腺病毒伴随病毒包装细胞系的建立,待发表.
6 Sambrook J,Maniatis T.Molecular Cloning:A laboratory manual 2nd. ed, New York:Cold Spring Harbor Laboratory Press,1989.
7 Samulski R J,Chang L S,Shenk T.Helper-free stocks of adeno-associated viruses:Normal integration does not require viral gene expression.J Virol,1989,63:3822-3828.
, http://www.100md.com
8 Wagher M J,Sharp J A,Summers W C.Nucleotide sequence of the thymidine kinase gene of herpes simplex virus type l.Proc Natl Acad Sci USA,1981,78:1441-1444.
9 卢圣栋主编.现代分子生物学实验技术.北京:高等教育出版社,1993.
10 吴小兵.第四军医大学博士论文,1996.
11 宋平根,李素文,主编.流式细胞仪的原理和应用.北京:北京师范大学出版社,1992.
12 Eastham J A,Chen S H,Sehgal I,et al.Prostate cancer gene therapy:herpes simplex virus thymidine kinase gene transduction followed by ganciclovir in mouse and human prostate cancer models.Hum Gene Therapy,1996,7:515-523.
, 百拇医药
13 Wang X S,Yoder M C,Zhou S Z,et al.Parvovirus B19 promoter at map unit 6 confers autonomous replication competence and erythroid specificity to adeno-associated virus 2 in primary human hematopoiretic progenitor cells.Proc Natl Acad Sci USA,1995,92:12416-12420.
14 Bantel-Schaal U,Stohr M.lnfluence of adeno-associated virus on adherence and growth properties of normal cells.J Virol,1992,66:773-779.
本文为国家863高技术发展计划(863-BH03-02-05)和国家攀登计划资助课题
1997年10月13日收稿 1998年3月2日修回, 百拇医药