山莨菪碱对创伤性肺损伤防治作用的实验研究
作者:梁继河 朱云喜 李琦 罗新林
单位:梁继河 朱云喜 710032 西安,第四军医大学附属西京医院心胸外科;李琦 第四军医大学基础部免疫学教研室;罗新林 航空医学系
关键词:创伤;急性肺损伤;山莨菪碱;肿瘤坏死因子-α;白介素-8;基因表达
中华创伤杂志980507 【摘要】 目的 探讨山莨菪碱(654-2)对创伤性急性肺损伤(ALI)的防止作用及其可能的机制。方法 观察654-2对创伤性ALI兔血浆和支气管肺泡灌洗液(BALF)中肿瘤坏死因子α(TNF-α)和白介素8(IL-8)含量的影响,同时进行组织病理学的光镜和电镜检查,并用原位杂交法检测肺和其他脏器组织中TNF-α和IL-8的mRNA表达。结果 致伤前、后给予654-2,可使创伤性ALI兔血浆及BALF中的TNF-α、IL-8明显减少、肺组织损伤程度减轻;TNF-α mRNA和 IL-8 mRNA的基因表达主要定位在内脏组织中的M、PMN和血管内皮细胞(VEC)内,表达数量明显减少。。结论 654-2可降低血浆及BALF中TNF-α、IL-8的含量,使TNFα mRNA和IL-8 mRNA的基因表达下调,从而减轻或在一定程度上防止创伤性ALI的发生和发展。
, http://www.100md.com
Experimental Study of Preventive and Therapeutic Effects of Anisodamine on Traumatic Acute Lung Injury LIANG Ji-he, ZHU Yun-xi, LI Qi, et al. Dept. of Cardiothoracic Surgery, Xijing Hospital, Fourth Military Medical University, Xi'an 710032
【Abstract】 Aim To investigate the preventive and therapeutic effects of anisodamine (654-2) on traumatic acute lung injury and their mechanism. Methods 654-2 was used in the prophylaxis and treatment of the rabbits with traumatic acute lung injury. The changes of the contents of tumor necrosis factor- α(TNF-α) and interleukin-8 (IL-8) in plasma and bronchoalveolar lavage fluid (BALF) were observed. Meanwhile, the pathologic changes were examined with optical microscope and TV microscope respectively. In situ hybridization test was used to detect the gene expression and cell localization of TNF-α and IL-8. Results 654-2 could decrease the contents of TNF-α and IL-8 in plasma and BALF and alleviate the pulmonary tissue injury. Gene expression of TNF-α mRNA and IL-8 mRNA was primarily located in M, PMN, VEC of organ tissues, and was significantly decreased in their cell quantity. Conclusion 654-2 possesses protective effects on traumatic lung injury through the decrease of TNF-α and IL-8 and downregulation of their gene expression.
, 百拇医药
【Key words】 Trauma Acute lung injury Anisodamine Tumor necrosis factor-α Interleukin-8 Gene expression
急性肺损伤(ALI)已成为严重创伤、大面积烧伤和严重感染等病人死亡的主要原因[1]。自1967年Ashbaugh等首次描述该病的临床特征以来,确切的发病机制至今尚未完全阐明,临床上缺乏有效的防治措施。近年来,临床和动物实验均证实山莨菪碱(654-2)对ALI具有良好的保护作用[2],但对其作用机制了解甚少。笔者采用胸部撞击加静脉注射小剂量内毒素的方法[3]造成创伤性ALI模型,采用酶联免疫方法检测兔血浆及支气管肺泡灌洗液(BALF)中肿瘤坏死因子α(TNF-α)、白介素8(IL-8)含量改变,并用原位杂交法检测肺和其他脏器组织中TNFα和IL-8 mRNA表达及细胞定位,观察静脉注射654-2对其含量的影响和对兔创伤性ALI的保护作用,力图从细胞因子水平探讨创伤性ALI的发病机制以及654-2对创伤性ALI的防治作用。
, 百拇医药
材料与方法
1.动物分组及处理:健康大耳白兔(本校动物中心提供)32只,雌雄不限(戊巴比妥钠25mg/kg静脉麻醉),随机分为4组,每组8只:(1)创伤性ALI模型(M)组,兔仰卧固定于撞击台上,以冲击速度5.71m/s、力75.8N/cm,冲撞能量约204J使胸壁压缩40%,约3cm。兔非冲撞击侧胸壁被硬板支撑,兔体只可挤压,不能移位。随后静脉注射大肠杆菌内毒素50μg/kg。(2)654-2预防(P)组:先静脉注射654-2 2mg/kg,然后按M组方法处理。(3)654-2治疗(T)组:按M组制成创伤性ALI后,即刻给予654-2 2mg/kg静脉注射。0.5小时后以1mg.kg-1.h-1静脉滴注维持。(4)正常对照组(C)组:静脉注射等渗盐水0.2ml/kg。2.检测指标:(1)各组均于撞击前、后0.5,1.5,2,4,6,12,24小时经颈动脉采血行血气分析。(2)与上述同一时相点采血检测血浆中TNF-α、IL-8含量;24小时活杀兔取右肺灌洗,检测BALF中TNF-α和IL-8含量。用酶联免疫方法测定(TNF-α和IL-8试剂盒均由我校免疫教研室提供)。(3)病理学检查:于撞击后24小时活杀兔,取左上肺作常规光镜和电镜检查。(4)用原位杂交法检测肺、肝、肾、心组织细胞中TNF-α和IL-8的mRNA表达,标记基因探针能够特异性地与细胞浆中相应的mRNA杂交呈现银颗粒聚集,其密度大于背底3倍以上的细胞才确认为阳性细胞。
, 百拇医药
3.统计学处理:各参数以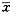 ±s表示,用我校统计教研室统计软件在微机上行单因素分析、t检验,P值代表差异显著性。
±s表示,用我校统计教研室统计软件在微机上行单因素分析、t检验,P值代表差异显著性。
结 果
1.呼吸变化:M组兔创伤后呼吸频率逐渐加快、呼吸困难、窘迫,有4只兔出现明显发绀,撞击后24小时濒于死亡;动脉血氧分压(PaO2)进行性下降,于实验后24小时为最低值(8.64±0.62)kPa。P组和T组撞击后呼吸均快且幅度加深,无发绀,PaO2逐渐下降,24小时后最低值P组为(9.63±0.84)kPa,T组为(9.24±0.76)kPa。M组与P组、T组差异均显著(P<0.05),M组与C组差异非常显著(P<0.01),C组与T组差异显著(P<0.05)。
2.肺湿/干比值:M组为5.84±0.28,P组5.12±0.20,T组5.24±2.11,C组4.62±0.21。M组与C组差异非常显著(P<0.01),P组、T组与C组差异均显著(P<0.05)。说明M组为重度肺水肿,P组和T组均为中性肺水肿。
, 百拇医药
3.病理学检查:M组肺体积增大变实,表面有大小不等散在红色斑片,切面呈红色实样变。光镜下:肺间质及肺泡腔水肿、渗出、出血、粒细胞浸润,肺泡腔内透明膜形成;电镜下:肺泡Ⅱ型细胞微绒毛脱落、板层体空化、线粒体肿大、肺间质内粒细胞浸润。P组与T组病变相似,但较M组略轻, 均可见病变以双侧下叶重,散在出血,少许炎细胞浸润;电镜下:Ⅱ型肺泡细胞微绒毛减少,肺泡腔少许渗出和细胞浸润。
4.血浆TNF-α含量变化(表1):各组实验前和C组血浆TNF-α均低于0.3ng/ml。M组撞击后0.5小时开始升高,1.5小时达高峰,2小时开始下降,4~6小时接近C组水平,P组未见明显升高;T组稍升高,4小时已接近C组水平。M组与C组之间差异非常显著(P<0.01),P组、T组与C组之间无显著性差异(P>0.05)。
表1 撞击前后兔血浆TNF-α含量的变化(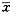 ±s,ng/ml) 组别
±s,ng/ml) 组别
, 百拇医药
撞击前
撞击后时间(h)
0.5
1
1.5
2
4
6
12
24
M组
0.18±0.10
0.56±0.20
, 百拇医药
0.88±0.28**
1.26±0.28**
0.84±0.30**
0.38±0.20
0.26±0.11
0.21±0.11
0.24±0.15
T组
0.17±0.09
0.31±0.12
0.38±0.11*
, http://www.100md.com
0.33±0.10*
0.30±0.12
0.31±0.11
0.28±0.14
0.38±0.12*
0.28±0.10
P组
0.18±0.10
0.30±0.11
0.35±0.12*
0.25±0.09
, 百拇医药
0.22±0.10
0.20±0.13
0.24±0.08
0.19±0.12
0.25±0.10
C组
0.15±0.08
0.17±0.10
0.16±0.10
0.15±0.11
0.16±0.12
0.18±0.11
, http://www.100md.com
0.20±0.10
0.17±0.01
0.20±0.14
与C组比较 *P<0.05 **P<0.01
5.血浆IL-8含量变化(表2):各组撞击前及C组血浆IL-8含量均低于(1.85±0.12)ng/ml。M组在撞击后0.5~1小时血浆IL-8含量未见明显变化,撞击后1.5小时开始升高,6小时仍继续上升,12小时开始下降,24小时达C组水平。P组和T组可见稍升高,T组高于P组。P、T组与C组之间均无显著性差异(P>0.05),M组与C组之间差异非常显著(P<0.01)。表2 撞击前后兔血浆IL-8含量的变化(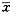 ±s,ng/ml)
±s,ng/ml)
, 百拇医药
组别
撞击前
撞击后时间(h)
0.5
1
1.5
2
4
6
12
24
M组
1.10±0.55
, 百拇医药
1.33±0.62
1.58±0.63
2.26±1.22*
2.58±1.06*
2.86±1.15**
4.06±1.58**
5.21±2.01**
1.56±0.73
T组
1.06±0.64
, 百拇医药
1.11±0.58
1.32±0.63
1.28±0.74
1.21±0.86
1.85±1.10*
2.23±0.92*
2.00±1.10
1.48±0.75
P组
1.07±0.62
1.11±0.63
, 百拇医药
1.15±0.68
1.20±0.82
1.25±0.82
1.62±1.10
1.48±0.87
1.36±0.76
1.27±0.80
C组
1.04±1.58
1.08±0.56
1.11±0.62
1.86±0.66
, 百拇医药
1.08±0.60
1.12±0.59
1.10±0.62
1.15±0.76
1.06±0.53
与C组比较 *P<0.05 **P<0.01 6.BALF中TNF-α及IL-8含量(表3):4组BALF中均能检测到TNF-α及IL-8,以M组含量最高,T组次之,P组最低。M组与C组之间差异非常显著(P<0.01),P组、T组与C组之间无显著性差异(P>0.05)。
表3 撞击后24小时兔BALF中TNF-α和IL-8含量(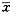 ±s,ng/ml) 组别
±s,ng/ml) 组别
, 百拇医药
TNF-α
IL-8
M组
1.21±0.64**
1.86±0.88**
T组
0.33±0.20
0.49±0.18*
P组
0.30±0.18
0.48±0.16
, 百拇医药 C组
0.28±0.11
0.20±0.12
与C组比较 *P<0.05 **P<0.01
7.原位杂交检测结果(表4):TNF-α mRNA在正常肺巨噬细胞(Mφ)和肝枯否细胞内有少量阳性表达,在肾、心组织中无阳性表达。IL-8 mRNA在正常组中无阳性表达。M组中TNF-α mRNA和IL-8 mRNA在肺组织中呈强阳性表达,不但出现在Mφ和枯否细胞内,还出现在嗜中性粒细胞(PMN)和血管内皮细胞(VEC)内,与 C组之间有非常显著性差异(P<0.01)。在肾、心组织的PMN和VEC中亦有阳性表达,与C组之间有显著性差异(P<0.05)。在P组和T组,上述组织中TNF-α mRNA和IL-8 mRNA表达远较M组为轻,与C组相比仅在肺组织中的表达呈现显著性差异(P<0.05)。表4 撞击24小时后兔肺、肝、肾、心组织中TNF-α与IL-8的mRNA阳性细胞(个/高倍视野) 组别
, 百拇医药
TNF-αmRAN
IL-8 mRNA
肺
肝
肾
心
肺
肝
肾
心
M组
156.3±32.4**
118.3±33.2**
, 百拇医药
67.4±18.2*
33.7±14.2*
212.4±54.3**
116.0±42.3**
65.0±33.2*
54.0±20.3*
T组
92.7±23.7*
52.6±20.4
13.6±7.2
, http://www.100md.com
13.6±7.2
84.5±20.0*
33.2±18.0
20.0±11.7
14.0±8.2
P组
92.3±19.8*
48.0±15.2
23.5±7.6
14.3±4.6
73.1±18.5*
, 百拇医药
32.4±15.2
18.4±6.0
8.5±3.2
C组
26.4±15.1
18.6±8.4
0.00±0.00
0.00±0.00
0.00±0.00
0.00±0.00
0.00±0.00
0.00±0.00
, 百拇医药
与C组比较 *P<0.05 **P<0.01
讨 论
创伤性ALI是指由创伤引起的急性呼吸功能不全,发病机制复杂,涉及机体多个系统和多种体液因素异常。近来研究发现,TNF在ALI中发挥着重要作用,是引起ALI的启动因子[3,4]。笔者在实验中发现,兔创伤后血浆和BALF中TNF-α均显著增高,约在伤后1.5小时达峰值,6小时后恢复正常水平。TNF-α升高引起肺损伤,出现一系列症状如呼吸窘迫、发绀、PaO2下降等典型ALI表现。TNF-α可通过下列途径引起肺损伤[5]:(1)TNF-α与肺组织TNF受体结合,溶酶体受损;酶外泄引起肺损伤;(2)TNF-α刺激粒细胞粘附,呼吸爆发和继发性脱颗粒,释放蛋白酶、血小板激活因子(PAF)和氧自由基;(3)刺激单核巨噬细胞产生IL-1,IL-2,IL6和IL-8引起组织损伤;(4)TNF-α直接作用于内皮细胞,使其受损,毛细血管通透性增加和血栓形成。
, 百拇医药
IL-8是单核细胞产生的中粒细胞趋化因子,多形核白细胞(PMN)在ALI发病中起作用。而IL-8的主要靶细胞就是PMN[6]。Donnelly等[7]报告,在ARDS病人血浆及BALF中均检测到IL-8显著升高。本实验创伤性ALI模型组兔血浆中IL-8在撞击后4~6小时升高,峰值是继TNF-α之后,持续时间较久,可能与创伤应激后粒细胞的持续和过度活化有关。TNF-α和IL-8在创伤后不同时间出现,可能提示它们之间的因果关系。TNF-α早期出现说明它是ALI的启动因子,而IL-8的随后出现并且持续较长时间,则也许是细胞因子群活化后,级联反应不断扩大的增强因子。IL-8的主要靶细胞是在ALI中发挥重要作用的粒细胞群,它可广泛地影响粒细胞的生物活性而参与肺损伤的发病机制[8]:对粒细胞有强烈的趋化性,使粒细胞脱颗粒,产生氧自由基、蛋白酶等介质;增加粒细胞对内皮细胞层的穿透力和血管内皮层的通透性;通过直接或间接的途径趋化粒细胞进入组织间隙和炎症区域。
原位杂交检测揭示TNF-α mRNA和IL-8 mRNA出现在M、枯否细胞、PMN和VEC中,既说明TNF-α和IL-8主要为上述细胞产生,又可说明这些细胞的过度激活在ALI的病理机制中起着重要作用。另一方面,ALI时TNF-α和IL-8的mRNA表达不仅出现在肺组织中,同时也出现在肝、肾、心组织 ,这就从基因表达上证实ALI是MODS的一部分。
, 百拇医药
654-2是我国医学科学工作者于1965年4月从植物中提取的一种生物碱类药物,目前临床广泛用于治疗感染性休克、解痉、改善微循环和防治缺血再灌注损伤等。80年代以来用于防治ALI,显示出良好的保护作用[2,3],但确切机制不明。笔者采用654-2防治创伤性ALI取得较好效果,兔呼吸困难和肺水肿明显改善,PaO2获得较好恢复,肺组织病变明显减轻,说明654-2可减轻创伤所致的
ALI。同时发现应用654-2后血浆及BALF中TNF-α及IL-8含量均明显降低,可能是654-2发挥抗炎、保护细胞膜结构和减轻肺损伤等重要药理作用所致。654-2能减轻TNF-α mRNA和IL-8 mRNA在肺、肝、肾、心组织内的表达,说明654-2对ALI的预防和治疗作用是通过改变TNF-α和IL-8的基因表达来起作用的,但对其机制尚需作进一步的研究。
本课题受国家自然科学基金资助(No.39770736)
, 百拇医药
参考文献
[1]Baker CC, Oppenheimer L, Stephens R, et al. Epidemiology of trauma deaths. Am J Surg, 1980, 140∶144-150.
[2]管用东,黄雄庆,陈秉学,等.山莨菪碱对ARDS的氧输送及血流动力学改变的作用.中华麻醉学杂志, 1996,16∶263-265.
[3]胡建才,刘维永,梁继河,等.肿瘤坏死因子和白介素-6在肺挫伤致急性呼吸窘迫综合征中的变化及意义.解放军医学杂志, 1997,22∶287-288.
[4]Spooner CE, Markowttz NP, Saravolatz LD, et al. The role of tumor necrosis factor in sepsis. Clinical Immunology and Immunopathology, 1992, 62(Suppl)∶S11-S17.
, 百拇医药
[5]Cerami A. Inflammatory cytokines. Clinical Immunology and Immunopathology, 1992, 62(Suppl)∶S3-S10.
[6]Fujishima S, Aikawa N. Neutrophil-mediated tissue injury and its modulation. Intensive Care Med, 1995, 21∶277-285.
[7]Donnelly SC, Strieter RM, Kunkel SL, et al. Interleukin-8 and development of adult respiratory distress syndrome in risk patient group. Lancet, 1993, 341∶643-649.
[8]Fujishima S, Saaki JI, Shinozawa Y, et al. Interleukin-8 in ARDS. Lanct, 1993, 342∶237-243.
(收稿:1997-03-24 修回:1998-06-01), 百拇医药
单位:梁继河 朱云喜 710032 西安,第四军医大学附属西京医院心胸外科;李琦 第四军医大学基础部免疫学教研室;罗新林 航空医学系
关键词:创伤;急性肺损伤;山莨菪碱;肿瘤坏死因子-α;白介素-8;基因表达
中华创伤杂志980507 【摘要】 目的 探讨山莨菪碱(654-2)对创伤性急性肺损伤(ALI)的防止作用及其可能的机制。方法 观察654-2对创伤性ALI兔血浆和支气管肺泡灌洗液(BALF)中肿瘤坏死因子α(TNF-α)和白介素8(IL-8)含量的影响,同时进行组织病理学的光镜和电镜检查,并用原位杂交法检测肺和其他脏器组织中TNF-α和IL-8的mRNA表达。结果 致伤前、后给予654-2,可使创伤性ALI兔血浆及BALF中的TNF-α、IL-8明显减少、肺组织损伤程度减轻;TNF-α mRNA和 IL-8 mRNA的基因表达主要定位在内脏组织中的M、PMN和血管内皮细胞(VEC)内,表达数量明显减少。。结论 654-2可降低血浆及BALF中TNF-α、IL-8的含量,使TNFα mRNA和IL-8 mRNA的基因表达下调,从而减轻或在一定程度上防止创伤性ALI的发生和发展。
, http://www.100md.com
Experimental Study of Preventive and Therapeutic Effects of Anisodamine on Traumatic Acute Lung Injury LIANG Ji-he, ZHU Yun-xi, LI Qi, et al. Dept. of Cardiothoracic Surgery, Xijing Hospital, Fourth Military Medical University, Xi'an 710032
【Abstract】 Aim To investigate the preventive and therapeutic effects of anisodamine (654-2) on traumatic acute lung injury and their mechanism. Methods 654-2 was used in the prophylaxis and treatment of the rabbits with traumatic acute lung injury. The changes of the contents of tumor necrosis factor- α(TNF-α) and interleukin-8 (IL-8) in plasma and bronchoalveolar lavage fluid (BALF) were observed. Meanwhile, the pathologic changes were examined with optical microscope and TV microscope respectively. In situ hybridization test was used to detect the gene expression and cell localization of TNF-α and IL-8. Results 654-2 could decrease the contents of TNF-α and IL-8 in plasma and BALF and alleviate the pulmonary tissue injury. Gene expression of TNF-α mRNA and IL-8 mRNA was primarily located in M, PMN, VEC of organ tissues, and was significantly decreased in their cell quantity. Conclusion 654-2 possesses protective effects on traumatic lung injury through the decrease of TNF-α and IL-8 and downregulation of their gene expression.
, 百拇医药
【Key words】 Trauma Acute lung injury Anisodamine Tumor necrosis factor-α Interleukin-8 Gene expression
急性肺损伤(ALI)已成为严重创伤、大面积烧伤和严重感染等病人死亡的主要原因[1]。自1967年Ashbaugh等首次描述该病的临床特征以来,确切的发病机制至今尚未完全阐明,临床上缺乏有效的防治措施。近年来,临床和动物实验均证实山莨菪碱(654-2)对ALI具有良好的保护作用[2],但对其作用机制了解甚少。笔者采用胸部撞击加静脉注射小剂量内毒素的方法[3]造成创伤性ALI模型,采用酶联免疫方法检测兔血浆及支气管肺泡灌洗液(BALF)中肿瘤坏死因子α(TNF-α)、白介素8(IL-8)含量改变,并用原位杂交法检测肺和其他脏器组织中TNFα和IL-8 mRNA表达及细胞定位,观察静脉注射654-2对其含量的影响和对兔创伤性ALI的保护作用,力图从细胞因子水平探讨创伤性ALI的发病机制以及654-2对创伤性ALI的防治作用。
, 百拇医药
材料与方法
1.动物分组及处理:健康大耳白兔(本校动物中心提供)32只,雌雄不限(戊巴比妥钠25mg/kg静脉麻醉),随机分为4组,每组8只:(1)创伤性ALI模型(M)组,兔仰卧固定于撞击台上,以冲击速度5.71m/s、力75.8N/cm,冲撞能量约204J使胸壁压缩40%,约3cm。兔非冲撞击侧胸壁被硬板支撑,兔体只可挤压,不能移位。随后静脉注射大肠杆菌内毒素50μg/kg。(2)654-2预防(P)组:先静脉注射654-2 2mg/kg,然后按M组方法处理。(3)654-2治疗(T)组:按M组制成创伤性ALI后,即刻给予654-2 2mg/kg静脉注射。0.5小时后以1mg.kg-1.h-1静脉滴注维持。(4)正常对照组(C)组:静脉注射等渗盐水0.2ml/kg。2.检测指标:(1)各组均于撞击前、后0.5,1.5,2,4,6,12,24小时经颈动脉采血行血气分析。(2)与上述同一时相点采血检测血浆中TNF-α、IL-8含量;24小时活杀兔取右肺灌洗,检测BALF中TNF-α和IL-8含量。用酶联免疫方法测定(TNF-α和IL-8试剂盒均由我校免疫教研室提供)。(3)病理学检查:于撞击后24小时活杀兔,取左上肺作常规光镜和电镜检查。(4)用原位杂交法检测肺、肝、肾、心组织细胞中TNF-α和IL-8的mRNA表达,标记基因探针能够特异性地与细胞浆中相应的mRNA杂交呈现银颗粒聚集,其密度大于背底3倍以上的细胞才确认为阳性细胞。
, 百拇医药
3.统计学处理:各参数以
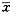 ±s表示,用我校统计教研室统计软件在微机上行单因素分析、t检验,P值代表差异显著性。
±s表示,用我校统计教研室统计软件在微机上行单因素分析、t检验,P值代表差异显著性。结 果
1.呼吸变化:M组兔创伤后呼吸频率逐渐加快、呼吸困难、窘迫,有4只兔出现明显发绀,撞击后24小时濒于死亡;动脉血氧分压(PaO2)进行性下降,于实验后24小时为最低值(8.64±0.62)kPa。P组和T组撞击后呼吸均快且幅度加深,无发绀,PaO2逐渐下降,24小时后最低值P组为(9.63±0.84)kPa,T组为(9.24±0.76)kPa。M组与P组、T组差异均显著(P<0.05),M组与C组差异非常显著(P<0.01),C组与T组差异显著(P<0.05)。
2.肺湿/干比值:M组为5.84±0.28,P组5.12±0.20,T组5.24±2.11,C组4.62±0.21。M组与C组差异非常显著(P<0.01),P组、T组与C组差异均显著(P<0.05)。说明M组为重度肺水肿,P组和T组均为中性肺水肿。
, 百拇医药
3.病理学检查:M组肺体积增大变实,表面有大小不等散在红色斑片,切面呈红色实样变。光镜下:肺间质及肺泡腔水肿、渗出、出血、粒细胞浸润,肺泡腔内透明膜形成;电镜下:肺泡Ⅱ型细胞微绒毛脱落、板层体空化、线粒体肿大、肺间质内粒细胞浸润。P组与T组病变相似,但较M组略轻, 均可见病变以双侧下叶重,散在出血,少许炎细胞浸润;电镜下:Ⅱ型肺泡细胞微绒毛减少,肺泡腔少许渗出和细胞浸润。
4.血浆TNF-α含量变化(表1):各组实验前和C组血浆TNF-α均低于0.3ng/ml。M组撞击后0.5小时开始升高,1.5小时达高峰,2小时开始下降,4~6小时接近C组水平,P组未见明显升高;T组稍升高,4小时已接近C组水平。M组与C组之间差异非常显著(P<0.01),P组、T组与C组之间无显著性差异(P>0.05)。
表1 撞击前后兔血浆TNF-α含量的变化(
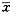 ±s,ng/ml) 组别
±s,ng/ml) 组别, 百拇医药
撞击前
撞击后时间(h)
0.5
1
1.5
2
4
6
12
24
M组
0.18±0.10
0.56±0.20
, 百拇医药
0.88±0.28**
1.26±0.28**
0.84±0.30**
0.38±0.20
0.26±0.11
0.21±0.11
0.24±0.15
T组
0.17±0.09
0.31±0.12
0.38±0.11*
, http://www.100md.com
0.33±0.10*
0.30±0.12
0.31±0.11
0.28±0.14
0.38±0.12*
0.28±0.10
P组
0.18±0.10
0.30±0.11
0.35±0.12*
0.25±0.09
, 百拇医药
0.22±0.10
0.20±0.13
0.24±0.08
0.19±0.12
0.25±0.10
C组
0.15±0.08
0.17±0.10
0.16±0.10
0.15±0.11
0.16±0.12
0.18±0.11
, http://www.100md.com
0.20±0.10
0.17±0.01
0.20±0.14
与C组比较 *P<0.05 **P<0.01
5.血浆IL-8含量变化(表2):各组撞击前及C组血浆IL-8含量均低于(1.85±0.12)ng/ml。M组在撞击后0.5~1小时血浆IL-8含量未见明显变化,撞击后1.5小时开始升高,6小时仍继续上升,12小时开始下降,24小时达C组水平。P组和T组可见稍升高,T组高于P组。P、T组与C组之间均无显著性差异(P>0.05),M组与C组之间差异非常显著(P<0.01)。表2 撞击前后兔血浆IL-8含量的变化(
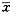 ±s,ng/ml)
±s,ng/ml), 百拇医药
组别
撞击前
撞击后时间(h)
0.5
1
1.5
2
4
6
12
24
M组
1.10±0.55
, 百拇医药
1.33±0.62
1.58±0.63
2.26±1.22*
2.58±1.06*
2.86±1.15**
4.06±1.58**
5.21±2.01**
1.56±0.73
T组
1.06±0.64
, 百拇医药
1.11±0.58
1.32±0.63
1.28±0.74
1.21±0.86
1.85±1.10*
2.23±0.92*
2.00±1.10
1.48±0.75
P组
1.07±0.62
1.11±0.63
, 百拇医药
1.15±0.68
1.20±0.82
1.25±0.82
1.62±1.10
1.48±0.87
1.36±0.76
1.27±0.80
C组
1.04±1.58
1.08±0.56
1.11±0.62
1.86±0.66
, 百拇医药
1.08±0.60
1.12±0.59
1.10±0.62
1.15±0.76
1.06±0.53
与C组比较 *P<0.05 **P<0.01 6.BALF中TNF-α及IL-8含量(表3):4组BALF中均能检测到TNF-α及IL-8,以M组含量最高,T组次之,P组最低。M组与C组之间差异非常显著(P<0.01),P组、T组与C组之间无显著性差异(P>0.05)。
表3 撞击后24小时兔BALF中TNF-α和IL-8含量(
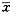 ±s,ng/ml) 组别
±s,ng/ml) 组别, 百拇医药
TNF-α
IL-8
M组
1.21±0.64**
1.86±0.88**
T组
0.33±0.20
0.49±0.18*
P组
0.30±0.18
0.48±0.16
, 百拇医药 C组
0.28±0.11
0.20±0.12
与C组比较 *P<0.05 **P<0.01
7.原位杂交检测结果(表4):TNF-α mRNA在正常肺巨噬细胞(Mφ)和肝枯否细胞内有少量阳性表达,在肾、心组织中无阳性表达。IL-8 mRNA在正常组中无阳性表达。M组中TNF-α mRNA和IL-8 mRNA在肺组织中呈强阳性表达,不但出现在Mφ和枯否细胞内,还出现在嗜中性粒细胞(PMN)和血管内皮细胞(VEC)内,与 C组之间有非常显著性差异(P<0.01)。在肾、心组织的PMN和VEC中亦有阳性表达,与C组之间有显著性差异(P<0.05)。在P组和T组,上述组织中TNF-α mRNA和IL-8 mRNA表达远较M组为轻,与C组相比仅在肺组织中的表达呈现显著性差异(P<0.05)。表4 撞击24小时后兔肺、肝、肾、心组织中TNF-α与IL-8的mRNA阳性细胞(个/高倍视野) 组别
, 百拇医药
TNF-αmRAN
IL-8 mRNA
肺
肝
肾
心
肺
肝
肾
心
M组
156.3±32.4**
118.3±33.2**
, 百拇医药
67.4±18.2*
33.7±14.2*
212.4±54.3**
116.0±42.3**
65.0±33.2*
54.0±20.3*
T组
92.7±23.7*
52.6±20.4
13.6±7.2
, http://www.100md.com
13.6±7.2
84.5±20.0*
33.2±18.0
20.0±11.7
14.0±8.2
P组
92.3±19.8*
48.0±15.2
23.5±7.6
14.3±4.6
73.1±18.5*
, 百拇医药
32.4±15.2
18.4±6.0
8.5±3.2
C组
26.4±15.1
18.6±8.4
0.00±0.00
0.00±0.00
0.00±0.00
0.00±0.00
0.00±0.00
0.00±0.00
, 百拇医药
与C组比较 *P<0.05 **P<0.01
讨 论
创伤性ALI是指由创伤引起的急性呼吸功能不全,发病机制复杂,涉及机体多个系统和多种体液因素异常。近来研究发现,TNF在ALI中发挥着重要作用,是引起ALI的启动因子[3,4]。笔者在实验中发现,兔创伤后血浆和BALF中TNF-α均显著增高,约在伤后1.5小时达峰值,6小时后恢复正常水平。TNF-α升高引起肺损伤,出现一系列症状如呼吸窘迫、发绀、PaO2下降等典型ALI表现。TNF-α可通过下列途径引起肺损伤[5]:(1)TNF-α与肺组织TNF受体结合,溶酶体受损;酶外泄引起肺损伤;(2)TNF-α刺激粒细胞粘附,呼吸爆发和继发性脱颗粒,释放蛋白酶、血小板激活因子(PAF)和氧自由基;(3)刺激单核巨噬细胞产生IL-1,IL-2,IL6和IL-8引起组织损伤;(4)TNF-α直接作用于内皮细胞,使其受损,毛细血管通透性增加和血栓形成。
, 百拇医药
IL-8是单核细胞产生的中粒细胞趋化因子,多形核白细胞(PMN)在ALI发病中起作用。而IL-8的主要靶细胞就是PMN[6]。Donnelly等[7]报告,在ARDS病人血浆及BALF中均检测到IL-8显著升高。本实验创伤性ALI模型组兔血浆中IL-8在撞击后4~6小时升高,峰值是继TNF-α之后,持续时间较久,可能与创伤应激后粒细胞的持续和过度活化有关。TNF-α和IL-8在创伤后不同时间出现,可能提示它们之间的因果关系。TNF-α早期出现说明它是ALI的启动因子,而IL-8的随后出现并且持续较长时间,则也许是细胞因子群活化后,级联反应不断扩大的增强因子。IL-8的主要靶细胞是在ALI中发挥重要作用的粒细胞群,它可广泛地影响粒细胞的生物活性而参与肺损伤的发病机制[8]:对粒细胞有强烈的趋化性,使粒细胞脱颗粒,产生氧自由基、蛋白酶等介质;增加粒细胞对内皮细胞层的穿透力和血管内皮层的通透性;通过直接或间接的途径趋化粒细胞进入组织间隙和炎症区域。
原位杂交检测揭示TNF-α mRNA和IL-8 mRNA出现在M、枯否细胞、PMN和VEC中,既说明TNF-α和IL-8主要为上述细胞产生,又可说明这些细胞的过度激活在ALI的病理机制中起着重要作用。另一方面,ALI时TNF-α和IL-8的mRNA表达不仅出现在肺组织中,同时也出现在肝、肾、心组织 ,这就从基因表达上证实ALI是MODS的一部分。
, 百拇医药
654-2是我国医学科学工作者于1965年4月从植物中提取的一种生物碱类药物,目前临床广泛用于治疗感染性休克、解痉、改善微循环和防治缺血再灌注损伤等。80年代以来用于防治ALI,显示出良好的保护作用[2,3],但确切机制不明。笔者采用654-2防治创伤性ALI取得较好效果,兔呼吸困难和肺水肿明显改善,PaO2获得较好恢复,肺组织病变明显减轻,说明654-2可减轻创伤所致的
ALI。同时发现应用654-2后血浆及BALF中TNF-α及IL-8含量均明显降低,可能是654-2发挥抗炎、保护细胞膜结构和减轻肺损伤等重要药理作用所致。654-2能减轻TNF-α mRNA和IL-8 mRNA在肺、肝、肾、心组织内的表达,说明654-2对ALI的预防和治疗作用是通过改变TNF-α和IL-8的基因表达来起作用的,但对其机制尚需作进一步的研究。
本课题受国家自然科学基金资助(No.39770736)
, 百拇医药
参考文献
[1]Baker CC, Oppenheimer L, Stephens R, et al. Epidemiology of trauma deaths. Am J Surg, 1980, 140∶144-150.
[2]管用东,黄雄庆,陈秉学,等.山莨菪碱对ARDS的氧输送及血流动力学改变的作用.中华麻醉学杂志, 1996,16∶263-265.
[3]胡建才,刘维永,梁继河,等.肿瘤坏死因子和白介素-6在肺挫伤致急性呼吸窘迫综合征中的变化及意义.解放军医学杂志, 1997,22∶287-288.
[4]Spooner CE, Markowttz NP, Saravolatz LD, et al. The role of tumor necrosis factor in sepsis. Clinical Immunology and Immunopathology, 1992, 62(Suppl)∶S11-S17.
, 百拇医药
[5]Cerami A. Inflammatory cytokines. Clinical Immunology and Immunopathology, 1992, 62(Suppl)∶S3-S10.
[6]Fujishima S, Aikawa N. Neutrophil-mediated tissue injury and its modulation. Intensive Care Med, 1995, 21∶277-285.
[7]Donnelly SC, Strieter RM, Kunkel SL, et al. Interleukin-8 and development of adult respiratory distress syndrome in risk patient group. Lancet, 1993, 341∶643-649.
[8]Fujishima S, Saaki JI, Shinozawa Y, et al. Interleukin-8 in ARDS. Lanct, 1993, 342∶237-243.
(收稿:1997-03-24 修回:1998-06-01), 百拇医药