牛血浆纤维粘连蛋白对培养的鼠牙乳头组织的影响
作者:汪平 史俊南 郝建军
单位:710032 西安,第四军医大学口腔医学院
关键词:纤连蛋白;细胞分化;牙胚;器官培养
中华口腔医学杂志/980513 【摘要】 目的 观察牛血浆纤维粘连蛋白(fibronectin, FN)对牙乳头组织及细胞的作用。方法 对大鼠牙乳头和牙胚组织进行器官培养,实验组将微孔滤膜用80mg/L FN液浸润2h,然后将牙乳头组织置薄膜上培养3、6天,同时设对照组,牙胚培养3、6、9天,常规组织学染色。结果 牙胚在体外可有成牙本质细胞分化和前期牙本质的形成。实验组于牙乳头组织和滤膜交界处出现极化细胞,而对照组则未出现上述现象。结论 FN参与了成牙本质细胞的极化过程。
Effect of bovine plasma fibronectin on rat papilla cells in vitro
, http://www.100md.com
Wang Ping, Shi Junnan, Hao Jianjun. College of Stomatology, the Fourth Millitary Medical University, Xi'an 710032
【Abstract】 Objective To observe the effect of exogenous fibronectin (FN) on the rat dental papilla tissues and cells.Methods Tooth germs of first mandibular molars obtained from 17-day-old rat (SD) embryos were cultured for 3,6,9 days on millipore filters in DMEM supplemented with 10% FCS, 50mg/L Vitamin c. The dental papilla were isolated by trypsin treatment of homologous tooth germs and cultured on uncoated (control) and FN coated millipore filters for 3,6 days, bovine plasma FN deposited on millpore filters by treated for 2 hours with 80mg/L FN.Results As shown by histological and cytological data, some mesenchymal cells differentiated into odontoblasts and deposited predentine in cultured tooth germs. In cultured dental papillas, polarized functional cells were observed in FN coated group, odontoblast-like cells never differentiated in control cultures.Conclusion FN may be involved in odontoblast polarization.
, 百拇医药
【Key words】 Fibronectin Cell differentiation Tooth germ Organ culture
牙齿发育阶段,胚胎性上皮组织的细胞与间充质细胞之间,存在着某种信息传递的相互作用,将两类分离的胚胎性组织在体外培养或体内进行移植实验,是观察组织诱导作用的主要方法。我们对大鼠牙乳头和牙胚进行器官培养,观察牛血浆纤维粘连蛋白(fibronectin, FN)对牙乳头组织及细胞的作用。
材料和方法
1.实验材料:DMEM培养液(Dubecco's Modified Eagle Medium, Giboo, USA); 小牛血清(简称FCS,汉中卫生学校);胰蛋白酶(上海生化试剂厂);牛血浆FN、L-Vitc(Sigma, USA)。
2.鼠牙胚的获取:将怀孕17天的SD母鼠(将未怀孕的母鼠与公鼠混合,第2天取出公鼠,选择怀孕母鼠并计算孕期)拉颈处死,取出鼠胚胎,置75%乙醇中消毒10s,无菌条件下用挖匙取出鼠胚胎的下颌第一磨牙,置含10% FCS的DMEM液中保存。
, 百拇医药
3.组织的分离:牙乳头和成釉器用含1%胰蛋白酶(1∶250)的DMEM液消化20min,机械分离牙乳头组织和成釉器,然后将牙乳头用DMEM液反复冲洗数次备用。
4.组织的体外培养:在24孔培养板中培养,每孔培养液(10%FCS+DMEM+50mg/L VitC)为1ml,培养条件为37℃,5%CO2,95%空气,牙乳头组织置于0.45μm孔径的微孔滤膜上,微孔滤膜用不锈钢网架置于气-液界面上,液体每3天换1次,分别培养3天、6天。
5.实验分组:①实验组:将微孔滤膜用80mg/L的FN液浸润2h。将分离的牙乳头置膜上培养,每孔5个牙乳头块,共2孔。②对照组:微孔滤膜不做任何处理,每孔5个牙乳头,共2孔。③完整牙胚培养组:共3孔,分别培养3、6、9天。
6.取材:终止培养的鼠牙胚和牙乳头组织用4%多聚甲醛液固定(pH 7.3),石蜡包埋并做连续切片,每片厚6μm,连续切4~6张为一组。极化细胞出现的标准:组织块至少有4个细胞在至少4个连续的切片上[1]。
, 百拇医药
结果
1.鼠牙胚的体外发育:牙胚培养开始时,胚胎磨牙处于帽状期;培养3天,有前期成牙本质细胞出现;培养6天,有成牙本质细胞出现;培养9天除有成牙本质细胞分化外,还有类似前期成牙本质的基质形成(图1)。
2.牙乳头组织培养观察:①实验组:在培养3天、6天的标本中,各有3个标本在与培养的组织相粘附的滤膜上出现成牙本质细胞样细胞,细胞核面积大而偏极,但滤膜未见基质沉积(图2)。②对照组:所有的样本均只见数层乳头间质细胞,未见成牙本质细胞样细胞出现(图3)。
讨论
一、用于诱导实验的牙乳头组织块培养
成牙本质细胞的分泌是由内釉上皮-乳头间质之间的一系列相关变化引起的,这种变化包括间质、生长因子及细胞之间的信号联系[2]。成牙本质细胞分化必须通过基底膜来引发,单独培养的牙乳头细胞不会分化为成牙本质细胞样细胞,而将内釉上皮与乳头间质重组后,则又可形成成牙本质细胞[3]。本实验证实:体外培养的牙乳头细胞在无基底膜存在的条件下,无成牙本质细胞样细胞出现。
, 百拇医药
牙乳头组织培养是研究影响细胞分化因子的有效模型,一般选择17~19天怀孕鼠的胚胎下颌第一磨牙为实验材料,17天鼠胚的下颌第一磨牙出现正在分化的前期成牙本质细胞,但还未出现极化;18、19天鼠胚的下颌第一磨牙有少许极化成牙本质细胞出现,此时是观察细胞分化和极化的最佳时期。本实验的牙胚培养对照实验也证实了这一点。
二、FN与牙乳头细胞分化的关系
FN在成牙本质细胞分化过程中的分布变化,表明它与细胞分化过程有关。细胞分化包括细胞伸长、核偏极、细胞顶端分泌前期牙本质基质,细胞的形态改变显示细胞骨架蛋白的重新排列。FN又称细胞外骨架,可能通过胞膜受体与细胞骨架形成跨膜连接,从而对细胞器和酶分子进行空间排列[4]。
一些实验也间接证明FN对成牙本质细胞的分化有重要作用。Lesot等[5]发现牙乳头细胞含有163.7×10μ的FN受体,在牙胚的培养液中加此受体抗体则阻滞了细胞极化。Cam等[6]将含有FN的牙乳头胞外基质沉积于微孔滤膜上,则体外培养的18天鼠胚牙乳头出现极化细胞。Tziafas等[1]认为糖胺聚糖(glycos aminoglycan)可保持体外培养牙乳头细胞处于极化状态,可能是因为它与FN相互作用,导致FN激活状态的形成和分布。本组证实:FN不仅可以促进前期成牙本质细胞分化为成牙本质细胞,并可保持其处于极化状态。
, 百拇医药
本组牙乳头组织块于含10%FCS的DMEM液中培养,细胞功能的发挥需要外源性血清携带的因子来调控,血清中含有一定量的FN。Lesot等[7]用125I-FN与鼠牙乳头组织孵育,表明FN与培养的牙乳头组织结合是短暂的。孵育6h后,组织结合的核素逐步被释放,新分泌的FN代替了血浆FN,因此,培养液中的FN可能对组织中细胞分化所起的作用有限,主要是滤膜上FN的作用。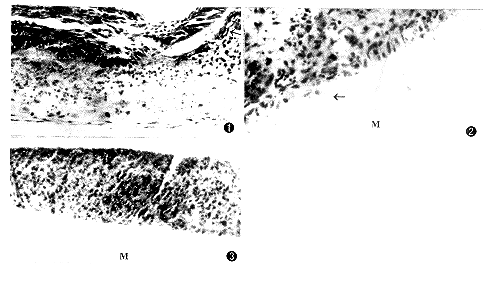
图1 培养9天的鼠牙胚,有极化成牙本质细胞出现(↑)(HE×400) 图2 FN组培养3天的鼠牙乳头组织,薄膜侧(M)细胞出现极化(↑)(HE×400) 图3 对照组培养6天的鼠牙乳头组织,薄膜侧(M)未见极化细胞出现(HE×400)
参考文献
1 Tziafas D, Amer S, Staubli A, et al. Effects of glycosaminoglycans on in vitro mouse dental cells. Arch Oral Biol, 1988, 33:735-740.
, 百拇医药
2 Slavkin HC. Molecular determinants during dental morphogenesis and cytodifferentiation: a review. J Craniofac Genet Dev Biol, 1991,11:338-349.
3 Thesleff I, Hurmerinta K. Tissue Interactions in tooth development. Differentiation, 1981, 18:75-88.
4 Lesot H, Fausser JL, Akiyama SK, et al. The carboxy-terminal extension of the collagen binding domain of fibronectin mediates interaction with a 165 kDa membrane protein involved in odontoblast differentiation. Differentiation, 1992, 49:109-118.
, 百拇医药
5 Lesot H, Karcher-Djuricic V, Kubler MD, et al. Membrane-cytoskeletion interactions: inhibition of odontoblast differentiation by a monoclonal antibody directed against a membrame protein. Differentiation, 1988, 37:62-72.
6 Cam Y, Meyer JM, Staubli A, et al. Epithelial-mesenchymal interactions: effects of a dental biomatrix on odontoblasts. Arch Anat Microsc Morphol Exp, 1986-87, 75:75-89.
7 Lesot H, Karcher-Djuricic V, Mark M, et al. Dental cell interaction with extracellular-matrix constiuents: type-I collagen and fibronectin. Differentiation, 1985, 29:176-181.
(收稿:1996-12-03 修回:1998-04-09), http://www.100md.com
单位:710032 西安,第四军医大学口腔医学院
关键词:纤连蛋白;细胞分化;牙胚;器官培养
中华口腔医学杂志/980513 【摘要】 目的 观察牛血浆纤维粘连蛋白(fibronectin, FN)对牙乳头组织及细胞的作用。方法 对大鼠牙乳头和牙胚组织进行器官培养,实验组将微孔滤膜用80mg/L FN液浸润2h,然后将牙乳头组织置薄膜上培养3、6天,同时设对照组,牙胚培养3、6、9天,常规组织学染色。结果 牙胚在体外可有成牙本质细胞分化和前期牙本质的形成。实验组于牙乳头组织和滤膜交界处出现极化细胞,而对照组则未出现上述现象。结论 FN参与了成牙本质细胞的极化过程。
Effect of bovine plasma fibronectin on rat papilla cells in vitro
, http://www.100md.com
Wang Ping, Shi Junnan, Hao Jianjun. College of Stomatology, the Fourth Millitary Medical University, Xi'an 710032
【Abstract】 Objective To observe the effect of exogenous fibronectin (FN) on the rat dental papilla tissues and cells.Methods Tooth germs of first mandibular molars obtained from 17-day-old rat (SD) embryos were cultured for 3,6,9 days on millipore filters in DMEM supplemented with 10% FCS, 50mg/L Vitamin c. The dental papilla were isolated by trypsin treatment of homologous tooth germs and cultured on uncoated (control) and FN coated millipore filters for 3,6 days, bovine plasma FN deposited on millpore filters by treated for 2 hours with 80mg/L FN.Results As shown by histological and cytological data, some mesenchymal cells differentiated into odontoblasts and deposited predentine in cultured tooth germs. In cultured dental papillas, polarized functional cells were observed in FN coated group, odontoblast-like cells never differentiated in control cultures.Conclusion FN may be involved in odontoblast polarization.
, 百拇医药
【Key words】 Fibronectin Cell differentiation Tooth germ Organ culture
牙齿发育阶段,胚胎性上皮组织的细胞与间充质细胞之间,存在着某种信息传递的相互作用,将两类分离的胚胎性组织在体外培养或体内进行移植实验,是观察组织诱导作用的主要方法。我们对大鼠牙乳头和牙胚进行器官培养,观察牛血浆纤维粘连蛋白(fibronectin, FN)对牙乳头组织及细胞的作用。
材料和方法
1.实验材料:DMEM培养液(Dubecco's Modified Eagle Medium, Giboo, USA); 小牛血清(简称FCS,汉中卫生学校);胰蛋白酶(上海生化试剂厂);牛血浆FN、L-Vitc(Sigma, USA)。
2.鼠牙胚的获取:将怀孕17天的SD母鼠(将未怀孕的母鼠与公鼠混合,第2天取出公鼠,选择怀孕母鼠并计算孕期)拉颈处死,取出鼠胚胎,置75%乙醇中消毒10s,无菌条件下用挖匙取出鼠胚胎的下颌第一磨牙,置含10% FCS的DMEM液中保存。
, 百拇医药
3.组织的分离:牙乳头和成釉器用含1%胰蛋白酶(1∶250)的DMEM液消化20min,机械分离牙乳头组织和成釉器,然后将牙乳头用DMEM液反复冲洗数次备用。
4.组织的体外培养:在24孔培养板中培养,每孔培养液(10%FCS+DMEM+50mg/L VitC)为1ml,培养条件为37℃,5%CO2,95%空气,牙乳头组织置于0.45μm孔径的微孔滤膜上,微孔滤膜用不锈钢网架置于气-液界面上,液体每3天换1次,分别培养3天、6天。
5.实验分组:①实验组:将微孔滤膜用80mg/L的FN液浸润2h。将分离的牙乳头置膜上培养,每孔5个牙乳头块,共2孔。②对照组:微孔滤膜不做任何处理,每孔5个牙乳头,共2孔。③完整牙胚培养组:共3孔,分别培养3、6、9天。
6.取材:终止培养的鼠牙胚和牙乳头组织用4%多聚甲醛液固定(pH 7.3),石蜡包埋并做连续切片,每片厚6μm,连续切4~6张为一组。极化细胞出现的标准:组织块至少有4个细胞在至少4个连续的切片上[1]。
, 百拇医药
结果
1.鼠牙胚的体外发育:牙胚培养开始时,胚胎磨牙处于帽状期;培养3天,有前期成牙本质细胞出现;培养6天,有成牙本质细胞出现;培养9天除有成牙本质细胞分化外,还有类似前期成牙本质的基质形成(图1)。
2.牙乳头组织培养观察:①实验组:在培养3天、6天的标本中,各有3个标本在与培养的组织相粘附的滤膜上出现成牙本质细胞样细胞,细胞核面积大而偏极,但滤膜未见基质沉积(图2)。②对照组:所有的样本均只见数层乳头间质细胞,未见成牙本质细胞样细胞出现(图3)。
讨论
一、用于诱导实验的牙乳头组织块培养
成牙本质细胞的分泌是由内釉上皮-乳头间质之间的一系列相关变化引起的,这种变化包括间质、生长因子及细胞之间的信号联系[2]。成牙本质细胞分化必须通过基底膜来引发,单独培养的牙乳头细胞不会分化为成牙本质细胞样细胞,而将内釉上皮与乳头间质重组后,则又可形成成牙本质细胞[3]。本实验证实:体外培养的牙乳头细胞在无基底膜存在的条件下,无成牙本质细胞样细胞出现。
, 百拇医药
牙乳头组织培养是研究影响细胞分化因子的有效模型,一般选择17~19天怀孕鼠的胚胎下颌第一磨牙为实验材料,17天鼠胚的下颌第一磨牙出现正在分化的前期成牙本质细胞,但还未出现极化;18、19天鼠胚的下颌第一磨牙有少许极化成牙本质细胞出现,此时是观察细胞分化和极化的最佳时期。本实验的牙胚培养对照实验也证实了这一点。
二、FN与牙乳头细胞分化的关系
FN在成牙本质细胞分化过程中的分布变化,表明它与细胞分化过程有关。细胞分化包括细胞伸长、核偏极、细胞顶端分泌前期牙本质基质,细胞的形态改变显示细胞骨架蛋白的重新排列。FN又称细胞外骨架,可能通过胞膜受体与细胞骨架形成跨膜连接,从而对细胞器和酶分子进行空间排列[4]。
一些实验也间接证明FN对成牙本质细胞的分化有重要作用。Lesot等[5]发现牙乳头细胞含有163.7×10μ的FN受体,在牙胚的培养液中加此受体抗体则阻滞了细胞极化。Cam等[6]将含有FN的牙乳头胞外基质沉积于微孔滤膜上,则体外培养的18天鼠胚牙乳头出现极化细胞。Tziafas等[1]认为糖胺聚糖(glycos aminoglycan)可保持体外培养牙乳头细胞处于极化状态,可能是因为它与FN相互作用,导致FN激活状态的形成和分布。本组证实:FN不仅可以促进前期成牙本质细胞分化为成牙本质细胞,并可保持其处于极化状态。
, 百拇医药
本组牙乳头组织块于含10%FCS的DMEM液中培养,细胞功能的发挥需要外源性血清携带的因子来调控,血清中含有一定量的FN。Lesot等[7]用125I-FN与鼠牙乳头组织孵育,表明FN与培养的牙乳头组织结合是短暂的。孵育6h后,组织结合的核素逐步被释放,新分泌的FN代替了血浆FN,因此,培养液中的FN可能对组织中细胞分化所起的作用有限,主要是滤膜上FN的作用。

图1 培养9天的鼠牙胚,有极化成牙本质细胞出现(↑)(HE×400) 图2 FN组培养3天的鼠牙乳头组织,薄膜侧(M)细胞出现极化(↑)(HE×400) 图3 对照组培养6天的鼠牙乳头组织,薄膜侧(M)未见极化细胞出现(HE×400)
参考文献
1 Tziafas D, Amer S, Staubli A, et al. Effects of glycosaminoglycans on in vitro mouse dental cells. Arch Oral Biol, 1988, 33:735-740.
, 百拇医药
2 Slavkin HC. Molecular determinants during dental morphogenesis and cytodifferentiation: a review. J Craniofac Genet Dev Biol, 1991,11:338-349.
3 Thesleff I, Hurmerinta K. Tissue Interactions in tooth development. Differentiation, 1981, 18:75-88.
4 Lesot H, Fausser JL, Akiyama SK, et al. The carboxy-terminal extension of the collagen binding domain of fibronectin mediates interaction with a 165 kDa membrane protein involved in odontoblast differentiation. Differentiation, 1992, 49:109-118.
, 百拇医药
5 Lesot H, Karcher-Djuricic V, Kubler MD, et al. Membrane-cytoskeletion interactions: inhibition of odontoblast differentiation by a monoclonal antibody directed against a membrame protein. Differentiation, 1988, 37:62-72.
6 Cam Y, Meyer JM, Staubli A, et al. Epithelial-mesenchymal interactions: effects of a dental biomatrix on odontoblasts. Arch Anat Microsc Morphol Exp, 1986-87, 75:75-89.
7 Lesot H, Karcher-Djuricic V, Mark M, et al. Dental cell interaction with extracellular-matrix constiuents: type-I collagen and fibronectin. Differentiation, 1985, 29:176-181.
(收稿:1996-12-03 修回:1998-04-09), http://www.100md.com