蛋白激酶C在非心脏器官预处理中的作用
作者:刘秀华 王士雯 武旭东 苏静怡 唐朝枢
单位:100853 北京,中国人民解放军总医院老年心血管病研究所(刘秀华、王士雯、武旭东),北京医科大学心血管基础研究所(苏静怡、唐朝枢)
关键词:蛋白激酶C;再灌流损伤;细胞
中华医学杂志980609 【摘要】 目的 探讨蛋白激酶C(PKC)在心脏以外组织器官缺血或缺氧预处理(PC)保护中的作用及其机理。方法 分别在原位灌流的大鼠小肠、肢体缺血再灌注模型和培养的大鼠胸主动脉血管平滑肌细胞(VSMC)缺氧复氧模型上观察PKC对于器官缺血或细胞缺氧PC作用的影响。结果 PKC抑制剂H7和多粘菌素B完全消除缺血PC对小肠和肢体的保护作用;缺氧PC激活VSMC内PKC,并使PKC介导的蛋白磷酸化反应加强。结论 PKC激活是心脏以外组织器官PC保护的重要环节,其机制可能与底物蛋白的磷酸化有关。
, http://www.100md.com
Effects of protein kinase C on non-heart organ protection of preconditioning Liu Xiuhua, Wang Shiwen, Wu Xudong, et al. Institute of Geriatric Cardiology, PLA General Hospital, Beijing 100853
【Abstract】 Objective To investigate the effects of protein kinase C (PKC) on ischemic (hypoxic) preconditioning (PC) in the non-heart organs and tissue. Methods In the models of ischemia/reperfusion of in situ perfused rat small intestine, limb, and in the model of hypoxia/ reoxygenation of cultured rat aortic vascular smooth muscle cells (VSMC), the effects of PKC on ischemic (hypoxic) PC were observed. Results PKC inhibitor H7 and polymyxin B completely abolished the protective effects of ischemic PC on small intestine and limb subjected to ischemia/ reperfusion injury. Hypoxic PC activated PKC in VSMC and potentiated phosphorylation mediated by PKC. Conclusion The activation of PKC is also the important chain of PC on non-heart organs, and its mechanism might involve protein phosphorylation.
, 百拇医药
【Key words】 Protein kinase C Reperfusion injury Cell
(Natl Med J China, 1998, 78:426-429)
近年来发现,缺血预处理(preconditioning, PC)不仅存在于心脏及心肌细胞,亦存在于其它器官和组织细胞[1]。但其保护机理是否与心脏PC的保护机理相同,目前尚不清楚。我们分别在大鼠小肠、肢体的缺血再灌注(ischemia/reperfusion, I/R)模型和培养的大鼠胸主动脉血管平滑肌细胞(vascular smooth muscle cells, VSMC)缺氧复氧(hypoxia/reoxygenation,H/R)模型上观察蛋白激酶C (protein kinase C, PKC)在上述器官和细胞缺血(缺氧)PC保护中的作用,并探讨其保护机理。
材料与方法
, http://www.100md.com
一、 材料
Wistar大鼠由北京医科大学动物部提供,H7、多粘菌素 B(PB)、PKC片段(530~558)、Okadiac Acid等均为美国Sigma公司产品。[γ32P]ATP为美国Dupont NEN公司产品(放射比强度1.1×105 GBq/mmol )。32P正磷酸钠为中国原子能研究所产品(放射比强度为26×37mBq/ml),余为市售分析纯产品。
二、方法
1.PKC对大鼠原位灌流小肠缺血PC的影响:体重200~250 g健康雄性Wistar大鼠,参照文献[2]的方法复制肠系膜上动脉(SMA)原位灌流I/R模型。预灌注10分钟后随机分为6组(每组6只鼠):(1) 缺血再灌注(I/R)组:停灌SMA 1小时、复灌15分钟结束实验。(2) 预处理(PC)组:预先停、复灌SMA各5分钟,反复3轮后按(1)组程序操作。(3) H7+PC组、(4) PB+PC组操作同(2)组,但于PC的第3轮再灌注液中分别加入PKC抑制剂H7(40 μmol/L)或PB(0.48mg/L)。(5) PB+I/R组:操作同(1)组,但预灌注最后5分钟灌注液中含有PB(0.48 mg/L)。(6) 对照组:持续K-H液灌注75分钟。收集再灌注期间流出液测定乳酸脱氢酶(LDH)和组织蛋白酶(CD)活性[3];硫代巴比妥酸法测定肠组织脂质过氧化产物丙二醛(MDA)含量。
, 百拇医药
2.PKC对大鼠肢体缺血PC的影响:按文献[4]方法复制大鼠肢体原位灌流模型,预灌注10分钟后随机分为5组:(1) I/R组:停灌股动脉4小时、复灌2小时结束实验。(2) PC组:预先停/复灌股动脉各5分钟,反复3轮,然后按(1)组程序操作。(3)、(4)组分别为H7+PC组和PB+PC组:操作同(2)组,但在PC的末次灌流液中分别加入H7 (40 μmol/L)和PB(0.48 mg/L)。(5) 对照组:持续灌注K-H液6小时。分别收集再灌注期间流出液测定LDH、CD活性,结束实验时取腓肠肌组织备测MDA和组织湿干重比值。
3.PKC对培养的大鼠胸主动脉VSMC缺氧PC的影响:以贴块法[5]进行VSMC培养,用第4~6代细胞常规处理后进行实验:(1) 缺氧PC对VSMC缺氧复氧损伤的影响:实验分为6组:① 缺氧复氧(H/R)组:将细胞缺氧孵育2小时,复氧孵育1小时[6]。② 缺氧PC组:细胞进行20分钟预缺氧后再按①组程序进行H/R操作。③、④组分别为H7+PC组和PB+PC组:预先分别以H7或PB预孵育VSMC 10分钟,再按②组程序依次进行PC和H/R操作。⑤ PMA+H/R组:细胞以PKC激动剂PMA(100 nmol/L)预孵育10分钟后再进行H/R操作。⑥对照组:细胞持续置培养箱孵育。结束实验时测定培养液中LDH活性,以台盼蓝排斥法计算细胞存活率[6]。(2) 模拟缺氧PC的短暂缺氧对VSMC 32 P掺入和PKC活性的影响:实验分为3组(每组6只鼠):① 短暂缺氧(transient hypoxia, TH)组:细胞缺氧孵育20分钟。② H7+TH组:以H7 (40 μmol/L)预孵育10分钟后按①组程序操作。③对照组:细胞持续孵育20分钟。经上述处理后细胞以32P正磷酸钠(3.7×103kBq/孔)标记后,测定32P参入量及细胞总PKC活性[7]。(3) 短暂缺氧对VSMC蛋白磷酸化的影响:按上述方法将细胞分为TH、H7+TH和对照组,分别操作后加入32P正磷酸钠(3.7×103kBq/孔)标记细胞,经洗涤、溶解后作十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)电泳[8],胶板经固定、染色、脱色后切割成0.5 cm宽,在β液闪仪上测定各条带蛋白参入的32P放射活性。(4) 去磷酸化反应对VSMC缺氧PC的影响:实验分7组:①、②、③组分别为H/R、PC和对照组(操作同(1)),④、⑤组分别为OA+PC组和BDM+PC组,于预处理前分别向实验各孔加入蛋白磷酸酶抑制剂okadaic acid (OA,2 μmol/L)或2,3-二乙酰一肟(BDM,20 mmol/L)预孵育10分钟后依次进行PC和H/R;⑥、⑦组分别为OA+H/R和BDM+H/R组,于H/R前分别向实验各孔中加入OA (2 μmol/L)或BDM(20 mmol/L)预孵育10分钟后进行H/R。结束实验时,取培养液测定LDH活性,计算细胞存活率,以高效液相法测定细胞内ATP含量。
, http://www.100md.com
三、统计学处理
实验结果以均数±标准差表示,以单因素方差分析和组间q检验作统计学处理。
结果
一、 PKC激活参与缺血PC对大鼠小肠缺血再灌注损伤的保护
小肠组织I/R损伤表现为LDH、CD大量漏出和肠道组织脂质过氧化产物MDA含量升高。预处理则减轻了I/R造成的上述损伤,其胞浆酶LDH和溶酶体酶CD漏出分别比I/R组低36%和74%(P<0.01),组织MDA含量比I/R组低81%(P<0.01)。PKC抑制剂PB和H7消除了PC的保护作用,其流出液中LDH和CD活性及组织中MDA含量均比PC组升高(P<0.01),而接近单纯I/R组(P>0.05)。但PB对单纯I/R组动物小肠LDH、CD漏出及MDA含量并无明显影响(P>0.05)(表1)。
, http://www.100md.com
表1 蛋白激酶C对大鼠小肠缺血PC作用的影响( ±s) 组别
±s) 组别
鼠数
门静脉流出液
肠组织丙二醛
(nmol/g
干重组织)
乳酸脱氢酶
(U/L)
组织蛋白酶D
(U/L)
对照组
, 百拇医药
6
59±12
19±11
97±31
缺血再灌注组
6
414± 8**
96± 6*
929±59**
预处理组
6
266±85▲▲
, 百拇医药
25± 4▲▲
178±51▲▲
PB+预处理组
6
482±60△△
45±12△△
643±11△△
H7+预处理组
6
435±84△△
51±12△△
, 百拇医药
799±11△△
PB+缺血再灌注组
6
430±93▲▲
97±18▲▲
652±96▲▲
注:与对照组比较:* P<0.05,** P<0.01;与缺血再灌注(或缺氧复氧)组比较:▲ P<0.05,▲▲P<0.01;与预处理组比较:△ P<0.05,△△P<0.01.以下表注相同.
二、 PKC激活参与缺血PC对大鼠肢体缺血再灌注损伤的保护
, 百拇医药
I/R造成大鼠肢体组织LDH和CD大量漏出,腓肠肌组织MDA集聚和组织水肿(组织湿干重比值增加);预处理明显减轻了I/R造成的组织损伤,其LDH和CD漏出分别比I/R组低41%和39%(P<0.01),组织MDA含量和湿干重比值较I/R组分别低26%(P<0.01)和21%(P<0.05)。PB和H7消除了PC的上述保护作用(表2)。
表2 蛋白激酶C对大鼠肢体缺血PC保护
作用的影响( ±s) 组别
±s) 组别
鼠数
股静脉流出液
腓肠肌组织
乳酸脱
, http://www.100md.com
氢酶
(U/L)
组织蛋
白酶D
(U/L)
丙二醛
(nmol/g
干重组织)
组织湿
干重比值
对照组
6
108± 6
, 百拇医药
16± 6
48±18
2.5±0.4
缺血再灌注组
6
413±49**
65±32*
70±18*
3.2±0.4**
预处理组
6
242±41▲▲
, 百拇医药
39±23▲▲
52±15▲
2.5±0.2▲
PB+预处理组
6
416±74△△
63±23△△
67±13△
3.2±0.3△
H7+预处理组
, 百拇医药
6
410±53△△
47±22△
72±11△
3.1±0.4△
三、 PKC激活及其介导的蛋白磷酸化参与VSMC缺氧PC的保护
1.PKC参与缺氧PC对VSMC缺氧复氧损伤的保护作用:缺氧复氧造成细胞存活率明显下降并有大量LDH和蛋白漏出;缺氧PC明显减轻上述损伤,细胞存活率比H/R组高50%(P<0.01),细胞LDH和蛋白漏出比H/R组分别低45%和22%(P<0.01)。以PKC激动剂PMA预孵育明显提高H/R后细胞存活率,并减少培养液中LDH和蛋白漏出,以上结果均接近缺氧PC组(P>0.05)。反之,以H7、PB预孵育,完全消除了缺氧PC的上述保护作用(表3)。
, http://www.100md.com
表3 蛋白激酶C在大鼠VSMC缺氧PC中的作用( ±s)
±s)
组别
鼠数
细胞存
活率(%)
培养液
乳酸脱氢
酶(U/L)
蛋白质
(mg/L)
对照组
, http://www.100md.com
6
92±3
105±6
110±10
缺氧复氧组
6
57±6**
764±12**
200±10**
预处理组
6
85±3▲▲
, 百拇医药
422±10▲▲
150±10▲▲
H7+预处理组
6
67±4△△
800±17△△
170±30△
PMA+缺氧复氧组
6
84±2▲▲
503±7▲▲
, 百拇医药
140±20▲
2.模拟缺氧预处理的短暂缺氧激活VSMC的PKC:模拟缺氧PC的短暂(20分钟)缺氧使VSMC的PKC活性升高1倍,H7完全消除了短暂缺氧所致的PKC激活,其PKC活性仅为TH组的54%(图1)。
3.模拟缺氧PC的短暂缺氧使VSMC内蛋白磷酸化加强:VSMC溶解液电泳各条带蛋白32P掺入测定结果表明,模拟缺氧PC的短暂缺氧(TH组)刺激了VSMC内71 000和31 000两个蛋白条带的磷酸化,其放射活性比对照组分别高27%和64%(P<0.01),H7则明显抑制这两个区带蛋白磷酸化的程度(图2)。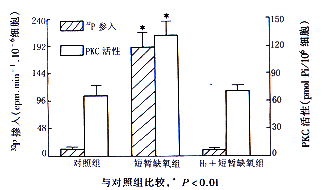
图1 模拟缺氧PC的短暂缺氧对VSMC PKC活性的影响
, http://www.100md.com
电泳后凝胶板切割片段数与对照组比较,* P<0.01
图2 模拟缺氧PC的短暂缺氧对VSMC蛋白磷酸化的影响
4.蛋白去磷酸化对VSMC缺氧PC的影响:缺氧复氧降低细胞存活率及ATP含量并使LDH漏出。缺氧PC明显减轻上述H/R损伤;H/R前以磷酸酶抑制剂OA预孵育,使H/R后细胞存活率及细胞内ATP含量分别比H/R组高18%和30%,培养液中LDH活性比H/R组低21%,上述各指标与PC组比较,差异无显著意义(P>0.05)。PC前给予磷酸酶激动剂BDM则完全消除了PC的上述保护作用(表4)。
表4 蛋白去磷酸化对大鼠VSMC缺氧PC的影响( ±s)
±s)
组别
, 百拇医药
鼠
数
细胞
培养液中乳酸
脱氢酶(U/L)
ATP(nmol/106
细胞数)
存活率
(%)
对照组
6
8.7±1.0
93± 2
, 百拇医药
56± 11
缺氧复氧组
6
4.0±1.0**
57± 4**
352±108**
预处理组
6
5.5±0.7▲
75± 6▲▲
221± 65▲▲
, 百拇医药
OA+预处理组
6
5.2±0.9
80± 5
234± 77
OA+缺氧复氧组
6
5.2±0.7▲
67±10▲
276± 64▲
BDM+预处理组
6
, 百拇医药
3.9±0.8△
61± 6△
324± 94△
BDM+缺氧复氧组
6
4.0±0.5
53± 4
306± 41
讨论
大量实验资料表明,缺血PC明显减轻心脏I/R损伤,表现为缩小心肌梗塞面积、减少心律失常发生和改善心肌收缩功能等[9]。近年发现,缺血PC的保护作用不仅存在于心脏及心肌细胞,而且对于脑、小肠、肝脏及肢体等器官的I/R损伤和培养的血管内皮及VSMC的H/R损伤亦具有保护作用[1]。本实验分别在原位灌流的大鼠小肠、肢体I/R模型上观察到缺血PC可以减轻I/R所造成的组织损伤,表现为胞浆酶LDH和溶酶体酶CD的漏出减少,脂质过氧化物MDA生成及组织水肿程度减轻;在培养的大鼠VSMC的H/R模型上观察到缺氧PC可以提高VSMC存活率、减少LDH漏出和ATP消耗等。表明缺血PC对心脏外器官及细胞亦有普遍的保护,与文献报道一致[1]。
, 百拇医药
PC的保护机理非常复杂,涉及多种因素及其相互作用。实验证实PKC激活与转位是心脏缺血PC保护机理的共同通路[9]。我们分别在原位灌流的大鼠小肠和肢体I/R模型上观察到,PKC抑制剂多粘菌素B和H7完全消除缺血PC对I/R损伤的保护作用;并在培养的大鼠VSMC上观察到PKC激动剂PMA能模拟、而PKC抑制剂H7完全消除缺氧PC对VSMC的保护作用,且缺氧PC激活VSMC内PKC;提示PKC的激活对于心脏以外组织细胞的PC保护作用亦具有重要作用,可能是PC保护作用的共同机理之一。
PKC是细胞内一类催化含丝氨酸、苏氨酸残基蛋白磷酸化的蛋白激酶,在机体的机能代谢调节中具有重要作用。但PC激活PKC后如何发挥保护作用目前尚不清楚。我们在培养的大鼠VSMC上观察到模拟缺氧PC的短暂缺氧能诱导VSMC内71 000和31 000蛋白条带的磷酸化加强,而PKC抑制剂H7则完全消除这种效应;应用蛋白磷酸酶抑制剂OA能模拟、而蛋白磷酸酶激动剂BDM则完全消除缺氧PC的VSMC保护作用,提示PKC介导的蛋白磷酸化加强可能是PC细胞保护作用的重要环节,这些底物蛋白的性质尚待进一步研究。
, 百拇医药
参考文献
1 刘秀华. 缺血(氧)预处理的普遍性及其临床应用前景. 生理科学进展,1997,28:355-358.
2 Yao CJ, Cousse NF, Zinner MJ. Serotonin and substance P stimulate intestinal secretion in the isolated perfused ileum. Surgery, 1989, 105: 86-92.
3 Su JY, Lefer AM. Beneficial effect of anisodamine in hemorrhagic shock. Naunyn Schmiedberg′s Arch Parmaco., 1984, 325: 360-365.
4 Rosenthal SM. Burns and shock:production of traumatic shock in mice. Public Health Rep, 1943, 58:1429-1433.
, http://www.100md.com
5 Hirata Y, Taragi Y, Takata S. CGRP receptor in cultured vascular smooth muscle and endothelial cells. Biochem Biophys Res Commun. 1988, 15:1113-1120.
6 Webster KA, Discher DJ, Bishopric NH. Cardioprotection in an in vitro model of hypoxic preconditioning. J Mol Cell Cardiol,1995, 27:453-458.
7 Fioraui R, Cantoni O, Tssinato A. Hydrogen peroxide and fetal bovine serum-induced DNA synthesis in vascular smooth muscle cells: positive and negative regulation by protein kinase C isoforms. Biochem Biophys Acta,1995, 1269:98-104.
, 百拇医药
8 Marrero M, Poxton WC, Duff JL, et al. Angiotension II stimulates tyrosine phosphorylation of phospholipase Cγ1 in vascular smooth muscle cells. J Biol Chem, 1994, 269:10935-10939.
9 Ytrehus K, Liu Y, Downey LM. Preconditioning protects ischemic rabbit heart by protein kinase C activation. Am J Physiol, 1994,266:H1145-H1152.
(收稿:1997-10-31 修回:1998-02-16), 百拇医药
单位:100853 北京,中国人民解放军总医院老年心血管病研究所(刘秀华、王士雯、武旭东),北京医科大学心血管基础研究所(苏静怡、唐朝枢)
关键词:蛋白激酶C;再灌流损伤;细胞
中华医学杂志980609 【摘要】 目的 探讨蛋白激酶C(PKC)在心脏以外组织器官缺血或缺氧预处理(PC)保护中的作用及其机理。方法 分别在原位灌流的大鼠小肠、肢体缺血再灌注模型和培养的大鼠胸主动脉血管平滑肌细胞(VSMC)缺氧复氧模型上观察PKC对于器官缺血或细胞缺氧PC作用的影响。结果 PKC抑制剂H7和多粘菌素B完全消除缺血PC对小肠和肢体的保护作用;缺氧PC激活VSMC内PKC,并使PKC介导的蛋白磷酸化反应加强。结论 PKC激活是心脏以外组织器官PC保护的重要环节,其机制可能与底物蛋白的磷酸化有关。
, http://www.100md.com
Effects of protein kinase C on non-heart organ protection of preconditioning Liu Xiuhua, Wang Shiwen, Wu Xudong, et al. Institute of Geriatric Cardiology, PLA General Hospital, Beijing 100853
【Abstract】 Objective To investigate the effects of protein kinase C (PKC) on ischemic (hypoxic) preconditioning (PC) in the non-heart organs and tissue. Methods In the models of ischemia/reperfusion of in situ perfused rat small intestine, limb, and in the model of hypoxia/ reoxygenation of cultured rat aortic vascular smooth muscle cells (VSMC), the effects of PKC on ischemic (hypoxic) PC were observed. Results PKC inhibitor H7 and polymyxin B completely abolished the protective effects of ischemic PC on small intestine and limb subjected to ischemia/ reperfusion injury. Hypoxic PC activated PKC in VSMC and potentiated phosphorylation mediated by PKC. Conclusion The activation of PKC is also the important chain of PC on non-heart organs, and its mechanism might involve protein phosphorylation.
, 百拇医药
【Key words】 Protein kinase C Reperfusion injury Cell
(Natl Med J China, 1998, 78:426-429)
近年来发现,缺血预处理(preconditioning, PC)不仅存在于心脏及心肌细胞,亦存在于其它器官和组织细胞[1]。但其保护机理是否与心脏PC的保护机理相同,目前尚不清楚。我们分别在大鼠小肠、肢体的缺血再灌注(ischemia/reperfusion, I/R)模型和培养的大鼠胸主动脉血管平滑肌细胞(vascular smooth muscle cells, VSMC)缺氧复氧(hypoxia/reoxygenation,H/R)模型上观察蛋白激酶C (protein kinase C, PKC)在上述器官和细胞缺血(缺氧)PC保护中的作用,并探讨其保护机理。
材料与方法
, http://www.100md.com
一、 材料
Wistar大鼠由北京医科大学动物部提供,H7、多粘菌素 B(PB)、PKC片段(530~558)、Okadiac Acid等均为美国Sigma公司产品。[γ32P]ATP为美国Dupont NEN公司产品(放射比强度1.1×105 GBq/mmol )。32P正磷酸钠为中国原子能研究所产品(放射比强度为26×37mBq/ml),余为市售分析纯产品。
二、方法
1.PKC对大鼠原位灌流小肠缺血PC的影响:体重200~250 g健康雄性Wistar大鼠,参照文献[2]的方法复制肠系膜上动脉(SMA)原位灌流I/R模型。预灌注10分钟后随机分为6组(每组6只鼠):(1) 缺血再灌注(I/R)组:停灌SMA 1小时、复灌15分钟结束实验。(2) 预处理(PC)组:预先停、复灌SMA各5分钟,反复3轮后按(1)组程序操作。(3) H7+PC组、(4) PB+PC组操作同(2)组,但于PC的第3轮再灌注液中分别加入PKC抑制剂H7(40 μmol/L)或PB(0.48mg/L)。(5) PB+I/R组:操作同(1)组,但预灌注最后5分钟灌注液中含有PB(0.48 mg/L)。(6) 对照组:持续K-H液灌注75分钟。收集再灌注期间流出液测定乳酸脱氢酶(LDH)和组织蛋白酶(CD)活性[3];硫代巴比妥酸法测定肠组织脂质过氧化产物丙二醛(MDA)含量。
, 百拇医药
2.PKC对大鼠肢体缺血PC的影响:按文献[4]方法复制大鼠肢体原位灌流模型,预灌注10分钟后随机分为5组:(1) I/R组:停灌股动脉4小时、复灌2小时结束实验。(2) PC组:预先停/复灌股动脉各5分钟,反复3轮,然后按(1)组程序操作。(3)、(4)组分别为H7+PC组和PB+PC组:操作同(2)组,但在PC的末次灌流液中分别加入H7 (40 μmol/L)和PB(0.48 mg/L)。(5) 对照组:持续灌注K-H液6小时。分别收集再灌注期间流出液测定LDH、CD活性,结束实验时取腓肠肌组织备测MDA和组织湿干重比值。
3.PKC对培养的大鼠胸主动脉VSMC缺氧PC的影响:以贴块法[5]进行VSMC培养,用第4~6代细胞常规处理后进行实验:(1) 缺氧PC对VSMC缺氧复氧损伤的影响:实验分为6组:① 缺氧复氧(H/R)组:将细胞缺氧孵育2小时,复氧孵育1小时[6]。② 缺氧PC组:细胞进行20分钟预缺氧后再按①组程序进行H/R操作。③、④组分别为H7+PC组和PB+PC组:预先分别以H7或PB预孵育VSMC 10分钟,再按②组程序依次进行PC和H/R操作。⑤ PMA+H/R组:细胞以PKC激动剂PMA(100 nmol/L)预孵育10分钟后再进行H/R操作。⑥对照组:细胞持续置培养箱孵育。结束实验时测定培养液中LDH活性,以台盼蓝排斥法计算细胞存活率[6]。(2) 模拟缺氧PC的短暂缺氧对VSMC 32 P掺入和PKC活性的影响:实验分为3组(每组6只鼠):① 短暂缺氧(transient hypoxia, TH)组:细胞缺氧孵育20分钟。② H7+TH组:以H7 (40 μmol/L)预孵育10分钟后按①组程序操作。③对照组:细胞持续孵育20分钟。经上述处理后细胞以32P正磷酸钠(3.7×103kBq/孔)标记后,测定32P参入量及细胞总PKC活性[7]。(3) 短暂缺氧对VSMC蛋白磷酸化的影响:按上述方法将细胞分为TH、H7+TH和对照组,分别操作后加入32P正磷酸钠(3.7×103kBq/孔)标记细胞,经洗涤、溶解后作十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)电泳[8],胶板经固定、染色、脱色后切割成0.5 cm宽,在β液闪仪上测定各条带蛋白参入的32P放射活性。(4) 去磷酸化反应对VSMC缺氧PC的影响:实验分7组:①、②、③组分别为H/R、PC和对照组(操作同(1)),④、⑤组分别为OA+PC组和BDM+PC组,于预处理前分别向实验各孔加入蛋白磷酸酶抑制剂okadaic acid (OA,2 μmol/L)或2,3-二乙酰一肟(BDM,20 mmol/L)预孵育10分钟后依次进行PC和H/R;⑥、⑦组分别为OA+H/R和BDM+H/R组,于H/R前分别向实验各孔中加入OA (2 μmol/L)或BDM(20 mmol/L)预孵育10分钟后进行H/R。结束实验时,取培养液测定LDH活性,计算细胞存活率,以高效液相法测定细胞内ATP含量。
, http://www.100md.com
三、统计学处理
实验结果以均数±标准差表示,以单因素方差分析和组间q检验作统计学处理。
结果
一、 PKC激活参与缺血PC对大鼠小肠缺血再灌注损伤的保护
小肠组织I/R损伤表现为LDH、CD大量漏出和肠道组织脂质过氧化产物MDA含量升高。预处理则减轻了I/R造成的上述损伤,其胞浆酶LDH和溶酶体酶CD漏出分别比I/R组低36%和74%(P<0.01),组织MDA含量比I/R组低81%(P<0.01)。PKC抑制剂PB和H7消除了PC的保护作用,其流出液中LDH和CD活性及组织中MDA含量均比PC组升高(P<0.01),而接近单纯I/R组(P>0.05)。但PB对单纯I/R组动物小肠LDH、CD漏出及MDA含量并无明显影响(P>0.05)(表1)。
, http://www.100md.com
表1 蛋白激酶C对大鼠小肠缺血PC作用的影响(
 ±s) 组别
±s) 组别鼠数
门静脉流出液
肠组织丙二醛
(nmol/g
干重组织)
乳酸脱氢酶
(U/L)
组织蛋白酶D
(U/L)
对照组
, 百拇医药
6
59±12
19±11
97±31
缺血再灌注组
6
414± 8**
96± 6*
929±59**
预处理组
6
266±85▲▲
, 百拇医药
25± 4▲▲
178±51▲▲
PB+预处理组
6
482±60△△
45±12△△
643±11△△
H7+预处理组
6
435±84△△
51±12△△
, 百拇医药
799±11△△
PB+缺血再灌注组
6
430±93▲▲
97±18▲▲
652±96▲▲
注:与对照组比较:* P<0.05,** P<0.01;与缺血再灌注(或缺氧复氧)组比较:▲ P<0.05,▲▲P<0.01;与预处理组比较:△ P<0.05,△△P<0.01.以下表注相同.
二、 PKC激活参与缺血PC对大鼠肢体缺血再灌注损伤的保护
, 百拇医药
I/R造成大鼠肢体组织LDH和CD大量漏出,腓肠肌组织MDA集聚和组织水肿(组织湿干重比值增加);预处理明显减轻了I/R造成的组织损伤,其LDH和CD漏出分别比I/R组低41%和39%(P<0.01),组织MDA含量和湿干重比值较I/R组分别低26%(P<0.01)和21%(P<0.05)。PB和H7消除了PC的上述保护作用(表2)。
表2 蛋白激酶C对大鼠肢体缺血PC保护
作用的影响(
 ±s) 组别
±s) 组别鼠数
股静脉流出液
腓肠肌组织
乳酸脱
, http://www.100md.com
氢酶
(U/L)
组织蛋
白酶D
(U/L)
丙二醛
(nmol/g
干重组织)
组织湿
干重比值
对照组
6
108± 6
, 百拇医药
16± 6
48±18
2.5±0.4
缺血再灌注组
6
413±49**
65±32*
70±18*
3.2±0.4**
预处理组
6
242±41▲▲
, 百拇医药
39±23▲▲
52±15▲
2.5±0.2▲
PB+预处理组
6
416±74△△
63±23△△
67±13△
3.2±0.3△
H7+预处理组
, 百拇医药
6
410±53△△
47±22△
72±11△
3.1±0.4△
三、 PKC激活及其介导的蛋白磷酸化参与VSMC缺氧PC的保护
1.PKC参与缺氧PC对VSMC缺氧复氧损伤的保护作用:缺氧复氧造成细胞存活率明显下降并有大量LDH和蛋白漏出;缺氧PC明显减轻上述损伤,细胞存活率比H/R组高50%(P<0.01),细胞LDH和蛋白漏出比H/R组分别低45%和22%(P<0.01)。以PKC激动剂PMA预孵育明显提高H/R后细胞存活率,并减少培养液中LDH和蛋白漏出,以上结果均接近缺氧PC组(P>0.05)。反之,以H7、PB预孵育,完全消除了缺氧PC的上述保护作用(表3)。
, http://www.100md.com
表3 蛋白激酶C在大鼠VSMC缺氧PC中的作用(
 ±s)
±s)组别
鼠数
细胞存
活率(%)
培养液
乳酸脱氢
酶(U/L)
蛋白质
(mg/L)
对照组
, http://www.100md.com
6
92±3
105±6
110±10
缺氧复氧组
6
57±6**
764±12**
200±10**
预处理组
6
85±3▲▲
, 百拇医药
422±10▲▲
150±10▲▲
H7+预处理组
6
67±4△△
800±17△△
170±30△
PMA+缺氧复氧组
6
84±2▲▲
503±7▲▲
, 百拇医药
140±20▲
2.模拟缺氧预处理的短暂缺氧激活VSMC的PKC:模拟缺氧PC的短暂(20分钟)缺氧使VSMC的PKC活性升高1倍,H7完全消除了短暂缺氧所致的PKC激活,其PKC活性仅为TH组的54%(图1)。
3.模拟缺氧PC的短暂缺氧使VSMC内蛋白磷酸化加强:VSMC溶解液电泳各条带蛋白32P掺入测定结果表明,模拟缺氧PC的短暂缺氧(TH组)刺激了VSMC内71 000和31 000两个蛋白条带的磷酸化,其放射活性比对照组分别高27%和64%(P<0.01),H7则明显抑制这两个区带蛋白磷酸化的程度(图2)。

图1 模拟缺氧PC的短暂缺氧对VSMC PKC活性的影响

, http://www.100md.com
电泳后凝胶板切割片段数与对照组比较,* P<0.01
图2 模拟缺氧PC的短暂缺氧对VSMC蛋白磷酸化的影响
4.蛋白去磷酸化对VSMC缺氧PC的影响:缺氧复氧降低细胞存活率及ATP含量并使LDH漏出。缺氧PC明显减轻上述H/R损伤;H/R前以磷酸酶抑制剂OA预孵育,使H/R后细胞存活率及细胞内ATP含量分别比H/R组高18%和30%,培养液中LDH活性比H/R组低21%,上述各指标与PC组比较,差异无显著意义(P>0.05)。PC前给予磷酸酶激动剂BDM则完全消除了PC的上述保护作用(表4)。
表4 蛋白去磷酸化对大鼠VSMC缺氧PC的影响(
 ±s)
±s)组别
, 百拇医药
鼠
数
细胞
培养液中乳酸
脱氢酶(U/L)
ATP(nmol/106
细胞数)
存活率
(%)
对照组
6
8.7±1.0
93± 2
, 百拇医药
56± 11
缺氧复氧组
6
4.0±1.0**
57± 4**
352±108**
预处理组
6
5.5±0.7▲
75± 6▲▲
221± 65▲▲
, 百拇医药
OA+预处理组
6
5.2±0.9
80± 5
234± 77
OA+缺氧复氧组
6
5.2±0.7▲
67±10▲
276± 64▲
BDM+预处理组
6
, 百拇医药
3.9±0.8△
61± 6△
324± 94△
BDM+缺氧复氧组
6
4.0±0.5
53± 4
306± 41
讨论
大量实验资料表明,缺血PC明显减轻心脏I/R损伤,表现为缩小心肌梗塞面积、减少心律失常发生和改善心肌收缩功能等[9]。近年发现,缺血PC的保护作用不仅存在于心脏及心肌细胞,而且对于脑、小肠、肝脏及肢体等器官的I/R损伤和培养的血管内皮及VSMC的H/R损伤亦具有保护作用[1]。本实验分别在原位灌流的大鼠小肠、肢体I/R模型上观察到缺血PC可以减轻I/R所造成的组织损伤,表现为胞浆酶LDH和溶酶体酶CD的漏出减少,脂质过氧化物MDA生成及组织水肿程度减轻;在培养的大鼠VSMC的H/R模型上观察到缺氧PC可以提高VSMC存活率、减少LDH漏出和ATP消耗等。表明缺血PC对心脏外器官及细胞亦有普遍的保护,与文献报道一致[1]。
, 百拇医药
PC的保护机理非常复杂,涉及多种因素及其相互作用。实验证实PKC激活与转位是心脏缺血PC保护机理的共同通路[9]。我们分别在原位灌流的大鼠小肠和肢体I/R模型上观察到,PKC抑制剂多粘菌素B和H7完全消除缺血PC对I/R损伤的保护作用;并在培养的大鼠VSMC上观察到PKC激动剂PMA能模拟、而PKC抑制剂H7完全消除缺氧PC对VSMC的保护作用,且缺氧PC激活VSMC内PKC;提示PKC的激活对于心脏以外组织细胞的PC保护作用亦具有重要作用,可能是PC保护作用的共同机理之一。
PKC是细胞内一类催化含丝氨酸、苏氨酸残基蛋白磷酸化的蛋白激酶,在机体的机能代谢调节中具有重要作用。但PC激活PKC后如何发挥保护作用目前尚不清楚。我们在培养的大鼠VSMC上观察到模拟缺氧PC的短暂缺氧能诱导VSMC内71 000和31 000蛋白条带的磷酸化加强,而PKC抑制剂H7则完全消除这种效应;应用蛋白磷酸酶抑制剂OA能模拟、而蛋白磷酸酶激动剂BDM则完全消除缺氧PC的VSMC保护作用,提示PKC介导的蛋白磷酸化加强可能是PC细胞保护作用的重要环节,这些底物蛋白的性质尚待进一步研究。
, 百拇医药
参考文献
1 刘秀华. 缺血(氧)预处理的普遍性及其临床应用前景. 生理科学进展,1997,28:355-358.
2 Yao CJ, Cousse NF, Zinner MJ. Serotonin and substance P stimulate intestinal secretion in the isolated perfused ileum. Surgery, 1989, 105: 86-92.
3 Su JY, Lefer AM. Beneficial effect of anisodamine in hemorrhagic shock. Naunyn Schmiedberg′s Arch Parmaco., 1984, 325: 360-365.
4 Rosenthal SM. Burns and shock:production of traumatic shock in mice. Public Health Rep, 1943, 58:1429-1433.
, http://www.100md.com
5 Hirata Y, Taragi Y, Takata S. CGRP receptor in cultured vascular smooth muscle and endothelial cells. Biochem Biophys Res Commun. 1988, 15:1113-1120.
6 Webster KA, Discher DJ, Bishopric NH. Cardioprotection in an in vitro model of hypoxic preconditioning. J Mol Cell Cardiol,1995, 27:453-458.
7 Fioraui R, Cantoni O, Tssinato A. Hydrogen peroxide and fetal bovine serum-induced DNA synthesis in vascular smooth muscle cells: positive and negative regulation by protein kinase C isoforms. Biochem Biophys Acta,1995, 1269:98-104.
, 百拇医药
8 Marrero M, Poxton WC, Duff JL, et al. Angiotension II stimulates tyrosine phosphorylation of phospholipase Cγ1 in vascular smooth muscle cells. J Biol Chem, 1994, 269:10935-10939.
9 Ytrehus K, Liu Y, Downey LM. Preconditioning protects ischemic rabbit heart by protein kinase C activation. Am J Physiol, 1994,266:H1145-H1152.
(收稿:1997-10-31 修回:1998-02-16), 百拇医药