内毒素诱导的肝细胞及枯否细胞凋亡与肝脏损伤的关系
作者:袁建成 周立新 秦孝健 肖光夏 黎鳌
单位:400038 重庆,第三军医大学附属西南医院烧伤研究所
关键词:脱噬作用;枯否细胞;肝细胞;肿瘤;坏死因子
中华医学杂志980608 【摘要】 目的 探讨内毒素、肿瘤坏死因子(TNF)在诱导枯否细胞及肝细胞凋亡过程中的作用及其与肝脏损伤的关系。方法 采用细胞死亡ELISA法分别检测枯否细胞,以及和肝脏细胞联合培养时,对不同浓度的内毒素,在不同时相点两种细胞的凋零密度,同时观察培养上清中丙氨酸转氨酶(ALT),乳酸脱氢酶(LDH)含量变化。结果 枯否细胞的凋亡数量随着培养时间的延长(3~24小时)和内毒素浓度的增加(0~10 μg/ml)明显增加。而枯否细胞与肝细胞联合培养时,在内毒素浓度大于1 μg/ml时,细胞凋亡数显著上升。TNF单克隆抗体可阻断内毒素诱导的枯否细胞及肝细胞凋亡。LDH及ALT含量在内毒素浓度高于1 μg/ml,且培养6小时后,有明显升高,晚于凋亡出现。结论 TNF介导了内毒素所致的枯否细胞及肝细胞的凋零。而且细胞凋亡早于细胞损伤的出现。大量凋零细胞的出现,使枯否细胞对内毒素的灭活作用降低进而可能导致肝细胞的凋零及损伤。
, 百拇医药
The relationship between LPS-induced apoptosis in hepatocyte, Kupffer cell and hepatocytic damage Yuan Jiancheng, Zhou Lixin, Qin Xiaojian, et al. Institute of Burn Research, South Western Hospital, Third Military Medical University, Chongqing, 400038
【Abstract】 Objective To study the role of tumor necrosis factor (TNFα) in the mechanisms of liver injury and the relationship between LPS-induced apoptosis in hepatocyte (HC), kupffer cell (KC), and hepatic damage. Methods In vitro, kupffer cells (1×10/ml) were stimulated with different concentrations of endotoxin (1~10 μg/ml) for 1-24hr; the kupffer cells, which had been cultured with endotoxin for 24hr, were isolated to coculture with hepatocytes (1∶1) for 1~24hr. Two kinds of cells of apoptosis and the block effect of TNFα antibody were detected by cell death ELISA, and the supernatant was performed to determine the levels of alanine aminotransferase (ALT), lactate dehydrogenase (LDH) at different time points. Results Following stimulation with LPS, the number of positive apoptotic KC increased in a concentration and time (3h~24h) dependent manner. In contrast, coincubation of HC with LPS-stimulated KC resulted in a marked increase in positive apoptotic hepatocyte when LPS concentration was greater than 1 μg/ml. TNFα antibody blocked apoptosis in both KC and HC. Only when the LPS concentration was higher than 1 μg/ml and cultured for 6hr, the release of liver enzymes (ALT, LDH), responsible for hepacyte damage, rose significantly, but the process was behind of apoptosis, and TNFα antibody couldn′t block it. Conclusion TNFα mediates LPS-induced apoptosis in KC and HC, and the apoptosis precedes cellular damage. Massive apoptosis of KC may lead to the decrease of clearance of LPS, thereby exacerbating septic shock, hepatocyte damage and apoptosis.
, 百拇医药
【Key words】 Apoptosis Kupffer cells Hepatocyte Tumor Necrosis factor
(Natl Med J China, 1998, 78:423-425)
很多研究已发现,枯否细胞受内毒素激活可产生多种毒性介质如氧自由基、蛋白酶和细胞因子,尤其是肿瘤坏死因子(TNF)对肝细胞造成损伤,甚至衰竭。这是严重创伤或感染后全身性炎症反应综合征所致多器官功能衰竭的一种具体表现[1]。但是目前有关枯否细胞(KC)、TNF在肝细胞损伤中的作用机制还存在争议。作者从细胞凋亡的角度着重研究了KC在诱导肝细胞损伤中的作用机制。
材料与方法
一、材料
肝细胞、枯否细胞的分离培养:采用原位灌注酶消化 法。首先分离出总的肝脏细胞,然后采用不同离心速度最终将肝细胞、枯否细胞等分开。细胞培养于RPMI1640(含10%小牛血清、青霉素100 U/ml,链霉素100 μg/ml,胰岛素0.1 U/ml以及Hepes 15 mmol)。培养条件37℃,5% CO2。
, 百拇医药
二、方法
1.KC凋亡诱导:调整KC成1×106/ml,接种于24孔培养板,培养4小时后换液,加入大肠杆菌001B4内毒素(0~10 μg/ml)培养1、3、6、12、24小时,取细胞做凋亡测试。
2.活化KC诱导肝细胞凋亡:KC受内毒素刺激24小时后,用无菌Hank′s液以培养板上洗脱下来,计数后加到肝细胞培养孔中(比例为1∶1)。联合培养1、3、6、12、24小时后做凋亡测试。
3.实验分组:(1) 正常KC组:1×106/ml细胞单独培养。(2) 正常HC组:1×106/ml细胞单独培养。(3) KC凋零诱导组:每孔加入0、0.1、1.0、10 μg/ml内毒素。(4) 肝细胞凋亡诱导组:肝细胞、KC细胞分别为1×106/ml(终浓度)。(5) 肝细胞内毒素处理组:分别加入内毒素0、1、10 μg/ml。(6) 拮抗组:KC及肝细胞联合培养分别加入0.1 μg TNF单抗/孔(终浓度)。
, 百拇医药
4.测量指标:(1) 凋亡:采用德国宝灵曼公司提供的体外细胞凋零检验试剂盒,ELISA方法,参照说明书进行。
2.TNF:取培养液上清,ELISA法测定,试剂盒由军科院提供。(3) 丙氨酸基转移酶(ALT)乳酸脱氢酶(LDH)测定:取培养上清液测定,试剂盒由上海长征医院科学有限公司提供。
三、统计学分析
所获数据均由华西医科大学提供的医学统计程序包行t检验和χ2检验。
结果
1.内毒素,TNF单抗对KC和HC凋亡的影响:在肝细胞凋亡组,当内毒素浓度大于1 μg/ml时肝细胞凋亡数迅速增加,达到32%±6%(P<0.05)。在正常KC组,正常肝细胞组,肝细胞内毒素处理组的细胞凋亡数分别是11%±3%,7%±2%以及8%±2%并无明显差别。但是加入TNF-α单克隆抗体后肝细胞,KC凋亡数均较凋亡诱导组有了显著下降(附表)。
, http://www.100md.com
2.内毒素对TNF水平的影响:在正常KC组,仅有低浓度的TNF分泌。而正常肝细胞且及肝细胞内毒素处理组则未发现有TNF的分泌。KC经内毒素处理后,TNF水平显著增加,其中内毒素1 μg/ml时其TNF水平明显高于0.1 μg/ml时,而内毒素10 μg/ml时TNF水平与前者差异无显著意义(图1)。
附表 内毒素对细胞凋零的影响(%, ±s) 组别
±s) 组别
内毒素(μg/ml)
0
0.1
1.0
10
KC组
, http://www.100md.com
11±3
21± 6▲
42±24▲▲
68±30▲▲
拮抗后
3h
3±3
4± 3**
5± 1*
9± 5*
6h
, 百拇医药
4±4
8± 6**
14± 6*
12± 9*
12h
3±2
8± 7*
12± 9*
22±14*
24h
6±4
, 百拇医药
2± 8*
14± 4*
28± 9*
KC+HC组
12±4
18±10
32±17△▲
55±28△△▲
拮抗后
3h
24±6
, http://www.100md.com
12± 2**
18± 9*
26±11*
6h
21±4
14± 7**
22± 9*
25±12*
12h
25±6
16± 5*
, http://www.100md.com
22±11*
28±17*
24h
23±9
14± 5*
26±16*
26±11*
HC
7±2
9± 3
8± 3
, http://www.100md.com 11± 3
注:与HC组比较△P<0.05,△△P<0.01,与未加TNF单抗拮抗组比较*P<0.01,**P<0.05,与前一浓度内毒素比较▲P<0.05,▲▲P<0.01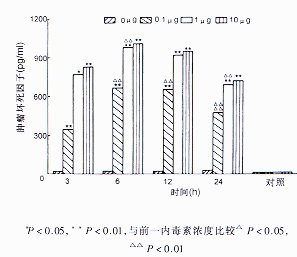
图1 内毒素刺激枯否细胞分泌TNF动态变化与肝细胞比较
3.ALT,LDH含量的变化:正常KC培养24小时后,其上清中LDH的含量未见明显增加,正常肝细胞ALT分泌水平也未见明显增加。但在KC凋亡组,肝细胞凋亡诱导组其LDH或ALT水平仅在内毒素浓度达1 μg/ml时在培养6小时后开始升高,而同组细胞凋亡的数量在培养3小时后就显著增加。而在TNF拮抗组,两种细胞的LDH或ALT的释放量未见显著下降。此外在肝细胞内毒素处理组仅当内毒素浓度大于10 μg/ml时,出现ALT水平的增加(图2,图3)。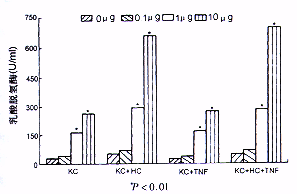
, 百拇医药
图2 内毒素处理后LDH释放变化与未受内毒素处理的枯否
细胞比较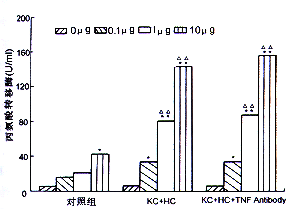
与未受内毒素刺激的肝细胞比较* P<0.05,**P<0.01,与前一内毒素浓度比较△△ P<0.01
图3 内毒素对肝细胞产生丙氨酸转移酶的影响
讨论
目前的研究发现在肝细胞凋亡过程中T细胞,Fas/Apol,甾质类激素、TGF-β、TNF均产生了重要作用[2]。而且越来越多的证据表明肝细胞凋亡可能是肝功能衰竭的重要原因[3]。多种细胞因子可诱导肝细胞的凋亡,参与全身过度炎症反应时细胞因子导致肝功能衰竭甚至多器官功能衰竭。
, 百拇医药
我们的研究发现,枯否细胞受内毒素攻击后随着内毒素浓度的增加及培养时间的延长,细胞凋亡数目显著增加,而受内毒素活化的KC与肝细胞联合培养后,也出现了凋亡现象。而其它未受内毒素刺激的细胞,虽然也有凋亡产生但其数量已大为降低。由此可见,内毒素是诱导枯否细胞凋亡的主要因素之一。
许多研究均已证明KC经内毒素活化释放大量的TNF,从而造成肝细胞的损伤。但是一些学者对此持反相意见,主要观点是TNF对肝细胞并无直接损伤作用[4]。从我们的结果发现,KC受内毒素刺激后,均有TNF的大量分泌释放。而且TNF释放的量越大,肝细胞、KC凋亡的数目也就越多。此外,加TNF-α单抗阻断TNF活性后,两种细胞凋亡数量均有了非常显著的降低。而肝细胞组,正常KC组、肝细胞内毒素处理组由于没有TNF的大量释放,故均未见明显细胞凋亡现象,提示TNF参与内毒素诱导的肝细胞、KC凋亡过程。虽然其促使细胞凋亡的机制还不清楚,但是有些学者甚至认为位于细胞膜上的TNF通过细胞接触更能发挥其生物学作用,诱导细胞的死亡[5]。这在内毒素诱导的肝脏损伤的病理过程尤应引起重视。
, 百拇医药
众所周知,枯否细胞是全身数量最多的巨噬细胞群落,主要作用是吞噬门静脉来源的内毒素,发挥“生物滤膜”作用[6]。如果大量的KC发生凋亡,必将导致内毒素的逃逸,出现全身性内毒素血症乃至内毒素休克[7]。另一方面,KC分泌的多种细胞因子还可进一步导致肝细胞的凋亡,进而出现肝功能衰竭。所以Leist等[8]认为TNF可能是诱导肝细胞凋亡器官损伤的起始步骤。
本课题为国家自然科学基金资助项目
参考文献
1 Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guideling for the use of innovative therapies in sepsis. Chest, 1992, 101:1644-1655.
, 百拇医药
2 Patel T,Gokes GJ. Apoptosis and hepatobilliary disease. (review) Hepatology, 1995, 21:1725-1741.
3 Ogasawara J, Wstanabe-Fukunaga R, Adachi M, et al. Lethal effect of the anti-Fas antibody in mice. Nature, 1993, 364. 806-809.
4 Hewell JA, Schultze AE, Vancise S, et al. Neutrophils deplation protects against liver injury from bacterial endotoxin. Lab Invest, 1992, 66:347-361.
5 Perez C, Albert C, Defay K, et al. A nonsecretable cell surface mutant of TNF kills by cell-to-cell contact. Cell, 1990, 63:251-258.
, http://www.100md.com
6 Wardle EN. Kupffer cells and their function. Liver, 1987, 7:63-78.
7 Takei y, Kawaro S, Goto M, et al. LPS-induced apoptosis in kupffer cells-a possible role in pathogenesis of sepsis. [Abstract] Hepatology, 1994, 20:191A.
8 Leist M, Gantner F, Bohlinger L, et al. TNF-induced hepatocyte apoptosis precedes liver failure in experiment murine shock models. Am J Path, 1995, 146:1220-1234.
(收稿:1997-05-28 修回:1997-12-04)
, http://www.100md.com
单位:400038 重庆,第三军医大学附属西南医院烧伤研究所
关键词:脱噬作用;枯否细胞;肝细胞;肿瘤;坏死因子
中华医学杂志980608 【摘要】 目的 探讨内毒素、肿瘤坏死因子(TNF)在诱导枯否细胞及肝细胞凋亡过程中的作用及其与肝脏损伤的关系。方法 采用细胞死亡ELISA法分别检测枯否细胞,以及和肝脏细胞联合培养时,对不同浓度的内毒素,在不同时相点两种细胞的凋零密度,同时观察培养上清中丙氨酸转氨酶(ALT),乳酸脱氢酶(LDH)含量变化。结果 枯否细胞的凋亡数量随着培养时间的延长(3~24小时)和内毒素浓度的增加(0~10 μg/ml)明显增加。而枯否细胞与肝细胞联合培养时,在内毒素浓度大于1 μg/ml时,细胞凋亡数显著上升。TNF单克隆抗体可阻断内毒素诱导的枯否细胞及肝细胞凋亡。LDH及ALT含量在内毒素浓度高于1 μg/ml,且培养6小时后,有明显升高,晚于凋亡出现。结论 TNF介导了内毒素所致的枯否细胞及肝细胞的凋零。而且细胞凋亡早于细胞损伤的出现。大量凋零细胞的出现,使枯否细胞对内毒素的灭活作用降低进而可能导致肝细胞的凋零及损伤。
, 百拇医药
The relationship between LPS-induced apoptosis in hepatocyte, Kupffer cell and hepatocytic damage Yuan Jiancheng, Zhou Lixin, Qin Xiaojian, et al. Institute of Burn Research, South Western Hospital, Third Military Medical University, Chongqing, 400038
【Abstract】 Objective To study the role of tumor necrosis factor (TNFα) in the mechanisms of liver injury and the relationship between LPS-induced apoptosis in hepatocyte (HC), kupffer cell (KC), and hepatic damage. Methods In vitro, kupffer cells (1×10/ml) were stimulated with different concentrations of endotoxin (1~10 μg/ml) for 1-24hr; the kupffer cells, which had been cultured with endotoxin for 24hr, were isolated to coculture with hepatocytes (1∶1) for 1~24hr. Two kinds of cells of apoptosis and the block effect of TNFα antibody were detected by cell death ELISA, and the supernatant was performed to determine the levels of alanine aminotransferase (ALT), lactate dehydrogenase (LDH) at different time points. Results Following stimulation with LPS, the number of positive apoptotic KC increased in a concentration and time (3h~24h) dependent manner. In contrast, coincubation of HC with LPS-stimulated KC resulted in a marked increase in positive apoptotic hepatocyte when LPS concentration was greater than 1 μg/ml. TNFα antibody blocked apoptosis in both KC and HC. Only when the LPS concentration was higher than 1 μg/ml and cultured for 6hr, the release of liver enzymes (ALT, LDH), responsible for hepacyte damage, rose significantly, but the process was behind of apoptosis, and TNFα antibody couldn′t block it. Conclusion TNFα mediates LPS-induced apoptosis in KC and HC, and the apoptosis precedes cellular damage. Massive apoptosis of KC may lead to the decrease of clearance of LPS, thereby exacerbating septic shock, hepatocyte damage and apoptosis.
, 百拇医药
【Key words】 Apoptosis Kupffer cells Hepatocyte Tumor Necrosis factor
(Natl Med J China, 1998, 78:423-425)
很多研究已发现,枯否细胞受内毒素激活可产生多种毒性介质如氧自由基、蛋白酶和细胞因子,尤其是肿瘤坏死因子(TNF)对肝细胞造成损伤,甚至衰竭。这是严重创伤或感染后全身性炎症反应综合征所致多器官功能衰竭的一种具体表现[1]。但是目前有关枯否细胞(KC)、TNF在肝细胞损伤中的作用机制还存在争议。作者从细胞凋亡的角度着重研究了KC在诱导肝细胞损伤中的作用机制。
材料与方法
一、材料
肝细胞、枯否细胞的分离培养:采用原位灌注酶消化 法。首先分离出总的肝脏细胞,然后采用不同离心速度最终将肝细胞、枯否细胞等分开。细胞培养于RPMI1640(含10%小牛血清、青霉素100 U/ml,链霉素100 μg/ml,胰岛素0.1 U/ml以及Hepes 15 mmol)。培养条件37℃,5% CO2。
, 百拇医药
二、方法
1.KC凋亡诱导:调整KC成1×106/ml,接种于24孔培养板,培养4小时后换液,加入大肠杆菌001B4内毒素(0~10 μg/ml)培养1、3、6、12、24小时,取细胞做凋亡测试。
2.活化KC诱导肝细胞凋亡:KC受内毒素刺激24小时后,用无菌Hank′s液以培养板上洗脱下来,计数后加到肝细胞培养孔中(比例为1∶1)。联合培养1、3、6、12、24小时后做凋亡测试。
3.实验分组:(1) 正常KC组:1×106/ml细胞单独培养。(2) 正常HC组:1×106/ml细胞单独培养。(3) KC凋零诱导组:每孔加入0、0.1、1.0、10 μg/ml内毒素。(4) 肝细胞凋亡诱导组:肝细胞、KC细胞分别为1×106/ml(终浓度)。(5) 肝细胞内毒素处理组:分别加入内毒素0、1、10 μg/ml。(6) 拮抗组:KC及肝细胞联合培养分别加入0.1 μg TNF单抗/孔(终浓度)。
, 百拇医药
4.测量指标:(1) 凋亡:采用德国宝灵曼公司提供的体外细胞凋零检验试剂盒,ELISA方法,参照说明书进行。
2.TNF:取培养液上清,ELISA法测定,试剂盒由军科院提供。(3) 丙氨酸基转移酶(ALT)乳酸脱氢酶(LDH)测定:取培养上清液测定,试剂盒由上海长征医院科学有限公司提供。
三、统计学分析
所获数据均由华西医科大学提供的医学统计程序包行t检验和χ2检验。
结果
1.内毒素,TNF单抗对KC和HC凋亡的影响:在肝细胞凋亡组,当内毒素浓度大于1 μg/ml时肝细胞凋亡数迅速增加,达到32%±6%(P<0.05)。在正常KC组,正常肝细胞组,肝细胞内毒素处理组的细胞凋亡数分别是11%±3%,7%±2%以及8%±2%并无明显差别。但是加入TNF-α单克隆抗体后肝细胞,KC凋亡数均较凋亡诱导组有了显著下降(附表)。
, http://www.100md.com
2.内毒素对TNF水平的影响:在正常KC组,仅有低浓度的TNF分泌。而正常肝细胞且及肝细胞内毒素处理组则未发现有TNF的分泌。KC经内毒素处理后,TNF水平显著增加,其中内毒素1 μg/ml时其TNF水平明显高于0.1 μg/ml时,而内毒素10 μg/ml时TNF水平与前者差异无显著意义(图1)。
附表 内毒素对细胞凋零的影响(%,
 ±s) 组别
±s) 组别内毒素(μg/ml)
0
0.1
1.0
10
KC组
, http://www.100md.com
11±3
21± 6▲
42±24▲▲
68±30▲▲
拮抗后
3h
3±3
4± 3**
5± 1*
9± 5*
6h
, 百拇医药
4±4
8± 6**
14± 6*
12± 9*
12h
3±2
8± 7*
12± 9*
22±14*
24h
6±4
, 百拇医药
2± 8*
14± 4*
28± 9*
KC+HC组
12±4
18±10
32±17△▲
55±28△△▲
拮抗后
3h
24±6
, http://www.100md.com
12± 2**
18± 9*
26±11*
6h
21±4
14± 7**
22± 9*
25±12*
12h
25±6
16± 5*
, http://www.100md.com
22±11*
28±17*
24h
23±9
14± 5*
26±16*
26±11*
HC
7±2
9± 3
8± 3
, http://www.100md.com 11± 3
注:与HC组比较△P<0.05,△△P<0.01,与未加TNF单抗拮抗组比较*P<0.01,**P<0.05,与前一浓度内毒素比较▲P<0.05,▲▲P<0.01

图1 内毒素刺激枯否细胞分泌TNF动态变化与肝细胞比较
3.ALT,LDH含量的变化:正常KC培养24小时后,其上清中LDH的含量未见明显增加,正常肝细胞ALT分泌水平也未见明显增加。但在KC凋亡组,肝细胞凋亡诱导组其LDH或ALT水平仅在内毒素浓度达1 μg/ml时在培养6小时后开始升高,而同组细胞凋亡的数量在培养3小时后就显著增加。而在TNF拮抗组,两种细胞的LDH或ALT的释放量未见显著下降。此外在肝细胞内毒素处理组仅当内毒素浓度大于10 μg/ml时,出现ALT水平的增加(图2,图3)。

, 百拇医药
图2 内毒素处理后LDH释放变化与未受内毒素处理的枯否
细胞比较

与未受内毒素刺激的肝细胞比较* P<0.05,**P<0.01,与前一内毒素浓度比较△△ P<0.01
图3 内毒素对肝细胞产生丙氨酸转移酶的影响
讨论
目前的研究发现在肝细胞凋亡过程中T细胞,Fas/Apol,甾质类激素、TGF-β、TNF均产生了重要作用[2]。而且越来越多的证据表明肝细胞凋亡可能是肝功能衰竭的重要原因[3]。多种细胞因子可诱导肝细胞的凋亡,参与全身过度炎症反应时细胞因子导致肝功能衰竭甚至多器官功能衰竭。
, 百拇医药
我们的研究发现,枯否细胞受内毒素攻击后随着内毒素浓度的增加及培养时间的延长,细胞凋亡数目显著增加,而受内毒素活化的KC与肝细胞联合培养后,也出现了凋亡现象。而其它未受内毒素刺激的细胞,虽然也有凋亡产生但其数量已大为降低。由此可见,内毒素是诱导枯否细胞凋亡的主要因素之一。
许多研究均已证明KC经内毒素活化释放大量的TNF,从而造成肝细胞的损伤。但是一些学者对此持反相意见,主要观点是TNF对肝细胞并无直接损伤作用[4]。从我们的结果发现,KC受内毒素刺激后,均有TNF的大量分泌释放。而且TNF释放的量越大,肝细胞、KC凋亡的数目也就越多。此外,加TNF-α单抗阻断TNF活性后,两种细胞凋亡数量均有了非常显著的降低。而肝细胞组,正常KC组、肝细胞内毒素处理组由于没有TNF的大量释放,故均未见明显细胞凋亡现象,提示TNF参与内毒素诱导的肝细胞、KC凋亡过程。虽然其促使细胞凋亡的机制还不清楚,但是有些学者甚至认为位于细胞膜上的TNF通过细胞接触更能发挥其生物学作用,诱导细胞的死亡[5]。这在内毒素诱导的肝脏损伤的病理过程尤应引起重视。
, 百拇医药
众所周知,枯否细胞是全身数量最多的巨噬细胞群落,主要作用是吞噬门静脉来源的内毒素,发挥“生物滤膜”作用[6]。如果大量的KC发生凋亡,必将导致内毒素的逃逸,出现全身性内毒素血症乃至内毒素休克[7]。另一方面,KC分泌的多种细胞因子还可进一步导致肝细胞的凋亡,进而出现肝功能衰竭。所以Leist等[8]认为TNF可能是诱导肝细胞凋亡器官损伤的起始步骤。
本课题为国家自然科学基金资助项目
参考文献
1 Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guideling for the use of innovative therapies in sepsis. Chest, 1992, 101:1644-1655.
, 百拇医药
2 Patel T,Gokes GJ. Apoptosis and hepatobilliary disease. (review) Hepatology, 1995, 21:1725-1741.
3 Ogasawara J, Wstanabe-Fukunaga R, Adachi M, et al. Lethal effect of the anti-Fas antibody in mice. Nature, 1993, 364. 806-809.
4 Hewell JA, Schultze AE, Vancise S, et al. Neutrophils deplation protects against liver injury from bacterial endotoxin. Lab Invest, 1992, 66:347-361.
5 Perez C, Albert C, Defay K, et al. A nonsecretable cell surface mutant of TNF kills by cell-to-cell contact. Cell, 1990, 63:251-258.
, http://www.100md.com
6 Wardle EN. Kupffer cells and their function. Liver, 1987, 7:63-78.
7 Takei y, Kawaro S, Goto M, et al. LPS-induced apoptosis in kupffer cells-a possible role in pathogenesis of sepsis. [Abstract] Hepatology, 1994, 20:191A.
8 Leist M, Gantner F, Bohlinger L, et al. TNF-induced hepatocyte apoptosis precedes liver failure in experiment murine shock models. Am J Path, 1995, 146:1220-1234.
(收稿:1997-05-28 修回:1997-12-04)
, http://www.100md.com