诱导型一氧化氮合酶选择性抑制剂对大鼠免疫性肝损伤的影响
作者:章国良 林志彬 张波
单位:100083 北京医科大学基础医学院药理学系(章国良、林志彬),病理学系(张波)
关键词:肝疾病;一氧化氮;酶抑制剂
中华医学杂志980726 【摘要】 目的 探讨大鼠免疫性肝损伤模型中一氧化氮(NO)的作用及诱生规律,诱导型一氧化氮合酶(iNOS)选择性抑制剂的作用机制。方法 采用原位PCR法对免疫损伤性肝细胞NOS基因表达进行原位检测,并观察细胞培养上清中NO生成量及乳酸脱氢酶(LDH)活性的变化。结果 用卡介苗(BCG,15、30、50 mg/只静脉注射)单独投与或与炎性细胞因子配伍(CM,含白细胞介素1β,干扰素γ,肿瘤坏死因子α及细菌脂多糖)可引起培养上清NO浓度及LDH活性明显升高(均P<0.05),NO生成量与肝损伤程度成正比,而与BCG剂量成反比;大鼠免疫损伤性肝实质细胞NOS基因表达以可溶性胞浆型iNOS为主;iNOS选择性抑制剂氨基胍在明显抑制细胞培养上清中NO生成(83.4%,P<0.05)的同时,减轻肝细胞损伤的程度(36.0%,P<0.05);而转录抑制剂放线菌素D则加重肝损伤(增加25.5%,P<0.05)。结论 在免疫刺激条件下诱导生成的NO主要参与肝损伤机制。
, http://www.100md.com
Effects of selective induceble nitric oxide synthase inhibitor on immunological hepatic injury in rat Zhang Guoliang, Lin Zhibin, Zhang Bo. Department of Pharmacology , Beijing Medical University, Beijing 100083
【Abstract】 Objective To investigate the role and induced regulation of nitric oxide (NO) in rat immunological hepatic injury, and the effect of selective inhibitor on induceble nitric oxide synthase (iNOS). Methods The intracellular NOS gene expression in the immune damaged hepatocytes was determined by in situ PCR technique, and NO concentration and lactate dehydrogenase (LDH) activity in culture supernatant were measured. Results Administration of bacille calmette guerin (BCG, 15,30,50mg/rat, iv) alone or BCG with the inflammatory cytokines mixture (CM), including IL-1β, IFN-γ, TNF-α and lipopolysacchride (LPS) significantly increased NO production and LDH release in culture medium(P<0.05). NO production was enhanced with hepatic injury degree in direct proportion, and with BCG dose in inverse proportion. Under immunological stimuli condition, hepatocytes NOS mRNA mainly expressed an induceble and soluble isoform (iNOS) in cytoplasm. Aminoguanidine (AG), a selective iNOS inhibitor,inhibited NO production and LDH release(83.4% and 36.0%, P <0.05), but the transcription inhibitor actinomycin D enhanced LDH level in the medium (25.5%, P<0.05). Conclusion NO produced by immunological stimuli participates in rat hepatic injury mechanism.
, 百拇医药
【Key words】 Liver diseases Nitric oxide Enzyme inhibitors
(Natl Med J China, 1998, 78:540-543)
由诱导型一氧化氮合酶(iNOS)所大量产生的一氧化氮(NO),主要作为细胞免疫和细胞毒性的效应分子,在多种感染性及自身免疫性疾病的发病机制中起重要作用[1]。采用药物对iNOS同工酶的活性及表达环节进行选择性调控,可望为多种疾病的治疗开辟新的途径。我们已证实体外分离培养的大鼠肝细胞可在细菌内毒素(LPS)与细胞因子的诱导下生成大量NO[2],但免疫性肝损伤与NO诱生的相关性及选择性抑制iNOS对肝损伤的影响尚未得到证
本研究旨在探讨大鼠免疫性肝损伤与iNOS基因表达及NO生成之间的相互关系,药物对NO生成的影响,以确定NO在肝损伤中的作用和诱生规律以及药物作用的机制,从而为多种iNOS诱生相关疾病的治疗提供实验依据。
, http://www.100md.com
材料与方法
1.材料:Wistar雄性大鼠(200±20 g),由本校实验动物部提供。胶原酶(Ⅳ型)、细菌内毒素(LPS)、胰岛素、氨基胍、L-精氨酸甲酯(Nω-nitro-L-arginine methyl ester,L-NAME)、地塞米松均为美国Sigma公司产品;放线菌素D为瑞士Fluka公司产品;人重组白细胞介素1(IL-1β)、干扰素(IFN-γ)及肿瘤坏死因子(TNF-α)为北京邦定生物医学公司产品;佐剂用卡介苗(BCG),购自中国药品生物制品检定所。原位杂交及原位聚合酶链反应检测iNOS mRNA所用探针为生物素标记的cRNA探针,长700 bp左右;原位PCR所用引物为外源性生物素标记的DNA片段,为人MDM2 的一段cDNA长973 bp;以上均由北京医科大学病理学系合成。
2.大鼠免疫性肝损伤模型的制备:大鼠随机分为5组(每组6只),即正常对照组,BCG各剂量组(15、30、50 mg/只),BCG+LPS组。除对照组外,各组均于尾静脉注射上述剂量的BCG。BCG致敏2周后BCG+LPS组尾静脉注射LPS(剂量分别为1、10、100 μg/只)。LPS注射4小时后处死各组动物取肝脏,石蜡包埋切片,HE染色,进行肝脏病理组织学检查或对肝细胞分离培养,以检测细胞培养上清中乳酸脱氢酶(LDH)活性(参照文献[3]方法)作为判断肝细胞损伤的生化学指标。
, 百拇医药
3.大鼠肝细胞原代培养:采用胶原酶灌流-差速离心法[2]对BCG致敏1~2周的大鼠及对照组大鼠肝实质细胞进行分离与纯化,将肝细胞按1×106个细胞*ml-1*孔-1接种于6孔平底培养板,常规培养24小时后,加入LPS与细胞因子(CM)或NOS抑制剂;观察药物量效与配伍关系时,取刺激24小时后的细胞及培养上清;观察时效关系时,取刺激6、12、24及48小时后各时间点细胞及培养上清进行生化测定。
4.细胞培养上清NO生成量测定:取培养上清100 μl,加等量Griess试剂(1%对氨基苯磺酰胺与0.1%N-萘基-乙二胺,5%H3PO4等量混合,临用当天配制),室温放置15分钟后,用酶标仪在540 nm处测定样本吸光度(A),以亚硝酸钠作标准曲线计算培养上清NO2含量,以NO2含量表示NO生成量。
, http://www.100md.com
5.原位杂交:(1) 标本制备:取原代培养对照组及免疫性损伤组肝细胞涂片或细胞悬液涂布于硅烷化载玻片(DAKO公司),4%多聚甲醛固定,0.2 mol/L盐酸处理10分钟后,蛋白酶K(10 μg/ml)消化细胞涂片,0.1%甘氨酸中止消化,4%多聚甲醛再固定,上行系列乙醇脱水;(2) 杂交:每片滴加杂交液25 μl(含50%去离子甲酰胺5 μl;NOS RNA探针2 μl;鲑精DNA 1 μl;1 mol/L DTT 1 μl;50×Denhardt′s液2 μl;50%硫聚葡糖胺2 μl;20×SSC 4 μl,对照片省去);(3) RNA探针于80℃变性15分钟;(4) 加封口膜,42℃保温过夜;(5) 杂交后洗涤:系列标准柠檬酸-氯化钠液(2×、1×、0.2×SSC)洗涤,1∶20马血清蛋白室温封闭40分钟;(6) 杂交后检测: 亲和素-生物素-过氧化物酶(ABC)复合液(1∶100,50 μl/张片)37℃作用1小时。以过氧化物酶-联苯胺(DAB)显色,出现棕色阳性信号后,苏木素复染核,上行乙醇脱水,树脂胶封片,光学显微镜下检测原位杂交阳性信号。
, http://www.100md.com
6.原位PCR:(1) 原位PCR前样本处理同原位杂交片;(2) 将生物素cRNA探针通过卵白素(1∶100)与生物素标记DNA片段(20 ng/片,对照片省去)桥接37℃1小时;(3) PCR体系50 μl反应液中:引物25 μmol/L分别1 μl,2 mmol/L dNTPs(含1 mmol/L dTTP, 1mmol/L 地高辛-dUTP 和2 mmol/L dATP,dCTP,dGTP) 4 μl,10×缓冲液5 μl,Taq DNA多聚酶2U;(4) 原位PCR反应:每张片25 μl上述反应液,石蜡油封片,置于原位PCR循环仪(美国,ERICOM公司)94℃变性1分钟,55℃退火1分钟,72℃延伸1分30秒,循环35次,最后72℃延伸5分钟;(5) 扩增后洗涤同原位杂交片,(6) 扩增后检测:抗地高辛抗体37℃ 2小时,BCIP/NBT(1∶100)暗盒内作用30分钟,出现紫蓝色阳性信号后,苏木素复染核,二甲苯透明,树脂胶封片。
7.统计学分析:实验结果以均数±标准差表示,组间差异显著性的比较用t检验。
, http://www.100md.com
结 果
一、大鼠免疫性肝损伤模型的诱发
1.体征变化:经尾静脉注射BCG 5~7天后,各剂量组大鼠出现攻击性增强,激惹易怒,相互撕打,啮咬;全身皮肤粘膜红肿,多处溃疡,尤以足跖部及尾部明显,肝脏亦明显充血肿大。该反应于注射后1~2周时达高峰,但具有自限性,即注射BCG 3周后,红肿逐渐消失,溃疡多自愈,重复实验3次,结果一致。
2.肝组织学变化:与对照组相比,BCG组切片汇管区有炎性细胞浸润伴部分细胞胞浆明显疏松化,空泡形成;BCG+LPS组炎症反应更甚于BCG组,除大量炎性细胞浸润外,可见肝小叶内汇管区出血及灶性坏死。
3.酶学变化:与对照组相比,BCG各剂量组或BCG+CM组肝细胞培养上清中LDH活性均呈时间依赖性地显著增高(P <0.01),而BCG+CM组与BCG组相比LDH活性亦明显增高(P< 0.05)。以上结果证明,BCG或BCG+LPS可造成大鼠免疫性肝损伤(表1 )。
, 百拇医药
表1 BCG或BCG+CM刺激与原代培养肝细胞LDH活性
变化的时效关系(U/100 ml, ±s) 组别
±s) 组别
鼠数
培养时间(小时)
6
12
24
48
对照组
5
50
, http://www.100md.com
±13
61
±15
64
±13
65
±11
BCG组
8
139
±11*
203
±12*
, http://www.100md.com
211
±13*
256
±21*
BCG+CM组
8
163
±16**
250
±13**
264
±15**
, 百拇医药
323
±17**
注:CM(细胞因子配伍,表2,3同):IL-1β 10 U/ml,TNF-α500 U/ml,IFN-γ 100 U/ml,PLS 10 mg/L;BCG(卡介苗,表2同):15 mg/只,2周静脉注射1次,与同一时间点的BCG组比较* P<0.05;与同一时间点的对照组比较** P<0.01
二、免疫性肝损伤与NO诱生的相关性
1.免疫性肝损伤中肝细胞iNOS mRNA细胞内表达的原位检测:采用原位杂交法检测原代培养免疫损伤性肝细胞涂片中NOS mRNA的表达,可见细胞浆处呈棕色阳性(+~++)反应;用原位PCR放大信号后,可见肝细胞浆弥漫强阳性紫蓝色颗粒,且胞膜及靠近胞膜处亦有少量表达。
, 百拇医药
2.免疫损伤性肝细胞NO生成量的变化(表2):BCG各剂量组刺激的NO生成量均较对照组肝细胞明显增加,BCG+CM组又较BCG组NO生成量有明显增加。这种对NO生成的刺激作用随培养时间的延长而增大(48小时生成量>24小时生成量),而随BCG剂量的增大而减少。NO生成量的变化与同步检测培养上清中乳酸脱氢酶(LDH)活性的变化呈正相关,而BCG致敏3周后的肝细胞NO生成则与对照组相比差异无显著意义。
三、选择性抑制iNOS对免疫性肝损伤中肝细胞NO生成及LDH活性的影响表2 不同剂量BCG致敏大鼠在CM刺激后肝细胞
NO2-生成情况(μmol/L, ±s) 组别
±s) 组别
鼠数
24小时
, 百拇医药
48小时
CM(-)
CM(+)
CM(-)
CM(+)
BCG(-)对照组
6
4.2
±1.1
11.3
±2.7*
5.7
±1.1
, 百拇医药
11.8
±1.6*
BCG15 mg组
6
41
±7**
201
±13**
77
±10**
225
±9**
, 百拇医药
BCG30 mg组
6
23
±4**
43
±4**
33
±5**
92
±8**
BCG50 mg组
6
, http://www.100md.com
7.6
±1.5*
12.6
±1.3*
9.8
±0.7*
50.3
±15.6*
注:与同时间点BCG(-)对照组比较* P<0.05;** P<0.01
iNOS选择性抑制剂氨基胍对BCG+CM诱导的肝细胞NO生成抑制作用最明显(抑制率83.4%),其次为非选择性NOS抑制剂L-NAME(77.4 %),其它如地塞米松(65.5 %)及放线菌素D(83.1%)亦有不同程度的抑制作用(表3)。在同样刺激条件下,观察氨基胍,L-NAME及地塞米松对肝细胞培养上清中LDH活性的影响,结果显示,上述药物均可有不同程度的抑制作用。抑制率分别为36.0%、 17.7%及13.1%,但较之上述药物对肝细胞NO生成抑制作用的程度明显减少。而RNA转录抑制剂放线菌素D则使培养上清中LDH活性进一步增高(增加25.5%,P<0.05)。
, http://www.100md.com
表3 药物对CM或BCG+CM所致原代培养大鼠肝细胞
NO生成及LDH活性的影响(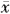 ±s) 组别
±s) 组别
NO2-
LDH
鼠数
(μmol/L)
鼠数
(U/100 ml)
正常对照组
6
, 百拇医药
4.2±1.1
5
64±13
BCG+CM
对照组
6
43.3±4.4**
8
264±15**
BCG+CM+
氨基胍
(0.1 mmol/L)组
, 百拇医药
12
15.2±2.6*△
8
169±14*△
BCG+CM+
L-NAME
(0.1 mmol/L)组
12
20.7±3.4*△
8
218±14*△
, 百拇医药
BCG+CM+
地塞米松
(10 μmol/L)组
12
31.6±8.5*△
8
229±22*△
BCG+CM+
放线菌素D
(0.2 ng/L)组
9
15.5±10.1*△
, 百拇医药
4
331±34**△
注:BCG 25mg/2周;与对照组比较* P<0.05,**P<0.01;与CM对照组比较△ P<0.05
讨 论
我们对免疫性肝损伤与NO诱生相关性的研究结果提示,在免疫刺激条件下iNOS mRNA在肝细胞的表达对肝损伤的发生有重要意义。在免疫刺激条件下诱导生成的NO对于组织细胞的作用,可能既取决于NO生成的部位又与免疫性刺激的类型有关。有人在缺乏诱导型一氧化氮合酶的基因敲除小鼠观察到LPS所致死亡率增加[4];反之NO在肺组织则引起与IgA免疫复合物生成水平相一致的损伤[5]。本实验结果与后者的观察一致,即由免疫刺激所诱导生成的NO至少部分参与了肝损伤机制。本研究通过对肝细胞NOS基因表达进行原位检测,结果显示肝实质细胞NOS mRNA的表达主要定位于细胞浆,与巨噬细胞及中性粒细胞相似的胞浆可溶性iNOS,但同时也可能表达少量与存在于血管内皮细胞来源的不可溶的颗粒型(也称膜结合型)cNOS相类似的mRNA[6]。提示同一来源的细胞内有不同类型NOS同工酶存在的可能性。本研究结果还显示,不同的刺激方式所致肝细胞NO的诱生规律亦各不相同,即体内诱导法(BCG组或BCG+CM组)所致NO生成量明显大于体外诱导法(CM组);而NO生成所需时间则相反(前者为8~12小时,后者则需5~7天)。这些差异提示肝细胞iNOS诱生过程可能有其它内源性调控机制的参与,即可能与肝外细胞某种调节性蛋白合成时的转录过程有关,而在体外细胞培养条件下,这种调节性蛋白质可能缺如或达不到所需的量。
, 百拇医药
选择性调控NOS同工酶的活性及表达,一个较为可行的方法是采用L-精氨酸同系物或某种含氮物质进行调控,但目前作为药理实验工具药厂为应用的L-精氨酸衍生物类竞争性拮抗剂多数对cNOS与iNOS缺乏特异性和选择性,因此,成为限制其在临床应用的主要障碍之一。已有报告证实,氨基胍可选择性抑制血管平滑肌细胞iNOS活性,其用于治疗糖尿病血管并发症时的非酶糖化抑制作用有可能是通过其抑制NO生成作用所致[7]。本实验亦进一步证实氨基胍可对BCG免疫性肝损伤中NO生成较非选择性NOS抑制剂L-NAME有较强的抑制作用,提示氨基胍可成为较理想的选择性NOS抑制剂。比较L-NAME、氨基胍及地塞米松对免疫性肝损伤中LDH活性的抑制作用,亦显示以对iNOS选择性较高的氨基胍作用最强,L-NAME次之,地塞米松则对LDH活性影响最小,这可能是后者虽能选择性地抑制iNOS基因的表达,但是一旦iNOS已经诱导生成,则对其无直接效果所致,反之,RNA转录抑制剂放线菌素D促使肝细胞LDH活性增高,推测放线菌素D可能除抑制NOS外,还有其它机制,因此,加重了BCG+LPS所致肝损伤。由于氨基胍对体内诱导所致NO生成抑制作用显著大于体外诱导,且在体内诱导条件下其NO抑制作用强度与RNA转录抑制剂放线菌素D相当,提示前者除在底物水平对NOS活性产生竞争性拮抗作用外,尚有可能在基因表达水平对其产生调控作用,为深入研究选择性NOS抑制剂提供了新思路,其确切的作用机制有待于进一步研究。
, 百拇医药
参考文献
1 Ignarro LJ. Physiology and pathophysiology of nitric oxide. Kidney Int (suppl), 1996, 55: 2-5.
2 Zhang GL, Lin ZB. Effects of cytokines on the endotoxin stimulated nitric oxide production in the primary cultured rat hepatocytes. J Beij Med Univ, 1998, 30:180-182.
3 Bohlinger I, Leist M, Barsig J, et al. Interleukin-1 and nitric oxide protect against tumor necrosis factor α-induced liver injury through distinct pathways. Hepatology, 1995, 22: 1829-1837.
, 百拇医药
4 Wei XQ, Charles IG, Smith A, et al. Altered immune responses in mice lacking inducible nitric oxide synthase. Nature, 1995, 375: 408- 411.
5 Mulligan MS, Warren JS, Smith CW, et al. Lung injury after deposition of IgA complexes requirements for CD18 and L-arginine. J Immunol, 1992, 148: 3086-3092.
6 Knowles RG, Moncada S. Nitric oxide synthases, in mammals. Biochem J, 1994, 298 :249-258.
7 Joly GA Ayres M, Chelly F, et al. Effects of NG-methyl-L-arginine, NOG-nitro-L-arginine, and aminoguanidine on constitutive and inducible nitric oxide synthase in rat aorta. Biochem Biophys Res Comm, 1994, 199: 147-154.
本课题为国家自然科学基金资助项目
(收稿:1997-09-12 修回:1998-03-04), 百拇医药
单位:100083 北京医科大学基础医学院药理学系(章国良、林志彬),病理学系(张波)
关键词:肝疾病;一氧化氮;酶抑制剂
中华医学杂志980726 【摘要】 目的 探讨大鼠免疫性肝损伤模型中一氧化氮(NO)的作用及诱生规律,诱导型一氧化氮合酶(iNOS)选择性抑制剂的作用机制。方法 采用原位PCR法对免疫损伤性肝细胞NOS基因表达进行原位检测,并观察细胞培养上清中NO生成量及乳酸脱氢酶(LDH)活性的变化。结果 用卡介苗(BCG,15、30、50 mg/只静脉注射)单独投与或与炎性细胞因子配伍(CM,含白细胞介素1β,干扰素γ,肿瘤坏死因子α及细菌脂多糖)可引起培养上清NO浓度及LDH活性明显升高(均P<0.05),NO生成量与肝损伤程度成正比,而与BCG剂量成反比;大鼠免疫损伤性肝实质细胞NOS基因表达以可溶性胞浆型iNOS为主;iNOS选择性抑制剂氨基胍在明显抑制细胞培养上清中NO生成(83.4%,P<0.05)的同时,减轻肝细胞损伤的程度(36.0%,P<0.05);而转录抑制剂放线菌素D则加重肝损伤(增加25.5%,P<0.05)。结论 在免疫刺激条件下诱导生成的NO主要参与肝损伤机制。
, http://www.100md.com
Effects of selective induceble nitric oxide synthase inhibitor on immunological hepatic injury in rat Zhang Guoliang, Lin Zhibin, Zhang Bo. Department of Pharmacology , Beijing Medical University, Beijing 100083
【Abstract】 Objective To investigate the role and induced regulation of nitric oxide (NO) in rat immunological hepatic injury, and the effect of selective inhibitor on induceble nitric oxide synthase (iNOS). Methods The intracellular NOS gene expression in the immune damaged hepatocytes was determined by in situ PCR technique, and NO concentration and lactate dehydrogenase (LDH) activity in culture supernatant were measured. Results Administration of bacille calmette guerin (BCG, 15,30,50mg/rat, iv) alone or BCG with the inflammatory cytokines mixture (CM), including IL-1β, IFN-γ, TNF-α and lipopolysacchride (LPS) significantly increased NO production and LDH release in culture medium(P<0.05). NO production was enhanced with hepatic injury degree in direct proportion, and with BCG dose in inverse proportion. Under immunological stimuli condition, hepatocytes NOS mRNA mainly expressed an induceble and soluble isoform (iNOS) in cytoplasm. Aminoguanidine (AG), a selective iNOS inhibitor,inhibited NO production and LDH release(83.4% and 36.0%, P <0.05), but the transcription inhibitor actinomycin D enhanced LDH level in the medium (25.5%, P<0.05). Conclusion NO produced by immunological stimuli participates in rat hepatic injury mechanism.
, 百拇医药
【Key words】 Liver diseases Nitric oxide Enzyme inhibitors
(Natl Med J China, 1998, 78:540-543)
由诱导型一氧化氮合酶(iNOS)所大量产生的一氧化氮(NO),主要作为细胞免疫和细胞毒性的效应分子,在多种感染性及自身免疫性疾病的发病机制中起重要作用[1]。采用药物对iNOS同工酶的活性及表达环节进行选择性调控,可望为多种疾病的治疗开辟新的途径。我们已证实体外分离培养的大鼠肝细胞可在细菌内毒素(LPS)与细胞因子的诱导下生成大量NO[2],但免疫性肝损伤与NO诱生的相关性及选择性抑制iNOS对肝损伤的影响尚未得到证
本研究旨在探讨大鼠免疫性肝损伤与iNOS基因表达及NO生成之间的相互关系,药物对NO生成的影响,以确定NO在肝损伤中的作用和诱生规律以及药物作用的机制,从而为多种iNOS诱生相关疾病的治疗提供实验依据。
, http://www.100md.com
材料与方法
1.材料:Wistar雄性大鼠(200±20 g),由本校实验动物部提供。胶原酶(Ⅳ型)、细菌内毒素(LPS)、胰岛素、氨基胍、L-精氨酸甲酯(Nω-nitro-L-arginine methyl ester,L-NAME)、地塞米松均为美国Sigma公司产品;放线菌素D为瑞士Fluka公司产品;人重组白细胞介素1(IL-1β)、干扰素(IFN-γ)及肿瘤坏死因子(TNF-α)为北京邦定生物医学公司产品;佐剂用卡介苗(BCG),购自中国药品生物制品检定所。原位杂交及原位聚合酶链反应检测iNOS mRNA所用探针为生物素标记的cRNA探针,长700 bp左右;原位PCR所用引物为外源性生物素标记的DNA片段,为人MDM2 的一段cDNA长973 bp;以上均由北京医科大学病理学系合成。
2.大鼠免疫性肝损伤模型的制备:大鼠随机分为5组(每组6只),即正常对照组,BCG各剂量组(15、30、50 mg/只),BCG+LPS组。除对照组外,各组均于尾静脉注射上述剂量的BCG。BCG致敏2周后BCG+LPS组尾静脉注射LPS(剂量分别为1、10、100 μg/只)。LPS注射4小时后处死各组动物取肝脏,石蜡包埋切片,HE染色,进行肝脏病理组织学检查或对肝细胞分离培养,以检测细胞培养上清中乳酸脱氢酶(LDH)活性(参照文献[3]方法)作为判断肝细胞损伤的生化学指标。
, 百拇医药
3.大鼠肝细胞原代培养:采用胶原酶灌流-差速离心法[2]对BCG致敏1~2周的大鼠及对照组大鼠肝实质细胞进行分离与纯化,将肝细胞按1×106个细胞*ml-1*孔-1接种于6孔平底培养板,常规培养24小时后,加入LPS与细胞因子(CM)或NOS抑制剂;观察药物量效与配伍关系时,取刺激24小时后的细胞及培养上清;观察时效关系时,取刺激6、12、24及48小时后各时间点细胞及培养上清进行生化测定。
4.细胞培养上清NO生成量测定:取培养上清100 μl,加等量Griess试剂(1%对氨基苯磺酰胺与0.1%N-萘基-乙二胺,5%H3PO4等量混合,临用当天配制),室温放置15分钟后,用酶标仪在540 nm处测定样本吸光度(A),以亚硝酸钠作标准曲线计算培养上清NO2含量,以NO2含量表示NO生成量。
, http://www.100md.com
5.原位杂交:(1) 标本制备:取原代培养对照组及免疫性损伤组肝细胞涂片或细胞悬液涂布于硅烷化载玻片(DAKO公司),4%多聚甲醛固定,0.2 mol/L盐酸处理10分钟后,蛋白酶K(10 μg/ml)消化细胞涂片,0.1%甘氨酸中止消化,4%多聚甲醛再固定,上行系列乙醇脱水;(2) 杂交:每片滴加杂交液25 μl(含50%去离子甲酰胺5 μl;NOS RNA探针2 μl;鲑精DNA 1 μl;1 mol/L DTT 1 μl;50×Denhardt′s液2 μl;50%硫聚葡糖胺2 μl;20×SSC 4 μl,对照片省去);(3) RNA探针于80℃变性15分钟;(4) 加封口膜,42℃保温过夜;(5) 杂交后洗涤:系列标准柠檬酸-氯化钠液(2×、1×、0.2×SSC)洗涤,1∶20马血清蛋白室温封闭40分钟;(6) 杂交后检测: 亲和素-生物素-过氧化物酶(ABC)复合液(1∶100,50 μl/张片)37℃作用1小时。以过氧化物酶-联苯胺(DAB)显色,出现棕色阳性信号后,苏木素复染核,上行乙醇脱水,树脂胶封片,光学显微镜下检测原位杂交阳性信号。
, http://www.100md.com
6.原位PCR:(1) 原位PCR前样本处理同原位杂交片;(2) 将生物素cRNA探针通过卵白素(1∶100)与生物素标记DNA片段(20 ng/片,对照片省去)桥接37℃1小时;(3) PCR体系50 μl反应液中:引物25 μmol/L分别1 μl,2 mmol/L dNTPs(含1 mmol/L dTTP, 1mmol/L 地高辛-dUTP 和2 mmol/L dATP,dCTP,dGTP) 4 μl,10×缓冲液5 μl,Taq DNA多聚酶2U;(4) 原位PCR反应:每张片25 μl上述反应液,石蜡油封片,置于原位PCR循环仪(美国,ERICOM公司)94℃变性1分钟,55℃退火1分钟,72℃延伸1分30秒,循环35次,最后72℃延伸5分钟;(5) 扩增后洗涤同原位杂交片,(6) 扩增后检测:抗地高辛抗体37℃ 2小时,BCIP/NBT(1∶100)暗盒内作用30分钟,出现紫蓝色阳性信号后,苏木素复染核,二甲苯透明,树脂胶封片。
7.统计学分析:实验结果以均数±标准差表示,组间差异显著性的比较用t检验。
, http://www.100md.com
结 果
一、大鼠免疫性肝损伤模型的诱发
1.体征变化:经尾静脉注射BCG 5~7天后,各剂量组大鼠出现攻击性增强,激惹易怒,相互撕打,啮咬;全身皮肤粘膜红肿,多处溃疡,尤以足跖部及尾部明显,肝脏亦明显充血肿大。该反应于注射后1~2周时达高峰,但具有自限性,即注射BCG 3周后,红肿逐渐消失,溃疡多自愈,重复实验3次,结果一致。
2.肝组织学变化:与对照组相比,BCG组切片汇管区有炎性细胞浸润伴部分细胞胞浆明显疏松化,空泡形成;BCG+LPS组炎症反应更甚于BCG组,除大量炎性细胞浸润外,可见肝小叶内汇管区出血及灶性坏死。
3.酶学变化:与对照组相比,BCG各剂量组或BCG+CM组肝细胞培养上清中LDH活性均呈时间依赖性地显著增高(P <0.01),而BCG+CM组与BCG组相比LDH活性亦明显增高(P< 0.05)。以上结果证明,BCG或BCG+LPS可造成大鼠免疫性肝损伤(表1 )。
, 百拇医药
表1 BCG或BCG+CM刺激与原代培养肝细胞LDH活性
变化的时效关系(U/100 ml,
 ±s) 组别
±s) 组别鼠数
培养时间(小时)
6
12
24
48
对照组
5
50
, http://www.100md.com
±13
61
±15
64
±13
65
±11
BCG组
8
139
±11*
203
±12*
, http://www.100md.com
211
±13*
256
±21*
BCG+CM组
8
163
±16**
250
±13**
264
±15**
, 百拇医药
323
±17**
注:CM(细胞因子配伍,表2,3同):IL-1β 10 U/ml,TNF-α500 U/ml,IFN-γ 100 U/ml,PLS 10 mg/L;BCG(卡介苗,表2同):15 mg/只,2周静脉注射1次,与同一时间点的BCG组比较* P<0.05;与同一时间点的对照组比较** P<0.01
二、免疫性肝损伤与NO诱生的相关性
1.免疫性肝损伤中肝细胞iNOS mRNA细胞内表达的原位检测:采用原位杂交法检测原代培养免疫损伤性肝细胞涂片中NOS mRNA的表达,可见细胞浆处呈棕色阳性(+~++)反应;用原位PCR放大信号后,可见肝细胞浆弥漫强阳性紫蓝色颗粒,且胞膜及靠近胞膜处亦有少量表达。
, 百拇医药
2.免疫损伤性肝细胞NO生成量的变化(表2):BCG各剂量组刺激的NO生成量均较对照组肝细胞明显增加,BCG+CM组又较BCG组NO生成量有明显增加。这种对NO生成的刺激作用随培养时间的延长而增大(48小时生成量>24小时生成量),而随BCG剂量的增大而减少。NO生成量的变化与同步检测培养上清中乳酸脱氢酶(LDH)活性的变化呈正相关,而BCG致敏3周后的肝细胞NO生成则与对照组相比差异无显著意义。
三、选择性抑制iNOS对免疫性肝损伤中肝细胞NO生成及LDH活性的影响表2 不同剂量BCG致敏大鼠在CM刺激后肝细胞
NO2-生成情况(μmol/L,
 ±s) 组别
±s) 组别鼠数
24小时
, 百拇医药
48小时
CM(-)
CM(+)
CM(-)
CM(+)
BCG(-)对照组
6
4.2
±1.1
11.3
±2.7*
5.7
±1.1
, 百拇医药
11.8
±1.6*
BCG15 mg组
6
41
±7**
201
±13**
77
±10**
225
±9**
, 百拇医药
BCG30 mg组
6
23
±4**
43
±4**
33
±5**
92
±8**
BCG50 mg组
6
, http://www.100md.com
7.6
±1.5*
12.6
±1.3*
9.8
±0.7*
50.3
±15.6*
注:与同时间点BCG(-)对照组比较* P<0.05;** P<0.01
iNOS选择性抑制剂氨基胍对BCG+CM诱导的肝细胞NO生成抑制作用最明显(抑制率83.4%),其次为非选择性NOS抑制剂L-NAME(77.4 %),其它如地塞米松(65.5 %)及放线菌素D(83.1%)亦有不同程度的抑制作用(表3)。在同样刺激条件下,观察氨基胍,L-NAME及地塞米松对肝细胞培养上清中LDH活性的影响,结果显示,上述药物均可有不同程度的抑制作用。抑制率分别为36.0%、 17.7%及13.1%,但较之上述药物对肝细胞NO生成抑制作用的程度明显减少。而RNA转录抑制剂放线菌素D则使培养上清中LDH活性进一步增高(增加25.5%,P<0.05)。
, http://www.100md.com
表3 药物对CM或BCG+CM所致原代培养大鼠肝细胞
NO生成及LDH活性的影响(
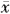 ±s) 组别
±s) 组别NO2-
LDH
鼠数
(μmol/L)
鼠数
(U/100 ml)
正常对照组
6
, 百拇医药
4.2±1.1
5
64±13
BCG+CM
对照组
6
43.3±4.4**
8
264±15**
BCG+CM+
氨基胍
(0.1 mmol/L)组
, 百拇医药
12
15.2±2.6*△
8
169±14*△
BCG+CM+
L-NAME
(0.1 mmol/L)组
12
20.7±3.4*△
8
218±14*△
, 百拇医药
BCG+CM+
地塞米松
(10 μmol/L)组
12
31.6±8.5*△
8
229±22*△
BCG+CM+
放线菌素D
(0.2 ng/L)组
9
15.5±10.1*△
, 百拇医药
4
331±34**△
注:BCG 25mg/2周;与对照组比较* P<0.05,**P<0.01;与CM对照组比较△ P<0.05
讨 论
我们对免疫性肝损伤与NO诱生相关性的研究结果提示,在免疫刺激条件下iNOS mRNA在肝细胞的表达对肝损伤的发生有重要意义。在免疫刺激条件下诱导生成的NO对于组织细胞的作用,可能既取决于NO生成的部位又与免疫性刺激的类型有关。有人在缺乏诱导型一氧化氮合酶的基因敲除小鼠观察到LPS所致死亡率增加[4];反之NO在肺组织则引起与IgA免疫复合物生成水平相一致的损伤[5]。本实验结果与后者的观察一致,即由免疫刺激所诱导生成的NO至少部分参与了肝损伤机制。本研究通过对肝细胞NOS基因表达进行原位检测,结果显示肝实质细胞NOS mRNA的表达主要定位于细胞浆,与巨噬细胞及中性粒细胞相似的胞浆可溶性iNOS,但同时也可能表达少量与存在于血管内皮细胞来源的不可溶的颗粒型(也称膜结合型)cNOS相类似的mRNA[6]。提示同一来源的细胞内有不同类型NOS同工酶存在的可能性。本研究结果还显示,不同的刺激方式所致肝细胞NO的诱生规律亦各不相同,即体内诱导法(BCG组或BCG+CM组)所致NO生成量明显大于体外诱导法(CM组);而NO生成所需时间则相反(前者为8~12小时,后者则需5~7天)。这些差异提示肝细胞iNOS诱生过程可能有其它内源性调控机制的参与,即可能与肝外细胞某种调节性蛋白合成时的转录过程有关,而在体外细胞培养条件下,这种调节性蛋白质可能缺如或达不到所需的量。
, 百拇医药
选择性调控NOS同工酶的活性及表达,一个较为可行的方法是采用L-精氨酸同系物或某种含氮物质进行调控,但目前作为药理实验工具药厂为应用的L-精氨酸衍生物类竞争性拮抗剂多数对cNOS与iNOS缺乏特异性和选择性,因此,成为限制其在临床应用的主要障碍之一。已有报告证实,氨基胍可选择性抑制血管平滑肌细胞iNOS活性,其用于治疗糖尿病血管并发症时的非酶糖化抑制作用有可能是通过其抑制NO生成作用所致[7]。本实验亦进一步证实氨基胍可对BCG免疫性肝损伤中NO生成较非选择性NOS抑制剂L-NAME有较强的抑制作用,提示氨基胍可成为较理想的选择性NOS抑制剂。比较L-NAME、氨基胍及地塞米松对免疫性肝损伤中LDH活性的抑制作用,亦显示以对iNOS选择性较高的氨基胍作用最强,L-NAME次之,地塞米松则对LDH活性影响最小,这可能是后者虽能选择性地抑制iNOS基因的表达,但是一旦iNOS已经诱导生成,则对其无直接效果所致,反之,RNA转录抑制剂放线菌素D促使肝细胞LDH活性增高,推测放线菌素D可能除抑制NOS外,还有其它机制,因此,加重了BCG+LPS所致肝损伤。由于氨基胍对体内诱导所致NO生成抑制作用显著大于体外诱导,且在体内诱导条件下其NO抑制作用强度与RNA转录抑制剂放线菌素D相当,提示前者除在底物水平对NOS活性产生竞争性拮抗作用外,尚有可能在基因表达水平对其产生调控作用,为深入研究选择性NOS抑制剂提供了新思路,其确切的作用机制有待于进一步研究。
, 百拇医药
参考文献
1 Ignarro LJ. Physiology and pathophysiology of nitric oxide. Kidney Int (suppl), 1996, 55: 2-5.
2 Zhang GL, Lin ZB. Effects of cytokines on the endotoxin stimulated nitric oxide production in the primary cultured rat hepatocytes. J Beij Med Univ, 1998, 30:180-182.
3 Bohlinger I, Leist M, Barsig J, et al. Interleukin-1 and nitric oxide protect against tumor necrosis factor α-induced liver injury through distinct pathways. Hepatology, 1995, 22: 1829-1837.
, 百拇医药
4 Wei XQ, Charles IG, Smith A, et al. Altered immune responses in mice lacking inducible nitric oxide synthase. Nature, 1995, 375: 408- 411.
5 Mulligan MS, Warren JS, Smith CW, et al. Lung injury after deposition of IgA complexes requirements for CD18 and L-arginine. J Immunol, 1992, 148: 3086-3092.
6 Knowles RG, Moncada S. Nitric oxide synthases, in mammals. Biochem J, 1994, 298 :249-258.
7 Joly GA Ayres M, Chelly F, et al. Effects of NG-methyl-L-arginine, NOG-nitro-L-arginine, and aminoguanidine on constitutive and inducible nitric oxide synthase in rat aorta. Biochem Biophys Res Comm, 1994, 199: 147-154.
本课题为国家自然科学基金资助项目
(收稿:1997-09-12 修回:1998-03-04), 百拇医药