CD44V6在大肠癌转移中作用机理的研究
作者:李祖国 丁彦青 邓永键 郭君其 朱梅刚
单位:510515 广州,第一军医大学病理教研室
关键词:大肠;肿瘤转移
中华医学杂志/981003 【摘要】 目的 研究CD44V6在大肠癌转移中的作用机理。方法 应用羊膜代基底膜模型并将大肠癌肿瘤细胞与羊膜及血管内皮共同培养,研究CD44V6对大肠癌细胞粘附基底膜与血管内皮的影响。采用共聚焦图像三维重构分析技术研究CD44V6对大肠癌细胞骨架的影响。使用激光漂白后荧光恢复技术研究CD44V6对大肠癌细胞缝隙连接细胞间通讯的影响。结果 CD44V6单抗能抑制大肠癌细胞对羊膜及血管内皮的粘附和浸润能力,影响大肠癌细胞骨架蛋白的构型和分布。但对大肠癌细胞缝隙连接细胞间通讯无明显影响。结论 CD44V6变异体能促进大肠癌细胞与血管内皮细胞及基底膜的粘附和浸润,并影响细胞骨架蛋白的构型和分布,增强肿瘤细胞的运动能力,促进肿瘤转移的发生。
, http://www.100md.com
Mechanism of CD44V6 in human colorectal carcinoma metastasis
Li Zuguo,Ding Yanqing,Deng Yongjian,et al.
Department of pathology,First Military Medical University, Guangzhou 510515
【Abstract】 Objective To study the mechanism of CD44V6 in human colorectal carcinoma (HCC) matastasis. Methods The affects of CD44V6 on HCC cell adhering to base membrane and vascular endothelium were investigated by human amniotic membrane invasion model and co-culturing HCC cell with vascular endothelium .The influence of CD44V6 variants on cytoskeleton and gap junctional intercellular communication (GJIC) was studied by immunofluorescent confocal 3-dimensional reconstruction and fluorescence recovery after photobleaching technique. Results CD44V6 antibody can decrease the ability of HCC cells to adhere to amniotic membrane and vascular endothelium. It also can affect the distribution, polymerization and depolymerization of actin of HCC cells, but does not significantly affect GJIC of HCC cells. Conclusions CD44V6 may play an important role in promoting HCC cells to adhere to vascular endothelium and base membranes and may affect the distribution, polymerization and depolymerization of actin in HCC cells and facilitate HCC cell metastasis.
, 百拇医药
【Key words】 Intestine, large Neoplasm metastasis
(Natl Med J China, 1998, 78:729-732)
CD44V6是与肿瘤转移相关的重要粘附分子,它的表达与某些肿瘤的侵袭、转移有关[1]。CD44V6在转移中的作用与其分子结构有密切关系,但它表达后究竟如何影响肿瘤的转移尚不清楚。本研究旨在进一步弄清CD44V6在肿瘤转移中的作用机理。
材料与方法
一、HT29、LoVo细胞羊膜粘附实验
羊膜代基底膜模型的制备采用Mignatti等[2]的方法。将制备好的羊膜剪成直径为2.4 cm的圆形小块,将其平贴于12孔培养板上,向已贴好羊膜的培养板孔内分别加入浓度为5×105个细胞/ml的HT29、LoVo细胞悬液各1 ml,实验组每孔另加CD44V6单克隆抗体(购自英国R&D公司,工作浓度1∶100)10 μl,对照组每孔另加0.1 mmol磷酸盐缓冲液(PBS)10 μl。盖好盖板,置于37℃、5% CO2孵育箱中培养24小时,轻轻吸去培养液,用37℃PBS漂洗羊膜3分钟,洗去未与羊膜粘附的细胞。将羊膜连同粘附其上的细胞用10%中性缓冲甲醛固定,常规石蜡切片,HE染色,显微镜观察。结果判断:每组制备10块羊膜,将羊膜每隔50μm切片,每块羊膜切片10张,光镜下观察肿瘤细胞对羊膜的粘附与浸润情况,同时计数每张切片上的细胞数。
, http://www.100md.com
二、HT29、LoVo细胞血管内皮粘附实验
无菌条件下剪开脐静脉血管,PBS冲洗内膜面,洗去红细胞,把血管剪成1 cm×1 cm的小块。将16孔培养板底灌入0.5 cm厚的石蜡,待凝固后PBS冲洗3次,无菌条件下将血管腔面朝上固定在孔底部的石蜡上。每孔中分别加入浓度为5×105个细胞/ml的HT29、LoVo细胞悬液各1 ml,实验组另加10 μl CD44V6蛋白单克隆抗体,对照组加等量PBS。盖好盖板,置37 ℃、5% CO2孵育箱内孵育8小时。取出脐血管,PBS漂洗2次,每次3分钟,2.5%缓冲戊二醛固定30分钟,漂洗,脱水,临界点干燥,喷金,扫描电镜下观察。结果判断:用电镜放大500倍观察,计数每个视野下粘附于血管内皮上的肿瘤细胞数,每组随机计数10个视野。
三、CD44V6单克隆抗体对HT29、LoVo细胞骨架的影响
1.CD44V6影响HT29、LoVo细胞骨架肌动蛋白分布的免疫荧光检测:将生长状态良好的HT29、LoVo细胞用胰酶消化,制成浓度为5×105个细胞/ml的细胞悬液,实验组细胞悬液加CD44V6单克隆抗体(1∶100稀释),对照组加等量PBS。将细胞悬液接种于盖玻片上,置37 ℃、5%CO2孵育箱内孵育24小时。将盖片取出,经漂洗、固定、过冷丙酮等处理后,加入细胞骨架肌动蛋白单克隆抗体(美国Sigma公司, 1:40稀释),37 ℃恒温孵育180分钟,PBS漂洗3分钟,加 FITC标记羊抗兔IgG(美国Sigma公司,1:50稀释),37 ℃恒温孵育180分钟,PBS 漂洗3分钟,缓冲甘油封片,荧光显微镜观察,照相。
, 百拇医药
2.细胞骨架荧光图像共聚焦三维重构分析:将上述制好的细胞片,用ACAS-570共聚焦显微镜分析检测,从X、Y、Z 3个方向进行激光断层扫描,然后通过计算机对图像进行重构分析,得出细胞内荧光物的不同断层构型和立体构型。以对细胞骨架构型变化进行分析。
四、CD44V6对LoVo细胞缝隙连接细胞间通讯的影响
应用激光漂白后荧光恢复技术在ACAS-570共聚焦显微镜上检测LoVo细胞缝隙连接细胞间通讯:将约1×105个LoVo细胞于检测前48小时分别接种于直径为36 mm的Petri平皿中,实验组细胞悬液加CD44V6蛋白单克隆抗体(1∶100稀释),对照组加等量PBS。置37℃、5% CO2孵育箱内孵育48小时。检测前弃去原培养液,PBS漂洗3分钟,用浓度为10 μg/ml荧光分子染料6-羟荧光素乙酰乙酸脂(美国Sigma公司)在37℃染色15分钟。然后采用Anders等[3]的方法,使用ACAS-570共聚焦显微镜检测LoVo细胞的缝隙连接细胞间通讯。
, 百拇医药
五、统计学处理
数据以s表示,采用t检验。
结果
一、HT29、LoVo细胞羊膜粘附实验
两种细胞都有与羊膜粘附的能力,LoVo细胞与羊膜粘附的能力较强,与羊膜共同培育24小时后,可见成团细胞粘附于羊膜表面,能见到羊膜表面有降解的现象,并可见部分LoVo细胞向羊膜内浸润(图1),但未见HT29细胞向羊膜内浸润。将两种细胞用CD44V6单抗封闭后,粘附于羊膜表面的细胞数明显减少,未见羊膜表面有降解的现象及向羊膜内浸润现象(图2)。处理组与羊膜粘附的细胞均数明显低于对照组,差异有非常显著意义(表1)
表1 HT29、LoVo细胞羊膜粘附实验结果(细胞数,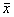 ±s) 组别
±s) 组别
, http://www.100md.com
样本数
HT29细胞
LoVo细胞
处理组
100
1.8±1.3
2.5±1.8
对照组
100
7.3±2.1
12.3±4.1
t值
7.201
, http://www.100md.com
7.502
P值
0.000 1
0.000 1
二、HT29、LoVo细胞与血管内皮细胞粘附实验
对照组HT29、LoVo细胞均对脐血管内皮有粘附能力,并可见到少数肿瘤细胞向脐血管内皮细胞间的缝隙内侵入的现象。其中对照组LoVo细胞与脐血管内皮的粘附能力较HT29细胞强。实验组HT29、LoVo细胞对脐血管内皮的粘附能力明显下降,仅见少量瘤细胞粘附于脐血管内皮表面,未见瘤细胞向脐血管内皮细胞间的缝隙内侵入的现象。电镜下:处理组每个视野下与血管内皮粘附的细胞均数比对照组明显少,两者比较差异有非常显著意义(表2)。两种细胞经CD44V6单抗封闭前后及血管内皮细胞粘附的形态学变化不明显。表2 HT29、LoVo细胞与血管内皮粘附实验
, http://www.100md.com
结果(细胞数,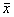 ±s) 组别
±s) 组别
样本数
HT29细胞
LoVo细胞
处理组
10
18± 5
62±19
对照组
10
143±27
260±35
, http://www.100md.com
t值
13.75
13.16
P值
0.000 1
0.000 1
三、CD44V6单克隆抗体对HT29、LoVo细胞骨架蛋白的影响
免疫荧光染色观察,HT29、LoVo细胞骨架蛋白actin较集中地分布于细胞核周围,似环状结构,胞
图1 对照组LoVo细胞与羊膜粘附的能力较强,可见成团细胞粘附于羊膜表面,羊膜表面有 降解及部分LoVo细胞向羊膜内浸润(↑) HE ×400(图2~6同) 图2 处理组LoVo细胞粘附于羊膜表面的细胞数明显减少,未见羊膜表面有降解及LoVo细胞向羊膜内浸润现象 HE 图3 对照组LoVo细胞缝隙连接细胞间通讯功能检测,这是激光漂白前的图像,图内数字为实验时检测细胞的序号(图3~5同) 共聚焦显微镜CFDA染色(图4~6同) 图4 对照组LoVo细胞缝隙连接细胞间通讯功能检测,这是激光漂白后荧光逐步恢复时的图像 图5 处理组LoVo细胞缝隙连接细胞间通讯功能检测,这是激光漂白前的图像 图6 处理组LoVo细胞缝隙连接细胞间通讯功能变化不大,这是激光漂白后的图像荧光逐步恢复时的图像
, http://www.100md.com
浆内呈细网状均匀一致的分布。经抗CD44V6单抗处理后,细胞骨架肌动蛋白构型发生变化,肌动蛋白呈解聚状态,荧光强度减弱,肌动蛋白在细胞核周集中分布的现象即环状结构消失,并且散在分布于细胞浆内。细胞骨架荧光图像共聚焦三维重构分析结果亦清楚地显示:LoVo细胞骨架肌动蛋白较集中地分布于细胞核周围,胞浆内呈细网状均匀一致的分布。经抗CD44V6单抗处理,细胞骨架肌动蛋白发生构型变化,肌动蛋白不再在细胞核周集中分布,且荧光强度减弱,呈解聚状态,散在分布于细胞浆内。
四、CD44V6单克隆抗体对LoVo细胞缝隙连接细胞间通讯的影响
LoVo细胞缝隙连接细胞间通讯结果显示:LoVo细胞系同一批传代细胞中,各不同的肿瘤细胞彼此之间的缝隙连接细胞间通信功能不一致,部分细胞缝隙连接细胞间通讯功能很低,部分细胞缝隙连接细胞间通讯功能较高(图3,4)。将LoVo细胞用抗CD44V6单抗封闭,LoVo细胞缝隙连接细胞间通讯功能变化不大(图5,6)。处理组LoVo细胞激光漂白10分钟后荧光恢复百分率的平均值为(24±13)%,对照组为(20±14)%,但差异无显著意义(P>0.05)。讨论
, 百拇医药
CD44标准体是一种细胞表面的跨膜糖蛋白粘附分子,其细胞膜内区羧基端通过锚蛋白、埃兹蛋白、膜突蛋白、根蛋白与细胞骨架肌动蛋白相连[4]。细胞膜外区有透明质酸、胶原、纤维连接素、硫酸软骨素的结合位点[5],CD44通过细胞膜外受体与相应的配体结合,参与细胞与细胞及细胞外基质的粘附。CD44V6的结构与CD44标准体的基本结构相似,但在细胞膜外靠近细胞膜区插入了43个由V6变异拼接型外显子所编码的不同序列的氨基酸[1]。这些氨基酸的插入有可能增加了胶原、纤维连接素、硫酸软骨素的接合位点,也可能使透明质酸接合位点发生空间结构的变化,导致与透明质酸的结合能力变强或减弱。同时亦有可能导致细胞内羧基端结构发生变化,影响细胞内骨架分布,细胞粘附、运动和细胞间信号传导。本实验研究了CD44V6对肿瘤细胞粘附和浸润基底膜能力的影响,表明经抗CD44V6变异体单抗封闭后的肿瘤细胞与羊膜的粘附能力明显下降,浸润能力消失,同时亦失去降解羊膜的能力。说明CD44V6可能通过细胞外羧基端透明质酸、胶原、纤维连接蛋白等受体与细胞外基质成分透明质酸、胶原、纤维连接蛋白结合,促进肿瘤细胞与细胞外基质的粘附,亦有可能促进肿瘤细胞释放蛋白水解酶,使细胞外基质降解,促进肿瘤细胞向细胞外基质浸润。同时我们还发现,应用抗CD44V6变异体单克隆抗体封闭HT29、LoVo细胞后,HT29、LoVo细胞与血管内皮细胞的粘附力下降。说明CD44V6也能促进瘤细胞与血管内皮细胞的粘附。
, 百拇医药
细胞骨架是细胞浆中一组由细纤维网状物质组成的网架结构,具有维持细胞形状、运动能力的功能[6]。肿瘤细胞内肌动蛋白的分布、结构和功能变化与肿瘤的生物学行为和转移能力有关[7]。本结果还显示,未经CD44V6单抗封闭的HT29、LoVo细胞内肌动蛋白主要集中分布在细胞核的周围呈环状结构,部分呈细丝状分布于胞浆内。经CD44V6单抗封闭后癌细胞内肌动蛋白的构型和分布发生改变,部分actin呈解聚状态,荧光强度减弱,绕核分布的环状结构消失,骨架蛋白散在分布于细胞浆的边缘。因此,我们认为CD44V6变异体能通过细胞内羧基端结构影响细胞内骨架蛋白的构型和分布,影响肿瘤细胞的运动能力,促进肿瘤转移的发生。
我们对大肠癌细胞缝隙连接细胞间通讯功能的研究发现,大肠癌LoVo细胞系缝隙连接细胞间通讯功能不一致。这说明同一肿瘤细胞系的不同细胞,存在着分化程度的不一致性,分化好的肿瘤细胞的缝隙连接细胞间通讯功能较高,而分化差的肿瘤细胞缝隙连接细胞间通讯功能较低。用抗CD44V6变异体单抗封闭大肠癌LoVo细胞,发现封闭后的LoVo细胞缝隙连接细胞间通讯功能变化不大。因此,我们认为CD44V6对肿瘤细胞与肿瘤细胞间的缝隙连接细胞间通讯功能的调节作用不大。
, http://www.100md.com
本题为军队“九五重大攻关基金资助项目”
参考文献
1 Dammrich J, Vollmers HP, Heider RH, et al. Importance of different CD44v6 expression in human gastric intestinal and diffuse type cancers for metastatic lymphogenic spreading. J Mol Med, 1995, 73:395-401.
2 Mignatti P, Robbine E, Rifkin DB. Tumor invasion through the human amniotic membrane : requirement for a proteinase cascade. Cell , 1986,47:487-498.
, 百拇医药
3 Anders JJ,Salopek M. Meningeal cells increase in vitro astrocytic gap junctional communication as measured by fluorescence recovery after laser photobleaching. J Neurocytol, 1989,18:257-262.
4 Tsukita S,Oishi K,Sato N,et al.EMR family members as molecular linkers between the cell surface glycoprotein CD44 and actin based cytoskeletons.J Cell Biol,1994,126:391-401.
5 Stamenkovic I,Amiot M,Pesando JM,et al.A lymphocyte molecule implicated in lymph node homing is a member of the cartilage link protein family.Cell, 1989,56:1057-1062.
6 Luna EJ, Hitl AL.Cytoskeleton-plasma membrane.Science,1992,258:955-963.
7 Cunningham CC.Actin structural proteins in cell motility. Cancer Matstasis Rev,1992,11:69-77
(收稿:1997-07-28 修回:1998-07-10), 百拇医药
单位:510515 广州,第一军医大学病理教研室
关键词:大肠;肿瘤转移
中华医学杂志/981003 【摘要】 目的 研究CD44V6在大肠癌转移中的作用机理。方法 应用羊膜代基底膜模型并将大肠癌肿瘤细胞与羊膜及血管内皮共同培养,研究CD44V6对大肠癌细胞粘附基底膜与血管内皮的影响。采用共聚焦图像三维重构分析技术研究CD44V6对大肠癌细胞骨架的影响。使用激光漂白后荧光恢复技术研究CD44V6对大肠癌细胞缝隙连接细胞间通讯的影响。结果 CD44V6单抗能抑制大肠癌细胞对羊膜及血管内皮的粘附和浸润能力,影响大肠癌细胞骨架蛋白的构型和分布。但对大肠癌细胞缝隙连接细胞间通讯无明显影响。结论 CD44V6变异体能促进大肠癌细胞与血管内皮细胞及基底膜的粘附和浸润,并影响细胞骨架蛋白的构型和分布,增强肿瘤细胞的运动能力,促进肿瘤转移的发生。
, http://www.100md.com
Mechanism of CD44V6 in human colorectal carcinoma metastasis
Li Zuguo,Ding Yanqing,Deng Yongjian,et al.
Department of pathology,First Military Medical University, Guangzhou 510515
【Abstract】 Objective To study the mechanism of CD44V6 in human colorectal carcinoma (HCC) matastasis. Methods The affects of CD44V6 on HCC cell adhering to base membrane and vascular endothelium were investigated by human amniotic membrane invasion model and co-culturing HCC cell with vascular endothelium .The influence of CD44V6 variants on cytoskeleton and gap junctional intercellular communication (GJIC) was studied by immunofluorescent confocal 3-dimensional reconstruction and fluorescence recovery after photobleaching technique. Results CD44V6 antibody can decrease the ability of HCC cells to adhere to amniotic membrane and vascular endothelium. It also can affect the distribution, polymerization and depolymerization of actin of HCC cells, but does not significantly affect GJIC of HCC cells. Conclusions CD44V6 may play an important role in promoting HCC cells to adhere to vascular endothelium and base membranes and may affect the distribution, polymerization and depolymerization of actin in HCC cells and facilitate HCC cell metastasis.
, 百拇医药
【Key words】 Intestine, large Neoplasm metastasis
(Natl Med J China, 1998, 78:729-732)
CD44V6是与肿瘤转移相关的重要粘附分子,它的表达与某些肿瘤的侵袭、转移有关[1]。CD44V6在转移中的作用与其分子结构有密切关系,但它表达后究竟如何影响肿瘤的转移尚不清楚。本研究旨在进一步弄清CD44V6在肿瘤转移中的作用机理。
材料与方法
一、HT29、LoVo细胞羊膜粘附实验
羊膜代基底膜模型的制备采用Mignatti等[2]的方法。将制备好的羊膜剪成直径为2.4 cm的圆形小块,将其平贴于12孔培养板上,向已贴好羊膜的培养板孔内分别加入浓度为5×105个细胞/ml的HT29、LoVo细胞悬液各1 ml,实验组每孔另加CD44V6单克隆抗体(购自英国R&D公司,工作浓度1∶100)10 μl,对照组每孔另加0.1 mmol磷酸盐缓冲液(PBS)10 μl。盖好盖板,置于37℃、5% CO2孵育箱中培养24小时,轻轻吸去培养液,用37℃PBS漂洗羊膜3分钟,洗去未与羊膜粘附的细胞。将羊膜连同粘附其上的细胞用10%中性缓冲甲醛固定,常规石蜡切片,HE染色,显微镜观察。结果判断:每组制备10块羊膜,将羊膜每隔50μm切片,每块羊膜切片10张,光镜下观察肿瘤细胞对羊膜的粘附与浸润情况,同时计数每张切片上的细胞数。
, http://www.100md.com
二、HT29、LoVo细胞血管内皮粘附实验
无菌条件下剪开脐静脉血管,PBS冲洗内膜面,洗去红细胞,把血管剪成1 cm×1 cm的小块。将16孔培养板底灌入0.5 cm厚的石蜡,待凝固后PBS冲洗3次,无菌条件下将血管腔面朝上固定在孔底部的石蜡上。每孔中分别加入浓度为5×105个细胞/ml的HT29、LoVo细胞悬液各1 ml,实验组另加10 μl CD44V6蛋白单克隆抗体,对照组加等量PBS。盖好盖板,置37 ℃、5% CO2孵育箱内孵育8小时。取出脐血管,PBS漂洗2次,每次3分钟,2.5%缓冲戊二醛固定30分钟,漂洗,脱水,临界点干燥,喷金,扫描电镜下观察。结果判断:用电镜放大500倍观察,计数每个视野下粘附于血管内皮上的肿瘤细胞数,每组随机计数10个视野。
三、CD44V6单克隆抗体对HT29、LoVo细胞骨架的影响
1.CD44V6影响HT29、LoVo细胞骨架肌动蛋白分布的免疫荧光检测:将生长状态良好的HT29、LoVo细胞用胰酶消化,制成浓度为5×105个细胞/ml的细胞悬液,实验组细胞悬液加CD44V6单克隆抗体(1∶100稀释),对照组加等量PBS。将细胞悬液接种于盖玻片上,置37 ℃、5%CO2孵育箱内孵育24小时。将盖片取出,经漂洗、固定、过冷丙酮等处理后,加入细胞骨架肌动蛋白单克隆抗体(美国Sigma公司, 1:40稀释),37 ℃恒温孵育180分钟,PBS漂洗3分钟,加 FITC标记羊抗兔IgG(美国Sigma公司,1:50稀释),37 ℃恒温孵育180分钟,PBS 漂洗3分钟,缓冲甘油封片,荧光显微镜观察,照相。
, 百拇医药
2.细胞骨架荧光图像共聚焦三维重构分析:将上述制好的细胞片,用ACAS-570共聚焦显微镜分析检测,从X、Y、Z 3个方向进行激光断层扫描,然后通过计算机对图像进行重构分析,得出细胞内荧光物的不同断层构型和立体构型。以对细胞骨架构型变化进行分析。
四、CD44V6对LoVo细胞缝隙连接细胞间通讯的影响
应用激光漂白后荧光恢复技术在ACAS-570共聚焦显微镜上检测LoVo细胞缝隙连接细胞间通讯:将约1×105个LoVo细胞于检测前48小时分别接种于直径为36 mm的Petri平皿中,实验组细胞悬液加CD44V6蛋白单克隆抗体(1∶100稀释),对照组加等量PBS。置37℃、5% CO2孵育箱内孵育48小时。检测前弃去原培养液,PBS漂洗3分钟,用浓度为10 μg/ml荧光分子染料6-羟荧光素乙酰乙酸脂(美国Sigma公司)在37℃染色15分钟。然后采用Anders等[3]的方法,使用ACAS-570共聚焦显微镜检测LoVo细胞的缝隙连接细胞间通讯。
, 百拇医药
五、统计学处理
数据以s表示,采用t检验。
结果
一、HT29、LoVo细胞羊膜粘附实验
两种细胞都有与羊膜粘附的能力,LoVo细胞与羊膜粘附的能力较强,与羊膜共同培育24小时后,可见成团细胞粘附于羊膜表面,能见到羊膜表面有降解的现象,并可见部分LoVo细胞向羊膜内浸润(图1),但未见HT29细胞向羊膜内浸润。将两种细胞用CD44V6单抗封闭后,粘附于羊膜表面的细胞数明显减少,未见羊膜表面有降解的现象及向羊膜内浸润现象(图2)。处理组与羊膜粘附的细胞均数明显低于对照组,差异有非常显著意义(表1)
表1 HT29、LoVo细胞羊膜粘附实验结果(细胞数,
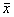 ±s) 组别
±s) 组别, http://www.100md.com
样本数
HT29细胞
LoVo细胞
处理组
100
1.8±1.3
2.5±1.8
对照组
100
7.3±2.1
12.3±4.1
t值
7.201
, http://www.100md.com
7.502
P值
0.000 1
0.000 1
二、HT29、LoVo细胞与血管内皮细胞粘附实验
对照组HT29、LoVo细胞均对脐血管内皮有粘附能力,并可见到少数肿瘤细胞向脐血管内皮细胞间的缝隙内侵入的现象。其中对照组LoVo细胞与脐血管内皮的粘附能力较HT29细胞强。实验组HT29、LoVo细胞对脐血管内皮的粘附能力明显下降,仅见少量瘤细胞粘附于脐血管内皮表面,未见瘤细胞向脐血管内皮细胞间的缝隙内侵入的现象。电镜下:处理组每个视野下与血管内皮粘附的细胞均数比对照组明显少,两者比较差异有非常显著意义(表2)。两种细胞经CD44V6单抗封闭前后及血管内皮细胞粘附的形态学变化不明显。表2 HT29、LoVo细胞与血管内皮粘附实验
, http://www.100md.com
结果(细胞数,
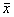 ±s) 组别
±s) 组别样本数
HT29细胞
LoVo细胞
处理组
10
18± 5
62±19
对照组
10
143±27
260±35
, http://www.100md.com
t值
13.75
13.16
P值
0.000 1
0.000 1
三、CD44V6单克隆抗体对HT29、LoVo细胞骨架蛋白的影响
免疫荧光染色观察,HT29、LoVo细胞骨架蛋白actin较集中地分布于细胞核周围,似环状结构,胞

图1 对照组LoVo细胞与羊膜粘附的能力较强,可见成团细胞粘附于羊膜表面,羊膜表面有 降解及部分LoVo细胞向羊膜内浸润(↑) HE ×400(图2~6同) 图2 处理组LoVo细胞粘附于羊膜表面的细胞数明显减少,未见羊膜表面有降解及LoVo细胞向羊膜内浸润现象 HE 图3 对照组LoVo细胞缝隙连接细胞间通讯功能检测,这是激光漂白前的图像,图内数字为实验时检测细胞的序号(图3~5同) 共聚焦显微镜CFDA染色(图4~6同) 图4 对照组LoVo细胞缝隙连接细胞间通讯功能检测,这是激光漂白后荧光逐步恢复时的图像 图5 处理组LoVo细胞缝隙连接细胞间通讯功能检测,这是激光漂白前的图像 图6 处理组LoVo细胞缝隙连接细胞间通讯功能变化不大,这是激光漂白后的图像荧光逐步恢复时的图像
, http://www.100md.com
浆内呈细网状均匀一致的分布。经抗CD44V6单抗处理后,细胞骨架肌动蛋白构型发生变化,肌动蛋白呈解聚状态,荧光强度减弱,肌动蛋白在细胞核周集中分布的现象即环状结构消失,并且散在分布于细胞浆内。细胞骨架荧光图像共聚焦三维重构分析结果亦清楚地显示:LoVo细胞骨架肌动蛋白较集中地分布于细胞核周围,胞浆内呈细网状均匀一致的分布。经抗CD44V6单抗处理,细胞骨架肌动蛋白发生构型变化,肌动蛋白不再在细胞核周集中分布,且荧光强度减弱,呈解聚状态,散在分布于细胞浆内。
四、CD44V6单克隆抗体对LoVo细胞缝隙连接细胞间通讯的影响
LoVo细胞缝隙连接细胞间通讯结果显示:LoVo细胞系同一批传代细胞中,各不同的肿瘤细胞彼此之间的缝隙连接细胞间通信功能不一致,部分细胞缝隙连接细胞间通讯功能很低,部分细胞缝隙连接细胞间通讯功能较高(图3,4)。将LoVo细胞用抗CD44V6单抗封闭,LoVo细胞缝隙连接细胞间通讯功能变化不大(图5,6)。处理组LoVo细胞激光漂白10分钟后荧光恢复百分率的平均值为(24±13)%,对照组为(20±14)%,但差异无显著意义(P>0.05)。讨论
, 百拇医药
CD44标准体是一种细胞表面的跨膜糖蛋白粘附分子,其细胞膜内区羧基端通过锚蛋白、埃兹蛋白、膜突蛋白、根蛋白与细胞骨架肌动蛋白相连[4]。细胞膜外区有透明质酸、胶原、纤维连接素、硫酸软骨素的结合位点[5],CD44通过细胞膜外受体与相应的配体结合,参与细胞与细胞及细胞外基质的粘附。CD44V6的结构与CD44标准体的基本结构相似,但在细胞膜外靠近细胞膜区插入了43个由V6变异拼接型外显子所编码的不同序列的氨基酸[1]。这些氨基酸的插入有可能增加了胶原、纤维连接素、硫酸软骨素的接合位点,也可能使透明质酸接合位点发生空间结构的变化,导致与透明质酸的结合能力变强或减弱。同时亦有可能导致细胞内羧基端结构发生变化,影响细胞内骨架分布,细胞粘附、运动和细胞间信号传导。本实验研究了CD44V6对肿瘤细胞粘附和浸润基底膜能力的影响,表明经抗CD44V6变异体单抗封闭后的肿瘤细胞与羊膜的粘附能力明显下降,浸润能力消失,同时亦失去降解羊膜的能力。说明CD44V6可能通过细胞外羧基端透明质酸、胶原、纤维连接蛋白等受体与细胞外基质成分透明质酸、胶原、纤维连接蛋白结合,促进肿瘤细胞与细胞外基质的粘附,亦有可能促进肿瘤细胞释放蛋白水解酶,使细胞外基质降解,促进肿瘤细胞向细胞外基质浸润。同时我们还发现,应用抗CD44V6变异体单克隆抗体封闭HT29、LoVo细胞后,HT29、LoVo细胞与血管内皮细胞的粘附力下降。说明CD44V6也能促进瘤细胞与血管内皮细胞的粘附。
, 百拇医药
细胞骨架是细胞浆中一组由细纤维网状物质组成的网架结构,具有维持细胞形状、运动能力的功能[6]。肿瘤细胞内肌动蛋白的分布、结构和功能变化与肿瘤的生物学行为和转移能力有关[7]。本结果还显示,未经CD44V6单抗封闭的HT29、LoVo细胞内肌动蛋白主要集中分布在细胞核的周围呈环状结构,部分呈细丝状分布于胞浆内。经CD44V6单抗封闭后癌细胞内肌动蛋白的构型和分布发生改变,部分actin呈解聚状态,荧光强度减弱,绕核分布的环状结构消失,骨架蛋白散在分布于细胞浆的边缘。因此,我们认为CD44V6变异体能通过细胞内羧基端结构影响细胞内骨架蛋白的构型和分布,影响肿瘤细胞的运动能力,促进肿瘤转移的发生。
我们对大肠癌细胞缝隙连接细胞间通讯功能的研究发现,大肠癌LoVo细胞系缝隙连接细胞间通讯功能不一致。这说明同一肿瘤细胞系的不同细胞,存在着分化程度的不一致性,分化好的肿瘤细胞的缝隙连接细胞间通讯功能较高,而分化差的肿瘤细胞缝隙连接细胞间通讯功能较低。用抗CD44V6变异体单抗封闭大肠癌LoVo细胞,发现封闭后的LoVo细胞缝隙连接细胞间通讯功能变化不大。因此,我们认为CD44V6对肿瘤细胞与肿瘤细胞间的缝隙连接细胞间通讯功能的调节作用不大。
, http://www.100md.com
本题为军队“九五重大攻关基金资助项目”
参考文献
1 Dammrich J, Vollmers HP, Heider RH, et al. Importance of different CD44v6 expression in human gastric intestinal and diffuse type cancers for metastatic lymphogenic spreading. J Mol Med, 1995, 73:395-401.
2 Mignatti P, Robbine E, Rifkin DB. Tumor invasion through the human amniotic membrane : requirement for a proteinase cascade. Cell , 1986,47:487-498.
, 百拇医药
3 Anders JJ,Salopek M. Meningeal cells increase in vitro astrocytic gap junctional communication as measured by fluorescence recovery after laser photobleaching. J Neurocytol, 1989,18:257-262.
4 Tsukita S,Oishi K,Sato N,et al.EMR family members as molecular linkers between the cell surface glycoprotein CD44 and actin based cytoskeletons.J Cell Biol,1994,126:391-401.
5 Stamenkovic I,Amiot M,Pesando JM,et al.A lymphocyte molecule implicated in lymph node homing is a member of the cartilage link protein family.Cell, 1989,56:1057-1062.
6 Luna EJ, Hitl AL.Cytoskeleton-plasma membrane.Science,1992,258:955-963.
7 Cunningham CC.Actin structural proteins in cell motility. Cancer Matstasis Rev,1992,11:69-77
(收稿:1997-07-28 修回:1998-07-10), 百拇医药