免疫调节剂对烫伤大鼠分泌细胞因子能力的影响
作者:卓安山 陈爱娟 杨晓琳 申繁星
单位:132011 吉林市,中国人民解放军第四六五医院(卓安山,申繁星),中国人民解放军空军医学高等专科学校(陈爱娟);中国医科大学微生物学教室(杨晓琳)
关键词:
中华医学杂志981125
我们以烧伤感染中最常见的三种致病菌为抗原,免疫动物,然后从致敏动物的肝脾中提取特异性iRNA,利用烫伤大鼠实验模型,探讨其对烫伤大鼠细胞因子产生能力的影响,并与黄芪多糖和β1,3多聚葡萄糖(葡聚糖)作对照,现报道如下。
一、材料和方法
1.实验材料:(1)动物Wistar健康大106只,鼠龄3个月,体重180~220 g,雌雄各半,购自白求恩医科大学动物所,实验前先在实验室习服6~7天。(2)试剂及培养液:RPMI1640培养液,美国Gibco公司生产,常规加谷氨酰胺2 mmol/L,Hepes 20 mmol/L,青霉素100 U/ml,链霉素100 μg/ml和10%小牛血清。噻唑蓝(MTT,Fluka公司提供):临用前用PBS液配成5 mg/ml,低温避光保存。刺激原:LPS和ConA购自Sigma公司。IL-2标准品由日本友人中村康弘先生惠赠,IL-6标准品由美国Genetech公司提供,比活性为1×107 U/mg。(3)细胞因子依赖细胞株:CTLL-2细胞和L929细胞由中国医科大学微生物教研室惠赠;IL-6依赖细胞株B9.9细胞由浙江医科大学免疫学教研室惠赠。(4)免疫调节剂:黄芪注射液成都地奥九泓制药厂生产,以生理盐水配制成50 mg/ml。葡聚糖Meades博士惠赠,用生理盐水配成60 mg/ml。特异性iRNA制备参见文献[1]。(5)菌悬液制备:将从烧伤病人感染创面中分离获得的菌种(金葡菌、大肠杆菌和绿脓杆菌)分别接种于100 ml肉汤培养基中,37℃孵育16小时后去上清,用比浊法调整细菌浓度为1×109/ml,用于创面涂菌。(6)烫伤模型制备:实验前1天,鼠背一定面积用8%硫化钠脱毛,实验当天,在非麻醉状态下,将大鼠背部浸入100℃恒温沸水中12秒,致25%体表面积的Ⅲ度烫伤(经病理切片证实),伤后立即腹腔内注射生理盐水6 ml以抗休克。10分钟后创面涂上述3种细菌的混悬液,每只1 ml,然后分笼饲养,自由进食水。
, 百拇医药
2.动物分组:将96只烫伤大鼠随机分成4组,每组24只。(1)对照组,注射生理盐水1 ml;(2)iRNA组,注射特异性iRNA 1 ml(含1 mg,3种iRNA各取1/3量);(3)黄芪组,注射黄芪注射液1 ml(含50 mg,相当于每日给药剂量为250 mg/kg);(4)葡聚糖组,注射葡聚糖1 ml(含60 mg)。以上各组均自伤后当天(即6小时内)开始腹腔注射,每天1次,连用3天。(5)另设正常组10只,注射生理盐水1 ml,用法及用量同对照组。
表1 正常及烫伤大鼠脾细胞及腹腔Mφ产生细胞因子能力测定结果(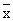 ±s) 组别
±s) 组别
鼠数
IL-2(U/ml)
IL-6(U/ml)
, 百拇医药
TNF(U/ml)
TL-1(A570nm)
正常组
10
62±9
6.4±2.9
10±3
0.41±0.025
伤后1天
8
54±7*
12±4△
, 百拇医药
17±3△
0.54±0.03*
伤后5天
6
38±8△
16±4△
28±4△
0.69±0.03△
伤后10天
4
37±7△
, 百拇医药
22±5△
33±4△
0.7±0.03△
注:与正常组比较* P<0.05,△ P<0.01表2 不同免疫调节剂对烫伤大鼠脾细胞产生IL-2、IL-6能力的影响(U/ml,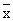 ±s) 组别
±s) 组别
IL-2
IL-6
伤后1天
伤后5天
伤后10天
, http://www.100md.com
伤后1天
伤后5天
伤后10天
对照组
54±7(8)
38±8(6)
37±7(4)
12±4(8)
16±4(6)
22±5
iRNA组
54±7(8)
52±6△(8)
, 百拇医药
59±7△(7)
11±3(8)
12±3*(8)
10±3△(7)
黄芪组
53±6(8)
51±6△(8)
57±7△(6)
11±3(8)
14±4(8)
13±4*(6)
, 百拇医药
葡聚糖组
54±7(8)
48±7△(7)
52±7△(5)
11±3(8)
14±4(7)
14±4*(5)
注:括号内为鼠数,与对照组比* P<0.05,△ P<0.01 表3同 3.实验方法:(1)标本采集:每组动物分别于伤后第1、5、10天各取8只活杀,留取标本待测。
(2)脾细胞IL-2活性测定参照文献[2],结果以U/ml表示。脾细胞IL-6活性测定参见文献[3],与IL-6标准品比较后,确定其活性单位,结果以U/ml表示。腹腔MφTNF活性测定方法根据文献[4],结果以U/ml表示。腹腔Mφ产生IL-1活性测定采用小鼠胸腺细胞增殖法,结果以A570nm值表示。
, 百拇医药
二、结果
1.正常烫伤后大鼠脾细胞及腹腔Mφ产生细胞因子能力的测定(表1)
2.不同免疫调节剂对烫伤大鼠脾细胞产生IL-2、IL-6能力的影响:由表2
表3 不同免疫调节剂对烫伤大鼠腹腔Mφ产生TNF、IL-1活性的影响(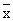 ±s) 组别
±s) 组别
TNF
IL-1
伤后1天
伤后5天
伤后10天
, http://www.100md.com
伤后1天
伤后5天
伤后10天
对照组
17±3(8)
28±4(6)
33±4(4)
0.54±0.028(8)
0.69±0.031(6)
0.71±0.033(4)
iRNA组
17±4(8)
, http://www.100md.com
19±4△(8)
16±5△(7)
0.55±0.027(8)
0.56±0.029*(8)
0.51±0.030*(7)
黄芪组
17±4(8)
20±5△(8)
18±5△(6)
0.53±0.028(8)
, 百拇医药
0.58±0.031*(8)
0.54±0.32*(6)
葡聚糖组
17±4(8)
21±5*(7)
22±6*(5)
0.55±0.026(8)
0.63±0.033*(7)
0.58±0.034*(5)
可见,烫伤后大鼠脾细胞产生IL-2能力下降,在伤后第10天时降至正常的59.3%。应用免疫调节剂治疗后,各组IL-2活性明显提高,与未用药的对照组比较,差异有显著意义(P<0.01)。对照组IL-6则显著升高,而用药组升高不明显,尤为iRNA组最佳。
, 百拇医药
3.不同免疫调节剂对烫伤大鼠腹腔Mφ产生TNF、IL-1活性的影响:表3显示,免疫调节剂对烫伤大鼠腹腔Mφ产生TNF、IL-1活性有明显的调节作用。
三、讨论
本研究显示,烫伤后第1~10天大鼠脾细胞及腹腔Mφ产生细胞因子能力异常,表现IL-2产生减少,IL-1、IL-6和TNF产生增高,且伤后第10天比第1天更明显,证实烫伤后大鼠细胞因子产生能力严重受损。
本研究试以烧伤感染中最常见的3种致病菌为抗原,免疫动物,从致敏动物的肝脾中提取特异性iRNA,发现,伤后6小时内腹腔注射特异性iRNA可明显改善伤鼠的免疫功能,促进伤鼠淋巴细胞产生细胞因子能力恢复正常,且其疗效明显优于黄芪和葡聚糖。说明伤后早期应用特异性iRNA对纠正伤鼠免疫功能失常具有重要的作用。
本课题为全军“八五”青年基金资助项目
, 百拇医药
参考文献
1 卓安山,张德林,申繁星,等.特异性iRNA预防烧伤感染的临床和实验研究.吉林医学,1995,16:321-325.
2 Tada H, Shiho O, Kuroshima K, et al. An improved colourimetric assay for interleukin-2. J Immunol Methods, 1986, 93:157-160.
3 Muraguchi A, Hirano T, Tang B, et al. The essential role of B cell stimulatory factor 2 (BSF-2/IL-6) for the terminal differentiation of B cells. J Exp Med, 1988, 167:332-338.
4 Lora MG, Jeanne LR, Carl F, et al. Rapid colormetric assay for cell viability: application to the quantitation of cytotoxic and growth inhibition lymphokines. J Immunol Methods, 1984, 70:257-262.
(收稿:1997-11-24 修回:1998-08-18), 百拇医药
单位:132011 吉林市,中国人民解放军第四六五医院(卓安山,申繁星),中国人民解放军空军医学高等专科学校(陈爱娟);中国医科大学微生物学教室(杨晓琳)
关键词:
中华医学杂志981125
我们以烧伤感染中最常见的三种致病菌为抗原,免疫动物,然后从致敏动物的肝脾中提取特异性iRNA,利用烫伤大鼠实验模型,探讨其对烫伤大鼠细胞因子产生能力的影响,并与黄芪多糖和β1,3多聚葡萄糖(葡聚糖)作对照,现报道如下。
一、材料和方法
1.实验材料:(1)动物Wistar健康大106只,鼠龄3个月,体重180~220 g,雌雄各半,购自白求恩医科大学动物所,实验前先在实验室习服6~7天。(2)试剂及培养液:RPMI1640培养液,美国Gibco公司生产,常规加谷氨酰胺2 mmol/L,Hepes 20 mmol/L,青霉素100 U/ml,链霉素100 μg/ml和10%小牛血清。噻唑蓝(MTT,Fluka公司提供):临用前用PBS液配成5 mg/ml,低温避光保存。刺激原:LPS和ConA购自Sigma公司。IL-2标准品由日本友人中村康弘先生惠赠,IL-6标准品由美国Genetech公司提供,比活性为1×107 U/mg。(3)细胞因子依赖细胞株:CTLL-2细胞和L929细胞由中国医科大学微生物教研室惠赠;IL-6依赖细胞株B9.9细胞由浙江医科大学免疫学教研室惠赠。(4)免疫调节剂:黄芪注射液成都地奥九泓制药厂生产,以生理盐水配制成50 mg/ml。葡聚糖Meades博士惠赠,用生理盐水配成60 mg/ml。特异性iRNA制备参见文献[1]。(5)菌悬液制备:将从烧伤病人感染创面中分离获得的菌种(金葡菌、大肠杆菌和绿脓杆菌)分别接种于100 ml肉汤培养基中,37℃孵育16小时后去上清,用比浊法调整细菌浓度为1×109/ml,用于创面涂菌。(6)烫伤模型制备:实验前1天,鼠背一定面积用8%硫化钠脱毛,实验当天,在非麻醉状态下,将大鼠背部浸入100℃恒温沸水中12秒,致25%体表面积的Ⅲ度烫伤(经病理切片证实),伤后立即腹腔内注射生理盐水6 ml以抗休克。10分钟后创面涂上述3种细菌的混悬液,每只1 ml,然后分笼饲养,自由进食水。
, 百拇医药
2.动物分组:将96只烫伤大鼠随机分成4组,每组24只。(1)对照组,注射生理盐水1 ml;(2)iRNA组,注射特异性iRNA 1 ml(含1 mg,3种iRNA各取1/3量);(3)黄芪组,注射黄芪注射液1 ml(含50 mg,相当于每日给药剂量为250 mg/kg);(4)葡聚糖组,注射葡聚糖1 ml(含60 mg)。以上各组均自伤后当天(即6小时内)开始腹腔注射,每天1次,连用3天。(5)另设正常组10只,注射生理盐水1 ml,用法及用量同对照组。
表1 正常及烫伤大鼠脾细胞及腹腔Mφ产生细胞因子能力测定结果(
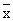 ±s) 组别
±s) 组别鼠数
IL-2(U/ml)
IL-6(U/ml)
, 百拇医药
TNF(U/ml)
TL-1(A570nm)
正常组
10
62±9
6.4±2.9
10±3
0.41±0.025
伤后1天
8
54±7*
12±4△
, 百拇医药
17±3△
0.54±0.03*
伤后5天
6
38±8△
16±4△
28±4△
0.69±0.03△
伤后10天
4
37±7△
, 百拇医药
22±5△
33±4△
0.7±0.03△
注:与正常组比较* P<0.05,△ P<0.01表2 不同免疫调节剂对烫伤大鼠脾细胞产生IL-2、IL-6能力的影响(U/ml,
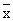 ±s) 组别
±s) 组别IL-2
IL-6
伤后1天
伤后5天
伤后10天
, http://www.100md.com
伤后1天
伤后5天
伤后10天
对照组
54±7(8)
38±8(6)
37±7(4)
12±4(8)
16±4(6)
22±5
iRNA组
54±7(8)
52±6△(8)
, 百拇医药
59±7△(7)
11±3(8)
12±3*(8)
10±3△(7)
黄芪组
53±6(8)
51±6△(8)
57±7△(6)
11±3(8)
14±4(8)
13±4*(6)
, 百拇医药
葡聚糖组
54±7(8)
48±7△(7)
52±7△(5)
11±3(8)
14±4(7)
14±4*(5)
注:括号内为鼠数,与对照组比* P<0.05,△ P<0.01 表3同 3.实验方法:(1)标本采集:每组动物分别于伤后第1、5、10天各取8只活杀,留取标本待测。
(2)脾细胞IL-2活性测定参照文献[2],结果以U/ml表示。脾细胞IL-6活性测定参见文献[3],与IL-6标准品比较后,确定其活性单位,结果以U/ml表示。腹腔MφTNF活性测定方法根据文献[4],结果以U/ml表示。腹腔Mφ产生IL-1活性测定采用小鼠胸腺细胞增殖法,结果以A570nm值表示。
, 百拇医药
二、结果
1.正常烫伤后大鼠脾细胞及腹腔Mφ产生细胞因子能力的测定(表1)
2.不同免疫调节剂对烫伤大鼠脾细胞产生IL-2、IL-6能力的影响:由表2
表3 不同免疫调节剂对烫伤大鼠腹腔Mφ产生TNF、IL-1活性的影响(
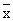 ±s) 组别
±s) 组别TNF
IL-1
伤后1天
伤后5天
伤后10天
, http://www.100md.com
伤后1天
伤后5天
伤后10天
对照组
17±3(8)
28±4(6)
33±4(4)
0.54±0.028(8)
0.69±0.031(6)
0.71±0.033(4)
iRNA组
17±4(8)
, http://www.100md.com
19±4△(8)
16±5△(7)
0.55±0.027(8)
0.56±0.029*(8)
0.51±0.030*(7)
黄芪组
17±4(8)
20±5△(8)
18±5△(6)
0.53±0.028(8)
, 百拇医药
0.58±0.031*(8)
0.54±0.32*(6)
葡聚糖组
17±4(8)
21±5*(7)
22±6*(5)
0.55±0.026(8)
0.63±0.033*(7)
0.58±0.034*(5)
可见,烫伤后大鼠脾细胞产生IL-2能力下降,在伤后第10天时降至正常的59.3%。应用免疫调节剂治疗后,各组IL-2活性明显提高,与未用药的对照组比较,差异有显著意义(P<0.01)。对照组IL-6则显著升高,而用药组升高不明显,尤为iRNA组最佳。
, 百拇医药
3.不同免疫调节剂对烫伤大鼠腹腔Mφ产生TNF、IL-1活性的影响:表3显示,免疫调节剂对烫伤大鼠腹腔Mφ产生TNF、IL-1活性有明显的调节作用。
三、讨论
本研究显示,烫伤后第1~10天大鼠脾细胞及腹腔Mφ产生细胞因子能力异常,表现IL-2产生减少,IL-1、IL-6和TNF产生增高,且伤后第10天比第1天更明显,证实烫伤后大鼠细胞因子产生能力严重受损。
本研究试以烧伤感染中最常见的3种致病菌为抗原,免疫动物,从致敏动物的肝脾中提取特异性iRNA,发现,伤后6小时内腹腔注射特异性iRNA可明显改善伤鼠的免疫功能,促进伤鼠淋巴细胞产生细胞因子能力恢复正常,且其疗效明显优于黄芪和葡聚糖。说明伤后早期应用特异性iRNA对纠正伤鼠免疫功能失常具有重要的作用。
本课题为全军“八五”青年基金资助项目
, 百拇医药
参考文献
1 卓安山,张德林,申繁星,等.特异性iRNA预防烧伤感染的临床和实验研究.吉林医学,1995,16:321-325.
2 Tada H, Shiho O, Kuroshima K, et al. An improved colourimetric assay for interleukin-2. J Immunol Methods, 1986, 93:157-160.
3 Muraguchi A, Hirano T, Tang B, et al. The essential role of B cell stimulatory factor 2 (BSF-2/IL-6) for the terminal differentiation of B cells. J Exp Med, 1988, 167:332-338.
4 Lora MG, Jeanne LR, Carl F, et al. Rapid colormetric assay for cell viability: application to the quantitation of cytotoxic and growth inhibition lymphokines. J Immunol Methods, 1984, 70:257-262.
(收稿:1997-11-24 修回:1998-08-18), 百拇医药