三种化合物对温石棉诱导人胚肺细胞芳香烃羟化酶活性的影响
作者:樊晶光 王起恩 刘世杰
单位:王起恩 刘世杰 (北京医科大学劳动卫生教研室 100083); 樊晶光 (劳动部劳动保护科学研究所工作 100029)
关键词:
卫生毒理学杂志990110 有研究表明,石棉和多环芳烃(PAHs)有协同致癌作用。其机制之一可能是石棉纤维使多环芳烃的排泄推迟,在体内停留时间延长,有利于与体内生物大分子作用[1]。另外,石棉还可能通过改变机体内依赖细胞色素P450的单氧化酶活性,影响多环芳烃的代谢,从而促进其致癌作用。本研究观察了温石棉对人胚肺(HEL)细胞芳香烃羟化酶(AHH)活性的诱导作用及3种化合物处理对温石棉诱导HEL细胞AHH活性的影响,现将结果报告如下。
材料与方法
1.细胞株:HEL细胞由军事医学科学院赵修南同志惠赠。用0.125%胰蛋白酶+0.01% EDTA消化传代,用含10%小牛血清和双抗的MEM培养液于37℃,5% CO2的条件下培养,3天传代一次。
, http://www.100md.com
2.石棉样品:选用青海茫崖产温石棉,用冰冻切片机切割成5~20μm(>10μm者占50%)的石棉纤维,置60℃烤箱中烘干备用。临用前将石棉加入磷酸盐缓冲液(PBS)或双蒸水中,超声10分,并用混悬器振荡2分,配成一定浓度均匀的混悬液。
3.其它化合物:混合稀土由中国农用稀土中心提供,为稀土硝酸盐,分子式为R(NO3)3.6H2O,稀土元素含量以氧化物计:La2O3占27%~28%,CeO2占50%,Nd2O3占15%~17%,Pr6O11占5%~6%,其他11种元素合计占约1%。柠檬酸铝由北京医科大学药厂生产,含铝量约9.3%。亚硒酸钠为北京市朝阳区中联化工试剂厂产品,分析纯,含亚硒酸钠不少于98.0%。
, 百拇医药
4.石棉纤维的预处理:
将一定量的温石棉悬液与不同浓度的混合稀土、柠檬酸铝(含Al3+ 9.3%)或亚硒酸钠溶液相混后,分别在室温下作用1小时,2000r/min离心10分,弃去上清液后,再用PBS将下部沉淀配成一定浓度均匀的混悬液。
5.AHH活性的测定[2]:
取指数生长期的HEL细胞,接种于150ml的培养瓶中,5×105个细胞/瓶,在37℃,5% CO2的孵育箱中培养48小时,弃上清,加入含不同量的温石棉或经浸泡过的温石棉的培养液,继续培养2小时,终止染毒,消化分离细胞,分别收集细胞于试管中后,用MEM调整至2ml。每管加入5μl苯并(a)芘溶液(5mg/ml丙酮),37℃水浴振荡孵育1小时,立即加入含10%丙酮的正己烷8ml,充分振荡混匀,取上层有机相4ml移入另一管中,加入1mol/L NaOH溶液3ml,充分振荡混匀,取下层水相,在激发波长396nm,发射波长522nm下测定荧光强度。
, http://www.100md.com
6.数据处理:
采用Primer软件中的t检验程序对数据进行统计分析。抑制率=(未处理石棉组所测值-处理后石棉组所测值)÷(未处理石棉组所测值-对照组所测值)。
结 果
1.不同剂量温石棉对HEL细胞AHH活性的诱导作用:
由表1可见,随着石棉剂量的增加,HEL细胞AHH活性逐渐升高,呈明显的剂量依赖性,表明石棉可诱导HEL细胞的AHH活性。
表1 温石棉对HEL细胞AHH活性的诱导作用(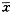 ±s,n=3) 石棉(μg/ml)
±s,n=3) 石棉(μg/ml)
AHH(荧光强度)
, 百拇医药
0
16.83±1.46
20
21.36±2.51
40
23.50±1.11**
80
24.00±2.69*
与对照组相比 *P<0.05,**P<0.01
2.3种化合物对石棉诱导HEL细胞AHH活性的影响:
由表2~4可见,经3种化合物预处理的石棉,其所诱导的HEL细胞AHH活性均明显低于未处理石棉组,并呈不同程度的剂量依赖性,其中在等量混合稀土处理组已完全恢复到对照水平,提示用3种化合物预处理石棉,可抑制石棉对HEL细胞AHH活性的诱导作用。
, 百拇医药
表2 柠檬酸铝对石棉诱导HEL细胞AHH活性的影响(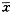 ±s,n=3) 石棉
±s,n=3) 石棉
(μg/ml)
柠檬酸铝
(μg/ml)
AHH
(荧光强度)
抑制率
(%)
80
0
24.00±2.69
, 百拇医药
-
80
20
18.80±1.25*
72.52
80
40
18.47±2.05*
77.13
80
80
17.87±1.21*
, 百拇医药
85.50
与未处理石棉组相比 *P<0.05
表3 混合稀土对石棉诱导HEL细胞AHH活性的影响(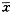 ±s,n=3) 石棉
±s,n=3) 石棉
(μg/ml)
混合稀土
(μg/ml)
AHH
(荧光强度)
抑制率
(%)
80
, 百拇医药
0
24.00±2.69
-
80
20
19.00±1.22*
69.74
80
40
17.93±2.10*
84.66
80
, 百拇医药
80
16.67±0.64*
102.23
与未处理石棉组相比 *P<0.05
表4 亚硒酸钠对石棉诱导HEL细胞AHH活性的影响(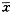 ±s,n=3) 石棉
±s,n=3) 石棉
(μg/ml)
亚硒酸钠
(μg/ml)
AHH
(荧光强度)
, 百拇医药
抑制率
(%)
80
0
24.00±2.69
-
80
20
19.60±1.73
61.37
80
40
18.73±1.42*
, 百拇医药
73.50
80
80
18.40±2.95*
78.10
与未处理石棉组相比 *P<0.05
讨 论
多数研究表明,肺癌患者肺中的AHH活性与肺癌危险度密切相关[3~5]。Kouri等[6]测定了51名各种肺病患者血淋巴细胞的AHH活性,结果发现,肺癌病人的AHH活性远高于其他肺病患者的AHH活性,其中活性最高的14名均属原发性肺癌患者,而且,AHH活性与病人的年龄、吸烟数量、癌症家族史、肿瘤的部位及组织类型均无关。Snodgrass等[7]检查了384名肺病患者后发现,在不同的病人中AHH活性的顺序为:既吸烟又接触石棉的肺癌患者>只吸烟不接触石棉的肺癌患者>既吸烟又接触石棉的非肺癌患者>既不吸烟又不接触石棉的非肺癌患者。这一结果提示,石棉可能诱导细胞AHH的活性。
, 百拇医药
本研究对培养的HEL细胞的AHH活性进行了测定,结果发现,用石棉悬液对HEL细胞染毒2小时后,随着石棉剂量的增加,HEL细胞的AHH活性逐渐升高,呈明显的剂量依赖性,表明石棉可诱导HEL细胞的AHH活性增高。
AHH属微粒体混合功能氧化酶系,是一种可诱导的、结合于膜的酶,它存在于动物和人的多种组织中,在化学致癌物的代谢过程中起着非常重要的作用。PAHs在AHH的催化下,可形成较为稳定的环氧化物,这些环氧化物的毒性往往远大于其母体化合物,还极易与生物大分子如DNA、RNA和蛋白质等进行共价结合,使遗传物质发生改变,从而导致癌瘤的发生。本研究结果表明,石棉可诱导HEL细胞的AHH活性增高,证实了石棉可能通过改变PAHs的代谢,而促进其致癌作用这一假说。
经3种化合物预处理的石棉,其所诱导的人胚肺细胞AHH活性均明显低于未处理石棉组,并呈不同程度的剂量依赖性,其中在混合稀土(1∶1)处理组已完全恢复到对照水平,提示用3种化合物预处理石棉,均可抑制石棉对人胚肺细胞AHH活性的诱导作用,从而可能减轻石棉对PAHs致癌的促进作用。
, 百拇医药
参考文献
1.Bevan DR,Ulman MR.Examination of factors that may influence disposition of benzo[a]pyrene in vivo:vehicles and asbestos.Cancer Lett,1991;57(2):173~179.
2.Nebert DW and Gelboin HV.Substrate-inducible microsomal aryl hydroxylase in mammalian cell culture.J Biol Chem,1968;243:6242~6261.
3.Alexandrow K,Rojas M,Geneste O,et al.An improved fluorometric assay for dosimetry of benzo(α)pyvene diol-epoxide-DNA adducts in smokers' lung:Comparison with total bulky adducts and aryl hydrocarbon hydroxylase activity.Cancer Res,1992;52:6248~6253.
, http://www.100md.com
4.Bartsch H,Petruzzeli S,De Flora S,et al.Carcinogen metabolism and DNA adducts in human lung tissues as affected by tobacco smoking or metabolic phenotype:study on lung cancer patients.Mutat Res,1991;250:103~114.
5.Geneste O,Camus AM,Castegnaro M,et al.Comparison of pulmonaryDNA adduct levels measured by32P-postlabelling and aryl hydrocarbon hydroxylase activity in lung parenchyma of smokers and ex-smokers.Carcinogenesis,1991;12:1301~1305.
, http://www.100md.com
6.Kouri RE,Mckinney CE,Slomiany DJ,et al.Positive correlation between high aryl hydrocarbon hydroxylase activity and primary lung cancer as analyzed in cryopreserved lymphocytes.Cancer Res,1982;42:5030~5037.
7.Snodgrass BS,Mc Lemore TL,Teague RB,et al.Aryl hydrocarbon hydroxylase activity in pulmonary macrophages and blood lymphocytes.Chest,1981;80(suppl):42s~44s.
(修回日期 1998年2月), 百拇医药
单位:王起恩 刘世杰 (北京医科大学劳动卫生教研室 100083); 樊晶光 (劳动部劳动保护科学研究所工作 100029)
关键词:
卫生毒理学杂志990110 有研究表明,石棉和多环芳烃(PAHs)有协同致癌作用。其机制之一可能是石棉纤维使多环芳烃的排泄推迟,在体内停留时间延长,有利于与体内生物大分子作用[1]。另外,石棉还可能通过改变机体内依赖细胞色素P450的单氧化酶活性,影响多环芳烃的代谢,从而促进其致癌作用。本研究观察了温石棉对人胚肺(HEL)细胞芳香烃羟化酶(AHH)活性的诱导作用及3种化合物处理对温石棉诱导HEL细胞AHH活性的影响,现将结果报告如下。
材料与方法
1.细胞株:HEL细胞由军事医学科学院赵修南同志惠赠。用0.125%胰蛋白酶+0.01% EDTA消化传代,用含10%小牛血清和双抗的MEM培养液于37℃,5% CO2的条件下培养,3天传代一次。
, http://www.100md.com
2.石棉样品:选用青海茫崖产温石棉,用冰冻切片机切割成5~20μm(>10μm者占50%)的石棉纤维,置60℃烤箱中烘干备用。临用前将石棉加入磷酸盐缓冲液(PBS)或双蒸水中,超声10分,并用混悬器振荡2分,配成一定浓度均匀的混悬液。
3.其它化合物:混合稀土由中国农用稀土中心提供,为稀土硝酸盐,分子式为R(NO3)3.6H2O,稀土元素含量以氧化物计:La2O3占27%~28%,CeO2占50%,Nd2O3占15%~17%,Pr6O11占5%~6%,其他11种元素合计占约1%。柠檬酸铝由北京医科大学药厂生产,含铝量约9.3%。亚硒酸钠为北京市朝阳区中联化工试剂厂产品,分析纯,含亚硒酸钠不少于98.0%。
, 百拇医药
4.石棉纤维的预处理:
将一定量的温石棉悬液与不同浓度的混合稀土、柠檬酸铝(含Al3+ 9.3%)或亚硒酸钠溶液相混后,分别在室温下作用1小时,2000r/min离心10分,弃去上清液后,再用PBS将下部沉淀配成一定浓度均匀的混悬液。
5.AHH活性的测定[2]:
取指数生长期的HEL细胞,接种于150ml的培养瓶中,5×105个细胞/瓶,在37℃,5% CO2的孵育箱中培养48小时,弃上清,加入含不同量的温石棉或经浸泡过的温石棉的培养液,继续培养2小时,终止染毒,消化分离细胞,分别收集细胞于试管中后,用MEM调整至2ml。每管加入5μl苯并(a)芘溶液(5mg/ml丙酮),37℃水浴振荡孵育1小时,立即加入含10%丙酮的正己烷8ml,充分振荡混匀,取上层有机相4ml移入另一管中,加入1mol/L NaOH溶液3ml,充分振荡混匀,取下层水相,在激发波长396nm,发射波长522nm下测定荧光强度。
, http://www.100md.com
6.数据处理:
采用Primer软件中的t检验程序对数据进行统计分析。抑制率=(未处理石棉组所测值-处理后石棉组所测值)÷(未处理石棉组所测值-对照组所测值)。
结 果
1.不同剂量温石棉对HEL细胞AHH活性的诱导作用:
由表1可见,随着石棉剂量的增加,HEL细胞AHH活性逐渐升高,呈明显的剂量依赖性,表明石棉可诱导HEL细胞的AHH活性。
表1 温石棉对HEL细胞AHH活性的诱导作用(
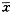 ±s,n=3) 石棉(μg/ml)
±s,n=3) 石棉(μg/ml)AHH(荧光强度)
, 百拇医药
0
16.83±1.46
20
21.36±2.51
40
23.50±1.11**
80
24.00±2.69*
与对照组相比 *P<0.05,**P<0.01
2.3种化合物对石棉诱导HEL细胞AHH活性的影响:
由表2~4可见,经3种化合物预处理的石棉,其所诱导的HEL细胞AHH活性均明显低于未处理石棉组,并呈不同程度的剂量依赖性,其中在等量混合稀土处理组已完全恢复到对照水平,提示用3种化合物预处理石棉,可抑制石棉对HEL细胞AHH活性的诱导作用。
, 百拇医药
表2 柠檬酸铝对石棉诱导HEL细胞AHH活性的影响(
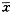 ±s,n=3) 石棉
±s,n=3) 石棉(μg/ml)
柠檬酸铝
(μg/ml)
AHH
(荧光强度)
抑制率
(%)
80
0
24.00±2.69
, 百拇医药
-
80
20
18.80±1.25*
72.52
80
40
18.47±2.05*
77.13
80
80
17.87±1.21*
, 百拇医药
85.50
与未处理石棉组相比 *P<0.05
表3 混合稀土对石棉诱导HEL细胞AHH活性的影响(
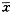 ±s,n=3) 石棉
±s,n=3) 石棉(μg/ml)
混合稀土
(μg/ml)
AHH
(荧光强度)
抑制率
(%)
80
, 百拇医药
0
24.00±2.69
-
80
20
19.00±1.22*
69.74
80
40
17.93±2.10*
84.66
80
, 百拇医药
80
16.67±0.64*
102.23
与未处理石棉组相比 *P<0.05
表4 亚硒酸钠对石棉诱导HEL细胞AHH活性的影响(
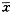 ±s,n=3) 石棉
±s,n=3) 石棉(μg/ml)
亚硒酸钠
(μg/ml)
AHH
(荧光强度)
, 百拇医药
抑制率
(%)
80
0
24.00±2.69
-
80
20
19.60±1.73
61.37
80
40
18.73±1.42*
, 百拇医药
73.50
80
80
18.40±2.95*
78.10
与未处理石棉组相比 *P<0.05
讨 论
多数研究表明,肺癌患者肺中的AHH活性与肺癌危险度密切相关[3~5]。Kouri等[6]测定了51名各种肺病患者血淋巴细胞的AHH活性,结果发现,肺癌病人的AHH活性远高于其他肺病患者的AHH活性,其中活性最高的14名均属原发性肺癌患者,而且,AHH活性与病人的年龄、吸烟数量、癌症家族史、肿瘤的部位及组织类型均无关。Snodgrass等[7]检查了384名肺病患者后发现,在不同的病人中AHH活性的顺序为:既吸烟又接触石棉的肺癌患者>只吸烟不接触石棉的肺癌患者>既吸烟又接触石棉的非肺癌患者>既不吸烟又不接触石棉的非肺癌患者。这一结果提示,石棉可能诱导细胞AHH的活性。
, 百拇医药
本研究对培养的HEL细胞的AHH活性进行了测定,结果发现,用石棉悬液对HEL细胞染毒2小时后,随着石棉剂量的增加,HEL细胞的AHH活性逐渐升高,呈明显的剂量依赖性,表明石棉可诱导HEL细胞的AHH活性增高。
AHH属微粒体混合功能氧化酶系,是一种可诱导的、结合于膜的酶,它存在于动物和人的多种组织中,在化学致癌物的代谢过程中起着非常重要的作用。PAHs在AHH的催化下,可形成较为稳定的环氧化物,这些环氧化物的毒性往往远大于其母体化合物,还极易与生物大分子如DNA、RNA和蛋白质等进行共价结合,使遗传物质发生改变,从而导致癌瘤的发生。本研究结果表明,石棉可诱导HEL细胞的AHH活性增高,证实了石棉可能通过改变PAHs的代谢,而促进其致癌作用这一假说。
经3种化合物预处理的石棉,其所诱导的人胚肺细胞AHH活性均明显低于未处理石棉组,并呈不同程度的剂量依赖性,其中在混合稀土(1∶1)处理组已完全恢复到对照水平,提示用3种化合物预处理石棉,均可抑制石棉对人胚肺细胞AHH活性的诱导作用,从而可能减轻石棉对PAHs致癌的促进作用。
, 百拇医药
参考文献
1.Bevan DR,Ulman MR.Examination of factors that may influence disposition of benzo[a]pyrene in vivo:vehicles and asbestos.Cancer Lett,1991;57(2):173~179.
2.Nebert DW and Gelboin HV.Substrate-inducible microsomal aryl hydroxylase in mammalian cell culture.J Biol Chem,1968;243:6242~6261.
3.Alexandrow K,Rojas M,Geneste O,et al.An improved fluorometric assay for dosimetry of benzo(α)pyvene diol-epoxide-DNA adducts in smokers' lung:Comparison with total bulky adducts and aryl hydrocarbon hydroxylase activity.Cancer Res,1992;52:6248~6253.
, http://www.100md.com
4.Bartsch H,Petruzzeli S,De Flora S,et al.Carcinogen metabolism and DNA adducts in human lung tissues as affected by tobacco smoking or metabolic phenotype:study on lung cancer patients.Mutat Res,1991;250:103~114.
5.Geneste O,Camus AM,Castegnaro M,et al.Comparison of pulmonaryDNA adduct levels measured by32P-postlabelling and aryl hydrocarbon hydroxylase activity in lung parenchyma of smokers and ex-smokers.Carcinogenesis,1991;12:1301~1305.
, http://www.100md.com
6.Kouri RE,Mckinney CE,Slomiany DJ,et al.Positive correlation between high aryl hydrocarbon hydroxylase activity and primary lung cancer as analyzed in cryopreserved lymphocytes.Cancer Res,1982;42:5030~5037.
7.Snodgrass BS,Mc Lemore TL,Teague RB,et al.Aryl hydrocarbon hydroxylase activity in pulmonary macrophages and blood lymphocytes.Chest,1981;80(suppl):42s~44s.
(修回日期 1998年2月), 百拇医药