T、B细胞表型抗体免疫组化敏感性与特异性分析
作者:陈林莺 张声 王小亚
单位:陈林莺 张声(福建医科大学附属第一医院病理科,福州 350005);王小亚(福州迈新生物技术开发公司,福州 350002)
关键词:淋巴瘤;B细胞;淋巴瘤;T细胞;免疫表型分型;免疫组织化学
临床与实验病理学杂志990105摘要 目的:探讨T、B细胞非霍奇金淋巴瘤免疫表型染色的特异性和交叉反应性。方法:应用S-P免疫组织化学方法对62例非霍奇金淋巴瘤进行CD20、CD74、CD45RO、CD43和CD3免疫表型测定。结果:发现B细胞表型抗体CD20和CD74对B细胞非霍奇金淋巴瘤染色阳性率达88.2%~100%,但CD74的特异性不强,与T细胞有26.7%(4/15)~35.7%(5/14)的交叉反应,而CD20表现出高度的特异性,交叉反应为0。T细胞表型抗体CD45RO、CD43和CD3对T细胞非霍奇金淋巴瘤染色阳性率达85.7%~100%,但CD45RO和CD43对B细胞的交叉反应高达40%(6/15)~47.1%(8/17),特异性不强,而多克隆抗体CD3与B细胞仅有5.9%(1/17)的交叉反应,表现出明显的特异性。结论:提示在进行T、B细胞免疫表型划分时,应使用一组包括CD20、CD74,CD45RO、CD43和CD3等抗体,CD3是一种具有高度敏感性和高度特异性的T细胞标志抗体,值得推荐。
, 百拇医药
中国图书分类号 R733.4; R392 文献标识码 A 文章编号 1001-7399(1999)01-0015-03
Specifity and reactivity of antibodies of B-cell and T-cell immunophenotype
1Chen Linying, 1Zhang Sheng, 2Wang Xiaoya
(1Dept of Pathol, First Affiliated Hospital of Fujian Medical University, Fuzhou 350005; 2Fuzhou Maxim Biotech Inc, Fuzhou 350002)
, 百拇医药 ABSTRACT Purpose To investigate the specificity and reactivity of antibodies of B-cell and T-cell of NHL. Methods Sixty-two cases of NHL were examined for CD20、CD74、CD45RO、CD43 and CD3 using S-P immunohistochemical methods. Results The positivity rates of CD20 and CD74 in B-cell NHL were 88.2%~100%, and the reactivity of CD74 with 26.7%~35.7% of T-cell NHL suggested that it may lack specifity; However, CD20 as high specificity as its cross-reactivity was zero. The staining rates of CD45RO,CD43 and CD3 with T-cell were 85.7%~100%. The cross-reactivity of CD45RO and CD43 with B-cell was 40%~47.1% and their specificities were lack, but the polyclonal CD3 only reacted with 5.9%(1/17) B-cell NHL and had very high specificity. Conclusion For determination of B-cell and T-cell immunophenotyping a panel of antibodies comprising CD20、CD74,CD45RO,CD43 and CD3 is recommended. CD3 is a antibody of T-cell marker with high sensitivity and specificity.
, http://www.100md.com
KEY WORDS lymphoma, B-cell; T-cell; lymphoma; immunophenotyping; immunohistochemistry
非霍奇金淋巴瘤的分类方法很多,通常以Lukes-Collins免疫功能分类为基础,也即以现代免疫学观念和新技术用于淋巴瘤的研究,产生以形态学与功能相结合的免疫功能分类,即将非霍奇金淋巴瘤分为B细胞、T细胞和组织细胞三大类的不同亚型。精确的表型划分对于恶性淋巴瘤的正确分类是非常重要的。通常是用一组可用于石蜡切片的抗体对淋巴瘤进行免疫分型,这包括许多种能识别B或T细胞抗原的试剂,包括CD20、CD74、CD43、CD45RO和CD3等抗体。然而其中有些为大家所常用的淋巴瘤分类抗体,在进行免疫组化染色时表现很强的交叉反应性,这种现象很大程度上困扰着我们对淋巴瘤的分类。本文应用一组B、T细胞淋巴瘤,对这些试剂免疫组化染色的敏感性和特异性进行分析。
, http://www.100md.com
1 材料和方法
1.1 组织标本 收集福建医科大学附属第一医院1994~1998年常规活检标本62例,常规福尔马林固定,24 h内取材,4 μm厚连续切片,经病理诊断为淋巴瘤,参照修正后的Kiel分类方法〔1〕。
1.2 试剂 CD20(L26),CD74(LN2),CD3(多克隆),CD45RO(UCHL1),CD43(MT-1)抗体及S-P(广谱)试剂盒均购自美国Maxim Biotech公司(由福州迈新公司提供),操作按说明书进行。
1.3 微波抗原修复 组织切片常规脱蜡至水化,用微波炉(National家用微波炉)行抗原修复。先用中档4~6 min对柠檬酸缓冲液进行升温,待见到轻度沸腾后即用中低档保温10 min(可见到微小气泡);一抗孵育2 h(室温25℃左右),常规DAB-H2O2显色8 min,苏木素复染。
, 百拇医药
2 结果
本组62例非霍奇金淋巴瘤患者,年龄19~77岁,平均46.4岁,其中男性37例,女性25例。按修正后的Kiel分类法,B细胞非霍奇金淋巴瘤33例,其中低度恶性17例,高度恶性16例;T细胞非霍奇金淋巴瘤29例,其中低度恶性14例,高度恶性15例。
总体观察微波抗原修复染色结果,在所有病例中免疫组化阳性染色为带有微弱的浆染色、细胞膜染色,组织结构清晰,未见明显背景染色。
62例非霍奇金淋巴瘤行免疫组化染色结果(图1~8)。
图1 低度恶性B细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400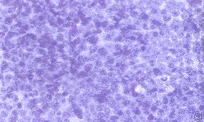
, http://www.100md.com
图2 低度恶性B细胞非霍奇金恶性淋巴瘤CD3染色阴怀。S-P×400
图3 高度恶性B细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400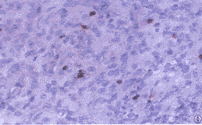
图4 高度恶性B细胞非霍奇金恶性淋巴瘤CD3染色阳性。S-P×400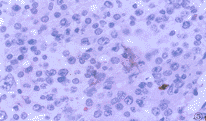
图5 低度恶性T细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400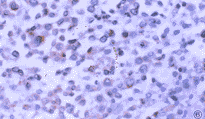
, http://www.100md.com
图6 低度恶性T细胞非霍奇金恶性淋巴瘤CD3染色阳性。S-P×400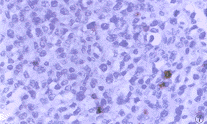
图7 高度恶性T细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400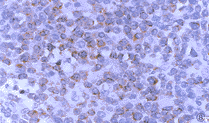
图8 高度恶性T细胞非霍奇金恶性淋巴瘤CD3染色阳性。S-P×400
2.1 B细胞非霍奇金淋巴瘤 17例低度恶性的B细胞非霍奇金淋巴瘤中,B细胞表型标志的CD20和CD74染色阳性率分别达94.1%(16/17),88.2%(15/17);而作为T细胞表型标志的CD45RO,CD3和CD43对B细胞的染色交叉率分别为44.2%(7/17),5.9%(1/17),47.1%(8/17)。
, http://www.100md.com
16例高度恶性的B细胞非霍奇金淋巴瘤中,CD20和CD74染色阳性率分别达100%;而CD45RO、CD3和CD43对B细胞的染色交叉率分别为43.7%(7/16),0(0/15),40.0%(6/15)。
2.2 T细胞非霍奇金淋巴瘤 14例低度恶性的T细胞非霍奇金淋巴瘤中,作为T细胞表型标志的CD45RO、CD3和CD43阳性染色率分别为85.7%(12/14),100%(14/14),100%(14/14);而作为B细胞表型标志的CD20和CD74对T细胞的染色交叉率为0(0/14)和35.7%(5/14)。
15例高度恶性的T细胞非霍奇金淋巴瘤中,CD45RO;CD3和CD43 阳性染色率分别为100%(15/15),86.7%(13/15),93.3%(14/15);而CD20和CD74对T细胞染色交叉率为0(0/15)和26.7%(4/15)。
, 百拇医药
在对B细胞非霍奇金淋巴瘤染色中,CD20和CD74的染色阳性率可达88.2%~100%,T细胞标志的CD45RO和CD43 对B细胞的染色交叉率高达40%~47.1%;仅对CD3在17例低度恶性的B细胞非霍奇金淋巴瘤中的1例阳性染色,在高度恶性的B细胞非霍奇金淋巴瘤中CD3未见染色交叉性。
在对T细胞非霍奇金淋巴瘤的染色中,CD45RO、CD3和CD43 的染色阳性率可达85.7%~100%;B细胞标志的CD20对T细胞的染色交叉率为0,但CD74对T细胞的染色交叉率达26.7%~35.7%。
3 讨论
本研究结果发现,对于B细胞免疫表型染色的CD20和CD74是两种敏感性很强的标志物,同时CD20具有高度的特异性,CD20对T细胞非霍奇金淋巴瘤的染色交叉率为0。但CD74对淋巴瘤的免疫表型特异性不强,与低度恶性(5/44)和高度恶性(4/15)的T细胞淋巴瘤有染色交叉性。
, http://www.100md.com
同样对于T细胞免疫表型的染色来说,CD45RO、CD3和CD43具有高度的敏感性,染色率达到85.7%~100%;但为大家所常用的CD45RO和CD43在对B细胞淋巴瘤进行免疫分型时其染色的交叉性高达40%~47.1%,特异性不强;相反多克隆的CD3却表现出明显的特异性,仅1例滤泡中心性淋巴瘤有较弱的膜染色。
许多研究〔2,3〕表明,任何单独一种的淋巴细胞标志物均不可能在所有的淋巴瘤病例中都呈现出100%的阳性染色,我们的结果与此相似,CD20和CD74对B细胞染色率为88.2%~100%,CD45RO、CD3和CD43对T细胞的染色率为85.7%~100%。Kreft等〔4〕发现CD20与10例T细胞非霍奇淋巴瘤中的2例存在交叉反应,我们未发现这一现象。Dobson等〔5〕也发现作为T细胞标志的CD43与B细胞非霍奇金淋巴瘤有42.4%(14/33)的免疫染色交叉反应,我们的结果与此相似。我们发现CD74对T细胞的染色交叉率达16.7%~35.7%,CD45RO和CD43对B细胞的交叉染色率达40%~47.1%,而CD3仅5.9%(1/17)。这就表明在进行淋巴瘤细胞免疫表型划分时需要使用一组标志物进行染色,即当疑为B细胞淋巴瘤时应采用B细胞表型抗体CD20、CD74加上T细胞表型抗体CD3和(或)CD45RO或CD43等;而疑为T细胞淋巴瘤时,应用T细胞表型抗体CD45RO、CD3、CD43加上B细胞表型抗体CD20和(或)CD74等抗体。
, 百拇医药
对于T细胞的表型染色,CD3多克隆抗体近来已被认识为具有高度敏感性和特异性,是一种可靠的T细胞表型染色的核心成员。CD3复合物由多种亚单位组成〔6〕,当与抗原接触时作为T细胞受体(TCR)复合物的信号传导单位,我们所经常使用的抗-CD3多克隆抗体是直接作用于CD3复合物的ε亚单位上。ε亚单位是一种非糖基肽,既往认为抗体为多克隆性抗体存在某些缺点,例如存在批间差异(此通过操作者的质控而减到最小),有相对较深的背景染色(应用微波抗原修复可减轻此抗体的背景染色)以及操作上的不方便。即需要使用不同的二抗(此已为广谱二抗的应用而消除)。
对于T细胞淋巴瘤的诊断,通常有多种抗体可供使用,如CD45RO、CD3和CD43等。但为大家所广泛使用的抗体CD45RO和CD43对B细胞、粒细胞、巨核细胞和组织细胞具有明显的染色交叉性,因此不具有细胞谱系的特异性。Chetty和Gatter〔7〕综述了10位作者的研究,与其他的T细胞标志抗体相比较,CD3(多克隆)免疫组化染色率在51%~100%之间;我们结果与他们相似,同时对B细胞非霍奇金淋巴瘤的染色交叉率仅为5.9%,因此,CD3具有T细胞谱系免疫染色的特异性。他们建议使用一组标志抗体包括CD3和CD45RO(UCHL1),作为非霍奇金淋巴瘤常规的免疫组化染色抗体。
, 百拇医药
总之,在进行非霍奇金淋巴瘤免疫表型划分时,建议使用一组抗体,包括CD20、CD74、CD3、CD43、CD45RO等;同时本实验表明CD3是一种具有高度敏感性和高度特异性的T细胞标志抗体,值得推荐使用。
作者简介:张 声,男,35岁,硕士,副主任医师。研究方向:胃癌的浸润与转移
参考文献
1,Stansfeld AG, Diebold J, Noel H et al. Updates Kiel classification for lymphomas. Lancet, 1988;1:292~293
2,Cabecadas JM, Isaacson PG. Phenotyping of T-cell lymphomas in paraffin sections-which antibodies? Histopathology, 1991;19:419~424
, http://www.100md.com
3,Muzaffar S, Pervez S, Aijaz F et al. Immunophenotypic analysis of non-Hodgkins lymphoma. J Pak Med Assoc, 1997;47(4):106~109
4,Kreft A, Busche G, Bernhards J et al. Immunophenotype of hairy-cell leukaemia after cold polymerization of methyl-methacrylate embeddings from 50 diagnostic bone marrow biopsies. Histopathology, 1997;30(2):145~151
5,Dobson CM, Myskow MW, Krajewski AS et al. Immunohistochemical staining of non-Hodgkins lymphoma in paraffin sections using the MB1 and MT1 mononclonal antibodies. J Pathol, 1987;153:203~212
, 百拇医药
6,Gold DP, Puck JM, Petty CL et al. Structure of the T-cell antigen receptor: Evidence for two CD3E subunits in the T-cell receptor CD3 complex. Proc Natl Acad Sci, 1990;87:7220~7224
7,Chetty R, Gatter K. CD3: structure, function and role of immunostaining in clinical practice. J Pathol, 1994;173:303~307
(图片见插页第4页)
收稿日期:1998-08-07, 百拇医药
单位:陈林莺 张声(福建医科大学附属第一医院病理科,福州 350005);王小亚(福州迈新生物技术开发公司,福州 350002)
关键词:淋巴瘤;B细胞;淋巴瘤;T细胞;免疫表型分型;免疫组织化学
临床与实验病理学杂志990105摘要 目的:探讨T、B细胞非霍奇金淋巴瘤免疫表型染色的特异性和交叉反应性。方法:应用S-P免疫组织化学方法对62例非霍奇金淋巴瘤进行CD20、CD74、CD45RO、CD43和CD3免疫表型测定。结果:发现B细胞表型抗体CD20和CD74对B细胞非霍奇金淋巴瘤染色阳性率达88.2%~100%,但CD74的特异性不强,与T细胞有26.7%(4/15)~35.7%(5/14)的交叉反应,而CD20表现出高度的特异性,交叉反应为0。T细胞表型抗体CD45RO、CD43和CD3对T细胞非霍奇金淋巴瘤染色阳性率达85.7%~100%,但CD45RO和CD43对B细胞的交叉反应高达40%(6/15)~47.1%(8/17),特异性不强,而多克隆抗体CD3与B细胞仅有5.9%(1/17)的交叉反应,表现出明显的特异性。结论:提示在进行T、B细胞免疫表型划分时,应使用一组包括CD20、CD74,CD45RO、CD43和CD3等抗体,CD3是一种具有高度敏感性和高度特异性的T细胞标志抗体,值得推荐。
, 百拇医药
中国图书分类号 R733.4; R392 文献标识码 A 文章编号 1001-7399(1999)01-0015-03
Specifity and reactivity of antibodies of B-cell and T-cell immunophenotype
1Chen Linying, 1Zhang Sheng, 2Wang Xiaoya
(1Dept of Pathol, First Affiliated Hospital of Fujian Medical University, Fuzhou 350005; 2Fuzhou Maxim Biotech Inc, Fuzhou 350002)
, 百拇医药 ABSTRACT Purpose To investigate the specificity and reactivity of antibodies of B-cell and T-cell of NHL. Methods Sixty-two cases of NHL were examined for CD20、CD74、CD45RO、CD43 and CD3 using S-P immunohistochemical methods. Results The positivity rates of CD20 and CD74 in B-cell NHL were 88.2%~100%, and the reactivity of CD74 with 26.7%~35.7% of T-cell NHL suggested that it may lack specifity; However, CD20 as high specificity as its cross-reactivity was zero. The staining rates of CD45RO,CD43 and CD3 with T-cell were 85.7%~100%. The cross-reactivity of CD45RO and CD43 with B-cell was 40%~47.1% and their specificities were lack, but the polyclonal CD3 only reacted with 5.9%(1/17) B-cell NHL and had very high specificity. Conclusion For determination of B-cell and T-cell immunophenotyping a panel of antibodies comprising CD20、CD74,CD45RO,CD43 and CD3 is recommended. CD3 is a antibody of T-cell marker with high sensitivity and specificity.
, http://www.100md.com
KEY WORDS lymphoma, B-cell; T-cell; lymphoma; immunophenotyping; immunohistochemistry
非霍奇金淋巴瘤的分类方法很多,通常以Lukes-Collins免疫功能分类为基础,也即以现代免疫学观念和新技术用于淋巴瘤的研究,产生以形态学与功能相结合的免疫功能分类,即将非霍奇金淋巴瘤分为B细胞、T细胞和组织细胞三大类的不同亚型。精确的表型划分对于恶性淋巴瘤的正确分类是非常重要的。通常是用一组可用于石蜡切片的抗体对淋巴瘤进行免疫分型,这包括许多种能识别B或T细胞抗原的试剂,包括CD20、CD74、CD43、CD45RO和CD3等抗体。然而其中有些为大家所常用的淋巴瘤分类抗体,在进行免疫组化染色时表现很强的交叉反应性,这种现象很大程度上困扰着我们对淋巴瘤的分类。本文应用一组B、T细胞淋巴瘤,对这些试剂免疫组化染色的敏感性和特异性进行分析。
, http://www.100md.com
1 材料和方法
1.1 组织标本 收集福建医科大学附属第一医院1994~1998年常规活检标本62例,常规福尔马林固定,24 h内取材,4 μm厚连续切片,经病理诊断为淋巴瘤,参照修正后的Kiel分类方法〔1〕。
1.2 试剂 CD20(L26),CD74(LN2),CD3(多克隆),CD45RO(UCHL1),CD43(MT-1)抗体及S-P(广谱)试剂盒均购自美国Maxim Biotech公司(由福州迈新公司提供),操作按说明书进行。
1.3 微波抗原修复 组织切片常规脱蜡至水化,用微波炉(National家用微波炉)行抗原修复。先用中档4~6 min对柠檬酸缓冲液进行升温,待见到轻度沸腾后即用中低档保温10 min(可见到微小气泡);一抗孵育2 h(室温25℃左右),常规DAB-H2O2显色8 min,苏木素复染。
, 百拇医药
2 结果
本组62例非霍奇金淋巴瘤患者,年龄19~77岁,平均46.4岁,其中男性37例,女性25例。按修正后的Kiel分类法,B细胞非霍奇金淋巴瘤33例,其中低度恶性17例,高度恶性16例;T细胞非霍奇金淋巴瘤29例,其中低度恶性14例,高度恶性15例。
总体观察微波抗原修复染色结果,在所有病例中免疫组化阳性染色为带有微弱的浆染色、细胞膜染色,组织结构清晰,未见明显背景染色。
62例非霍奇金淋巴瘤行免疫组化染色结果(图1~8)。

图1 低度恶性B细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400

, http://www.100md.com
图2 低度恶性B细胞非霍奇金恶性淋巴瘤CD3染色阴怀。S-P×400

图3 高度恶性B细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400

图4 高度恶性B细胞非霍奇金恶性淋巴瘤CD3染色阳性。S-P×400

图5 低度恶性T细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400

, http://www.100md.com
图6 低度恶性T细胞非霍奇金恶性淋巴瘤CD3染色阳性。S-P×400

图7 高度恶性T细胞非霍奇金恶性淋巴瘤CD20染色阳性。S-P×400

图8 高度恶性T细胞非霍奇金恶性淋巴瘤CD3染色阳性。S-P×400
2.1 B细胞非霍奇金淋巴瘤 17例低度恶性的B细胞非霍奇金淋巴瘤中,B细胞表型标志的CD20和CD74染色阳性率分别达94.1%(16/17),88.2%(15/17);而作为T细胞表型标志的CD45RO,CD3和CD43对B细胞的染色交叉率分别为44.2%(7/17),5.9%(1/17),47.1%(8/17)。
, http://www.100md.com
16例高度恶性的B细胞非霍奇金淋巴瘤中,CD20和CD74染色阳性率分别达100%;而CD45RO、CD3和CD43对B细胞的染色交叉率分别为43.7%(7/16),0(0/15),40.0%(6/15)。
2.2 T细胞非霍奇金淋巴瘤 14例低度恶性的T细胞非霍奇金淋巴瘤中,作为T细胞表型标志的CD45RO、CD3和CD43阳性染色率分别为85.7%(12/14),100%(14/14),100%(14/14);而作为B细胞表型标志的CD20和CD74对T细胞的染色交叉率为0(0/14)和35.7%(5/14)。
15例高度恶性的T细胞非霍奇金淋巴瘤中,CD45RO;CD3和CD43 阳性染色率分别为100%(15/15),86.7%(13/15),93.3%(14/15);而CD20和CD74对T细胞染色交叉率为0(0/15)和26.7%(4/15)。
, 百拇医药
在对B细胞非霍奇金淋巴瘤染色中,CD20和CD74的染色阳性率可达88.2%~100%,T细胞标志的CD45RO和CD43 对B细胞的染色交叉率高达40%~47.1%;仅对CD3在17例低度恶性的B细胞非霍奇金淋巴瘤中的1例阳性染色,在高度恶性的B细胞非霍奇金淋巴瘤中CD3未见染色交叉性。
在对T细胞非霍奇金淋巴瘤的染色中,CD45RO、CD3和CD43 的染色阳性率可达85.7%~100%;B细胞标志的CD20对T细胞的染色交叉率为0,但CD74对T细胞的染色交叉率达26.7%~35.7%。
3 讨论
本研究结果发现,对于B细胞免疫表型染色的CD20和CD74是两种敏感性很强的标志物,同时CD20具有高度的特异性,CD20对T细胞非霍奇金淋巴瘤的染色交叉率为0。但CD74对淋巴瘤的免疫表型特异性不强,与低度恶性(5/44)和高度恶性(4/15)的T细胞淋巴瘤有染色交叉性。
, http://www.100md.com
同样对于T细胞免疫表型的染色来说,CD45RO、CD3和CD43具有高度的敏感性,染色率达到85.7%~100%;但为大家所常用的CD45RO和CD43在对B细胞淋巴瘤进行免疫分型时其染色的交叉性高达40%~47.1%,特异性不强;相反多克隆的CD3却表现出明显的特异性,仅1例滤泡中心性淋巴瘤有较弱的膜染色。
许多研究〔2,3〕表明,任何单独一种的淋巴细胞标志物均不可能在所有的淋巴瘤病例中都呈现出100%的阳性染色,我们的结果与此相似,CD20和CD74对B细胞染色率为88.2%~100%,CD45RO、CD3和CD43对T细胞的染色率为85.7%~100%。Kreft等〔4〕发现CD20与10例T细胞非霍奇淋巴瘤中的2例存在交叉反应,我们未发现这一现象。Dobson等〔5〕也发现作为T细胞标志的CD43与B细胞非霍奇金淋巴瘤有42.4%(14/33)的免疫染色交叉反应,我们的结果与此相似。我们发现CD74对T细胞的染色交叉率达16.7%~35.7%,CD45RO和CD43对B细胞的交叉染色率达40%~47.1%,而CD3仅5.9%(1/17)。这就表明在进行淋巴瘤细胞免疫表型划分时需要使用一组标志物进行染色,即当疑为B细胞淋巴瘤时应采用B细胞表型抗体CD20、CD74加上T细胞表型抗体CD3和(或)CD45RO或CD43等;而疑为T细胞淋巴瘤时,应用T细胞表型抗体CD45RO、CD3、CD43加上B细胞表型抗体CD20和(或)CD74等抗体。
, 百拇医药
对于T细胞的表型染色,CD3多克隆抗体近来已被认识为具有高度敏感性和特异性,是一种可靠的T细胞表型染色的核心成员。CD3复合物由多种亚单位组成〔6〕,当与抗原接触时作为T细胞受体(TCR)复合物的信号传导单位,我们所经常使用的抗-CD3多克隆抗体是直接作用于CD3复合物的ε亚单位上。ε亚单位是一种非糖基肽,既往认为抗体为多克隆性抗体存在某些缺点,例如存在批间差异(此通过操作者的质控而减到最小),有相对较深的背景染色(应用微波抗原修复可减轻此抗体的背景染色)以及操作上的不方便。即需要使用不同的二抗(此已为广谱二抗的应用而消除)。
对于T细胞淋巴瘤的诊断,通常有多种抗体可供使用,如CD45RO、CD3和CD43等。但为大家所广泛使用的抗体CD45RO和CD43对B细胞、粒细胞、巨核细胞和组织细胞具有明显的染色交叉性,因此不具有细胞谱系的特异性。Chetty和Gatter〔7〕综述了10位作者的研究,与其他的T细胞标志抗体相比较,CD3(多克隆)免疫组化染色率在51%~100%之间;我们结果与他们相似,同时对B细胞非霍奇金淋巴瘤的染色交叉率仅为5.9%,因此,CD3具有T细胞谱系免疫染色的特异性。他们建议使用一组标志抗体包括CD3和CD45RO(UCHL1),作为非霍奇金淋巴瘤常规的免疫组化染色抗体。
, 百拇医药
总之,在进行非霍奇金淋巴瘤免疫表型划分时,建议使用一组抗体,包括CD20、CD74、CD3、CD43、CD45RO等;同时本实验表明CD3是一种具有高度敏感性和高度特异性的T细胞标志抗体,值得推荐使用。
作者简介:张 声,男,35岁,硕士,副主任医师。研究方向:胃癌的浸润与转移
参考文献
1,Stansfeld AG, Diebold J, Noel H et al. Updates Kiel classification for lymphomas. Lancet, 1988;1:292~293
2,Cabecadas JM, Isaacson PG. Phenotyping of T-cell lymphomas in paraffin sections-which antibodies? Histopathology, 1991;19:419~424
, http://www.100md.com
3,Muzaffar S, Pervez S, Aijaz F et al. Immunophenotypic analysis of non-Hodgkins lymphoma. J Pak Med Assoc, 1997;47(4):106~109
4,Kreft A, Busche G, Bernhards J et al. Immunophenotype of hairy-cell leukaemia after cold polymerization of methyl-methacrylate embeddings from 50 diagnostic bone marrow biopsies. Histopathology, 1997;30(2):145~151
5,Dobson CM, Myskow MW, Krajewski AS et al. Immunohistochemical staining of non-Hodgkins lymphoma in paraffin sections using the MB1 and MT1 mononclonal antibodies. J Pathol, 1987;153:203~212
, 百拇医药
6,Gold DP, Puck JM, Petty CL et al. Structure of the T-cell antigen receptor: Evidence for two CD3E subunits in the T-cell receptor CD3 complex. Proc Natl Acad Sci, 1990;87:7220~7224
7,Chetty R, Gatter K. CD3: structure, function and role of immunostaining in clinical practice. J Pathol, 1994;173:303~307
(图片见插页第4页)
收稿日期:1998-08-07, 百拇医药