内皮素-1(ET-1)在口腔粘膜下纤维性变中的表达水平
作者:许春姣 彭解英 刘蜀凡 方厂云
单位:许春姣 彭解英 刘蜀凡 方厂云 410078长沙,湖南医科大学附属湘雅医院
关键词:内皮素-1;口腔粘膜下纤维性变;形态计量学
临床口腔医学杂志990117 提 要 为探讨ET-1与口腔粘膜下纤维性变(OSF)的关系,应用免疫组化染色和图像分析技术,检测了OSF 30例、正常口腔粘膜(NOR)10例组织中ET-1的定位分布和含量。结果显示:①OSF组织中ET-1有异常表达,其免疫阳性物质主要分布于上皮棘细胞、基底细胞,间质成纤维细胞、血管内皮细胞及平滑肌细胞的胞浆胞膜上;②ET-1在OSF组织表达的阳性率及相对含量均显著高于NOR(P<0.01);③OSF各期ET-1相对含量存在差别,其中早、中期上皮细胞ET-1相对含量显著高于晚期(P<0.05)。由此提示,ET-1可能参与了OSF的纤维化过程。
, http://www.100md.com
The Expression of Endothelin-1 (ET-1) in Oral Submucous Fibrosis Xu Chunjiao, et al. Department of Stomatology, Hunan Medical University,Changsha 410078
Abstract In order to urderstand whether ET-1 is involved in the pathology of oral submucous fibrosis (OSF),a sensitive immuno-histochemical and morphometric technique was adopted in the examination of the localization and content of ET-1 in oral mucosa from 30 patients with OSF, 10 normal oral mucosa. The results showed that:(1) Overexpression of ET-1 showed in mucosa from OSF, the immunostains for ET-1 were prominent within the cytoplasm and on the cell membrane of spinocells, basiocells,fibroblasts, vascular endothelial and smooth muscle cells.(2) The proportion of ET-1 positive cells and the cellular content of ET-1 in OSF was all significantly higher than that in normal control (P<0.01);(3) Difference exists between early, moderate and advanced stages OSF, while the cell contents of ET-1 in early and moderate stages were significantly higher than that in advanced stage in epithelium (P<0.05). ET-1 conld play a role in the fibrogenic process of OSF.
, http://www.100md.com
Key Words Endothelin-1 Oral submucous fibrosis Morphometry
内皮素-1(Endothelin-1,ET-1)是日本学者Yanagisawa于1988年首先从猪主动脉内皮细胞培养的上清液分离纯化的血管活性多肽,是迄今所知最强的缩血管因子[1],近年来大量资料研究表明,ET-1具有促细胞生长效应,尤其能促进与纤维化有关的细胞增殖、刺激胶原合成增加而与组织纤维化关系密切[2~8]。而有关ET-1在口腔粘膜下纤维性变(oral submucous fibrosis,OSF)的表达目前国内外尚无报道。从ET-1的多重生物效应,推测可能与OSF的纤维化的形成有关。本文采用免疫组化染色和图像分析技术检测了ET-1在OSF组织,正常口腔粘膜(normal oral mucosa,NOR)的分布和含量,从而为探讨ET-1参与OSF发病机理提供客观依据。
, http://www.100md.com
材料与方法
1. 标本收集:所有标本均来源于湖南医科大学口腔系粘膜病专科门诊。正常对照组10例取自无槟榔、烟、酒嗜好、身体健康的自愿者相应部位的颊粘膜。病变组按Pindborg病理学标准[9]及临床表现,经病理学家确诊并分期,取OSF早、中、晚期各10例。10%福尔马林固定,常规石蜡包埋,连续切片,4~5μm分别作HE和免疫组化染色。
2. 免疫组化染色:采用美国PENISULALA-BORATORIES公司的兔抗人ET-1抗体和武汉博士德公司的SABC试剂盒进行。①切片脱蜡至水;②3%过氧化氢孵育5min;③PBS浸泡3×5min;④抗原微波修复,0.01M柠檬酸盐缓冲液(pH6.0)95±1.0℃作用2×5min,冷却,重复③;⑤10%正常羊血清封闭37℃30min;⑥1∶500 ET-1抗体,37℃温育30min,4℃冰箱内过夜,重复③;⑦1∶100生物素标记的羊抗兔IgG,37℃温育30min,重复③;⑧1∶100SABC试剂,37℃30min,重复③;⑨新鲜配制0.04%DAB-H2O2液显色,流水冲洗;⑩苏木素复染,封片。以上步骤除注明外,均在室温下进行。每批免疫组化染色中,以正常肾上腺作为阳性对照[10],以PBS取代ET-1抗体作为阴性对照,以正常口腔粘膜为正常对照。
, http://www.100md.com
3. 图像分析。利用MIAS-300型图像分析系统,计量分析已做过免疫组化染色的各组织标本中ET-1相对含量。将切片置于光学显微镜下成像,高分辨摄像机CCP摄像,经计算机处理后,图像分析仪显示数字图像并存储,经图像处理后测定阳性反应物的灰度值。每例随机选择测试10个高倍视野,分别记录上皮和上皮下间质细胞的平均灰度值。平均灰度值是图像分析中用来表示图像的透光率,细胞内ET-1含量高染色深,透光率低则灰度值低,反之则越大[11]。
4. 免疫组化阳性结果判断:阳性对照中,胞浆、胞膜上可见棕黄色颗粒,阴性对照中所有组织和细胞仅为淡淡的浅黄色背景染色,说明ET-1免疫组化染色具有特异性。免疫组化染色的细胞胞浆、胞膜上出现棕黄或黄色颗粒记为阳性细胞,阳性细胞数超过待标记细胞总数50%以上者,记为阳性病例。
结 果
1. ET-1在各组口腔粘膜组织的表达分布
, 百拇医药
正常口腔粘膜,1例ET-1阳性表达,仅在上皮基底层及近基层少量棘细胞胞浆中散在染色,上皮下间质基本不着色。OSF早期,7例ET-1阳性表达,棘细胞、基底细胞胞浆胞膜上均见棕黄色染色,空泡性变的棘细胞亦见棕黄染色(图1,2),间质中成纤维细胞、血管内皮细胞胞浆胞膜亦见阳性染色,此外,血管平滑肌细胞、血管周围少量炎性细胞亦见阳性染色(图3,4)且阳性血管周围的成纤维细胞阳性反应明显。OSF中期,上皮9例ET-1阳性表达,染色范围较早期进一步扩大,棘细胞、基底细胞胞浆胞膜染色加深,间质7例阳性表达,染色强度略弱于上皮细胞。OSF晚期,上皮6例阳性表达范围及染色程度较早、中期减少,除近基层棘细胞胞膜明显深棕色外,其余细胞胞膜胞浆可见散在棕黄染色,间质细胞染色亦相应减弱。
图1 OSF早期 上皮基底细胞、棘细胞、固有层血管内皮细胞及成纤维细胞胞浆胞膜上可见ET-1棕黄染色(×400)
, http://www.100md.com
图2 OSF早期 上皮空泡性变的棘细胞ET-1染色显著增强(×400)
图3 OSF早期 粘膜下层微血管扩张、炎性细胞浸润,内皮细胞及其附近的成纤维细胞棕黄染色,少量炎性细胞亦见棕黄染色(×400)
图4 OSF早期 粘膜下层血管内皮、平滑肌细胞胞浆、胞膜上可见棕黄染色(×400)
各组口腔粘膜组织ET-1表达阳性率(表1),OSF早、中、晚期上皮及间质细胞ET-1阳性率均显著高于正常口腔粘膜(P<0.01),OSF组间无显著差异(P>0.05)。
表1 各组口腔粘膜组织ET-1表达水平 组织学类型
例 数
ET-1表达阳性率
, http://www.100md.com
上 皮
间 质
NOR
10
10%
0
OSF早
10
70%
70%
OSF中
10
90%
, 百拇医药 70%
OSF晚
10
60%
60%
2. ET-1在各组口腔粘膜上皮及间质细胞表达的定量分析
正常口腔粘膜平均灰度值高,ET-1相对含量则低。OSF各期与正常口腔粘膜上皮比较,平均灰度值均明显降低,即ET-1相对含量增高(P<0.01),进一步对OSF早、中、晚期ET-1含量比较,前两者之间无显著差异(P>0.05),OSF晚期ET-1含量显著低于早中期(P<0.01)。间质细胞(主要为成纤维细胞、内皮细胞)中,OSF组织ET-1平均灰度值明显低于正常对照,即相对含量高于正常对照(P<0.01),组间差异不显著(P>0.05)(图5)。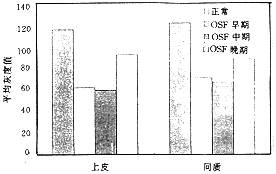
, 百拇医药
图5 各组口腔粘膜上皮和间质细胞ET-1形态计量结果比较图
讨 论
OSF是一种隐匿的慢性疾病,可侵犯口腔任何部分,由于上皮下胶原纤维增多、玻璃样变以及上皮萎缩,引起粘膜硬化,形成条索,最终导致牙关紧闭,妨碍口腔各种功能的发挥。OSF病因尚不清楚,可能的影响因素有咀嚼槟榔、食辣椒、营养不良、基因易感性、自身免疫和胶原代谢紊乱等[12]。国内外学者对其病因病理等方面做了大量的研究,但尚未发现有关ET在OSF发生发展等病理过程中作用的相关研究资料,本研究首次观察研究了ET-1在OSF组织表达和分布状态,结果表明:ET-1在OSF组织表达异常增强,阳性产物主要分布于上皮棘细胞和基底细胞、间质成纤维细胞和血管内皮细胞的胞浆胞膜上,从而为人们研究OSF病变的发生发展机制提供了新的线索。
ET为21氨基酸组成的多肽,其N端氨基酸为胱氨酸,C端氨基酸为色氨酸,分子量约为2,492道尔顿,据其氨基酸顺序的差异分为ET-1、ET-2、ET-3[1],ET-1是最早鉴定并发现,缩血管效应最高,研究最深入。大量资料显示,肺、肝、皮肤、血管等纤维化组织中ET表达高于正常水平[4~8]。体内外实验研究证实,ET可能以自分泌或旁分泌的方式作用于成纤维细胞或与TGF-β、IL-1、PDGF等[13,14]细胞因子协同作用,刺激成纤维细胞增殖,诱导胶原合成增加,降低胶原酶活性,直接或间接影响胶原合成及降解代谢,导致组织纤维化。
, 百拇医药
本研究发现,ET-1存在于成纤维细胞的胞膜胞浆内,从分子水平证实了ET-1与OSF的关系。Kawaguchi等用ELISA和RT-PCR证实,体外培养的皮肤成纤维细胞能产生ET-1蛋白[15],其膜上亦表达ETaRmRNA[6]。由此推测,OSF中的成纤维细胞可能自身合成分泌ET-1,同时,也可能接受上皮、内皮细胞等产生的ET-1(旁分泌),因此,ET-1可能作为一种中间介质参与OSF的纤维化过程。
Zamora用放免法及Northern杂交证实了体外培养的角朊细胞能合成、分泌ET-1[16]。本研究发现OSF口腔上皮细胞胞浆胞膜存在明显的ET-1颗粒,空泡性变棘细胞亦有明显的ET-1表达,且上皮表达强于间质,提示OSF中上皮细胞可能具有合成分泌ET的功能,胞膜上可能还存在ET-1受体。OSF中上皮细胞ET-1超量表达,是否同槟榔咀嚼物相关成分刺激有关,尚需深入研究加以证实。
, http://www.100md.com
在某些病理条件下,ET的过度合成与释放与疾病的发生发展有着密切联系,ET是某些病理过程中机体的一种内源性致病因子。Lerman等[8]免疫组化研究表明,动脉粥样硬化血管壁中,血管内皮细胞、平滑肌细胞均有ET免疫反应物,ET由损伤的血管大量释放,又反馈地损伤血管,它是血管损伤程度的一种标记物。以往研究从病理形态学证实了OSF微血管病变的存在,本研究发现,OSF中微血管内皮及平滑肌细胞ET-1表达增强,进一步从分子水平提示了OSF微血管损伤的存在。过量的ET-1与平滑肌上ET-1受体结合,使血管强烈收缩,血流供给减少而引发营养障碍,导致胶原变性、上皮萎缩;ET-1持久作用刺激平滑肌增殖,引起OSF血管的病理性狭窄、闭锁。此外,我们又发现阳性血管周围的成纤维细胞ET-1明显阳性染色。有文献显示,血管周围活性成纤维细胞表达高水平的Ⅰ、Ⅲ型胶原,血管内皮细胞可调节成纤维细胞活性[17],因此推测,损伤的微血管内皮细胞释放的ET-1也可作用于周围的成纤维细胞。
, http://www.100md.com
本研究显示,OSF各组间也存在差别,OSF晚期上皮细胞ET-1含量显著低于早中期,可能因为纤维化早中期,细胞处于活化状态,晚期细胞活性下降,随着疾病进展,尤其到晚期,胶原等ECM成分大量堆积,血管闭锁、上皮萎缩,细胞成分明显减少,从而使ET-1结合位点随之减少[7],也可能与晚期血管数目减少,内皮源性ET减少有关。本研究认为,ET-1与OSF组织纤维化活跃程度和发病阶段密切相关。
参 考 文 献
[1] Yanagisawa M.kurihara H, Kimuras S, et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature, 1988;332:411~5
[2] Guarda E, Katwa LC,Myers PR,et al.Effects of endothelins on collagen turnover in cardiac fibroblasts. Cardiovascular Res, 1993;27:2130~4
, 百拇医药
[3] Kahaleh MB. Endothelin,an endothelial-dependent vasoconstrictor in scleroderma-enhanced production and profibrotic action. Arthritis Rheum,1991;34(8):978~83
[4] Giaid A, Michel RP, Stewart DJ, et al. Expression of endothelin-1 in lungs of patients with cryptogenic fibrosing alveolitis. Lancet,1993;341:1550~4
[5] Pinzani M,Milanis, Franco RD,et al.Endothelin-1 is overexpressed in human cirrhotic liver and exerts multiple effects on activated hepatic stellate cells. Gastrogenterology,1996;110:534~48
, 百拇医药
[6] Kihuchi K,Kadono T, Sato S, et al.Impaired growth response to endothelin-1 in scleroderma fibroblasts. Biochem Biophys Res Commun,1995;27(2):829~38
[7] Vancheeswaran R, Azam A, Black C, et al.Localization of endothelin-1 and its binding sites in scleroderma skin. J Rheumatol, 1994;21(7):1268~76
[8] Lerman A, Edwards BS, Hallett JW. Circulating and tissue endothelin immunoreactivity in advanced athero-sclerosis. N Engl J Med,1991;325:997~1001
, http://www.100md.com
[9] Pindborg JJ. Dral Submucous fibrosis. Oral Surg, 1966;22:764~7
[10] Li Q, Grimelius L, Zhang X, et al.Ultrastructural localization of endothelin-1 in nonneoplastic, hyperplastic,and neoplastic adoeal gland. Vitrastruet pathol,1995;19(6):489~94
[11] 杜宝东,杜波,张元德,等.增殖细胞核抗原在鼻咽癌中表达的定量研究.中华耳鼻喉科杂志,1997;32(1):21~3
[12] Murti PR, Bhonsle RB, Gupta PC, et al.Etiology of oral submucous fibrosis with special reference to the role of area nut chewing. J Oral Pathol Med, 1995;24(4):145~52
, 百拇医药
[13] Kanse SM, Takahashi R, Lam HC,et al.Cytokine stimulated endothelin release from endothelial cells. Life Sci, 1991;48:1739~84
[14] Taffer FE, Knauss TC, Poptic E, et al.Endothelin stimulates PDGF secretion in cultured human mesangial cells. Kidney,1990;38:1193~8
[15] Kawaguchi Y, Suauki K, Hara H,et al.Increased endothelin-1 production in fibroblasts derived from patients with systemic sclerosis. Ann Rheum Dis, 1994 Aug,53(38):506~10
, 百拇医药
[16] Zomora M, Morelli JG, Norris DA, et al.Cultured human keratinocytes synthesize and secrete endothelin-1. J Invest Dermatol, 1992;98:646
[17] Scharffeter K, Buttgeret BL, Krieg T.Location ofcollagen MRNA in normal and scleroderma skin by in site hybridization. Eur J Clin Invest, 1988;18:9~17
(收稿:1998—04—04), 百拇医药
单位:许春姣 彭解英 刘蜀凡 方厂云 410078长沙,湖南医科大学附属湘雅医院
关键词:内皮素-1;口腔粘膜下纤维性变;形态计量学
临床口腔医学杂志990117 提 要 为探讨ET-1与口腔粘膜下纤维性变(OSF)的关系,应用免疫组化染色和图像分析技术,检测了OSF 30例、正常口腔粘膜(NOR)10例组织中ET-1的定位分布和含量。结果显示:①OSF组织中ET-1有异常表达,其免疫阳性物质主要分布于上皮棘细胞、基底细胞,间质成纤维细胞、血管内皮细胞及平滑肌细胞的胞浆胞膜上;②ET-1在OSF组织表达的阳性率及相对含量均显著高于NOR(P<0.01);③OSF各期ET-1相对含量存在差别,其中早、中期上皮细胞ET-1相对含量显著高于晚期(P<0.05)。由此提示,ET-1可能参与了OSF的纤维化过程。
, http://www.100md.com
The Expression of Endothelin-1 (ET-1) in Oral Submucous Fibrosis Xu Chunjiao, et al. Department of Stomatology, Hunan Medical University,Changsha 410078
Abstract In order to urderstand whether ET-1 is involved in the pathology of oral submucous fibrosis (OSF),a sensitive immuno-histochemical and morphometric technique was adopted in the examination of the localization and content of ET-1 in oral mucosa from 30 patients with OSF, 10 normal oral mucosa. The results showed that:(1) Overexpression of ET-1 showed in mucosa from OSF, the immunostains for ET-1 were prominent within the cytoplasm and on the cell membrane of spinocells, basiocells,fibroblasts, vascular endothelial and smooth muscle cells.(2) The proportion of ET-1 positive cells and the cellular content of ET-1 in OSF was all significantly higher than that in normal control (P<0.01);(3) Difference exists between early, moderate and advanced stages OSF, while the cell contents of ET-1 in early and moderate stages were significantly higher than that in advanced stage in epithelium (P<0.05). ET-1 conld play a role in the fibrogenic process of OSF.
, http://www.100md.com
Key Words Endothelin-1 Oral submucous fibrosis Morphometry
内皮素-1(Endothelin-1,ET-1)是日本学者Yanagisawa于1988年首先从猪主动脉内皮细胞培养的上清液分离纯化的血管活性多肽,是迄今所知最强的缩血管因子[1],近年来大量资料研究表明,ET-1具有促细胞生长效应,尤其能促进与纤维化有关的细胞增殖、刺激胶原合成增加而与组织纤维化关系密切[2~8]。而有关ET-1在口腔粘膜下纤维性变(oral submucous fibrosis,OSF)的表达目前国内外尚无报道。从ET-1的多重生物效应,推测可能与OSF的纤维化的形成有关。本文采用免疫组化染色和图像分析技术检测了ET-1在OSF组织,正常口腔粘膜(normal oral mucosa,NOR)的分布和含量,从而为探讨ET-1参与OSF发病机理提供客观依据。
, http://www.100md.com
材料与方法
1. 标本收集:所有标本均来源于湖南医科大学口腔系粘膜病专科门诊。正常对照组10例取自无槟榔、烟、酒嗜好、身体健康的自愿者相应部位的颊粘膜。病变组按Pindborg病理学标准[9]及临床表现,经病理学家确诊并分期,取OSF早、中、晚期各10例。10%福尔马林固定,常规石蜡包埋,连续切片,4~5μm分别作HE和免疫组化染色。
2. 免疫组化染色:采用美国PENISULALA-BORATORIES公司的兔抗人ET-1抗体和武汉博士德公司的SABC试剂盒进行。①切片脱蜡至水;②3%过氧化氢孵育5min;③PBS浸泡3×5min;④抗原微波修复,0.01M柠檬酸盐缓冲液(pH6.0)95±1.0℃作用2×5min,冷却,重复③;⑤10%正常羊血清封闭37℃30min;⑥1∶500 ET-1抗体,37℃温育30min,4℃冰箱内过夜,重复③;⑦1∶100生物素标记的羊抗兔IgG,37℃温育30min,重复③;⑧1∶100SABC试剂,37℃30min,重复③;⑨新鲜配制0.04%DAB-H2O2液显色,流水冲洗;⑩苏木素复染,封片。以上步骤除注明外,均在室温下进行。每批免疫组化染色中,以正常肾上腺作为阳性对照[10],以PBS取代ET-1抗体作为阴性对照,以正常口腔粘膜为正常对照。
, http://www.100md.com
3. 图像分析。利用MIAS-300型图像分析系统,计量分析已做过免疫组化染色的各组织标本中ET-1相对含量。将切片置于光学显微镜下成像,高分辨摄像机CCP摄像,经计算机处理后,图像分析仪显示数字图像并存储,经图像处理后测定阳性反应物的灰度值。每例随机选择测试10个高倍视野,分别记录上皮和上皮下间质细胞的平均灰度值。平均灰度值是图像分析中用来表示图像的透光率,细胞内ET-1含量高染色深,透光率低则灰度值低,反之则越大[11]。
4. 免疫组化阳性结果判断:阳性对照中,胞浆、胞膜上可见棕黄色颗粒,阴性对照中所有组织和细胞仅为淡淡的浅黄色背景染色,说明ET-1免疫组化染色具有特异性。免疫组化染色的细胞胞浆、胞膜上出现棕黄或黄色颗粒记为阳性细胞,阳性细胞数超过待标记细胞总数50%以上者,记为阳性病例。
结 果
1. ET-1在各组口腔粘膜组织的表达分布
, 百拇医药
正常口腔粘膜,1例ET-1阳性表达,仅在上皮基底层及近基层少量棘细胞胞浆中散在染色,上皮下间质基本不着色。OSF早期,7例ET-1阳性表达,棘细胞、基底细胞胞浆胞膜上均见棕黄色染色,空泡性变的棘细胞亦见棕黄染色(图1,2),间质中成纤维细胞、血管内皮细胞胞浆胞膜亦见阳性染色,此外,血管平滑肌细胞、血管周围少量炎性细胞亦见阳性染色(图3,4)且阳性血管周围的成纤维细胞阳性反应明显。OSF中期,上皮9例ET-1阳性表达,染色范围较早期进一步扩大,棘细胞、基底细胞胞浆胞膜染色加深,间质7例阳性表达,染色强度略弱于上皮细胞。OSF晚期,上皮6例阳性表达范围及染色程度较早、中期减少,除近基层棘细胞胞膜明显深棕色外,其余细胞胞膜胞浆可见散在棕黄染色,间质细胞染色亦相应减弱。

图1 OSF早期 上皮基底细胞、棘细胞、固有层血管内皮细胞及成纤维细胞胞浆胞膜上可见ET-1棕黄染色(×400)
, http://www.100md.com
图2 OSF早期 上皮空泡性变的棘细胞ET-1染色显著增强(×400)
图3 OSF早期 粘膜下层微血管扩张、炎性细胞浸润,内皮细胞及其附近的成纤维细胞棕黄染色,少量炎性细胞亦见棕黄染色(×400)
图4 OSF早期 粘膜下层血管内皮、平滑肌细胞胞浆、胞膜上可见棕黄染色(×400)
各组口腔粘膜组织ET-1表达阳性率(表1),OSF早、中、晚期上皮及间质细胞ET-1阳性率均显著高于正常口腔粘膜(P<0.01),OSF组间无显著差异(P>0.05)。
表1 各组口腔粘膜组织ET-1表达水平 组织学类型
例 数
ET-1表达阳性率
, http://www.100md.com
上 皮
间 质
NOR
10
10%
0
OSF早
10
70%
70%
OSF中
10
90%
, 百拇医药 70%
OSF晚
10
60%
60%
2. ET-1在各组口腔粘膜上皮及间质细胞表达的定量分析
正常口腔粘膜平均灰度值高,ET-1相对含量则低。OSF各期与正常口腔粘膜上皮比较,平均灰度值均明显降低,即ET-1相对含量增高(P<0.01),进一步对OSF早、中、晚期ET-1含量比较,前两者之间无显著差异(P>0.05),OSF晚期ET-1含量显著低于早中期(P<0.01)。间质细胞(主要为成纤维细胞、内皮细胞)中,OSF组织ET-1平均灰度值明显低于正常对照,即相对含量高于正常对照(P<0.01),组间差异不显著(P>0.05)(图5)。

, 百拇医药
图5 各组口腔粘膜上皮和间质细胞ET-1形态计量结果比较图
讨 论
OSF是一种隐匿的慢性疾病,可侵犯口腔任何部分,由于上皮下胶原纤维增多、玻璃样变以及上皮萎缩,引起粘膜硬化,形成条索,最终导致牙关紧闭,妨碍口腔各种功能的发挥。OSF病因尚不清楚,可能的影响因素有咀嚼槟榔、食辣椒、营养不良、基因易感性、自身免疫和胶原代谢紊乱等[12]。国内外学者对其病因病理等方面做了大量的研究,但尚未发现有关ET在OSF发生发展等病理过程中作用的相关研究资料,本研究首次观察研究了ET-1在OSF组织表达和分布状态,结果表明:ET-1在OSF组织表达异常增强,阳性产物主要分布于上皮棘细胞和基底细胞、间质成纤维细胞和血管内皮细胞的胞浆胞膜上,从而为人们研究OSF病变的发生发展机制提供了新的线索。
ET为21氨基酸组成的多肽,其N端氨基酸为胱氨酸,C端氨基酸为色氨酸,分子量约为2,492道尔顿,据其氨基酸顺序的差异分为ET-1、ET-2、ET-3[1],ET-1是最早鉴定并发现,缩血管效应最高,研究最深入。大量资料显示,肺、肝、皮肤、血管等纤维化组织中ET表达高于正常水平[4~8]。体内外实验研究证实,ET可能以自分泌或旁分泌的方式作用于成纤维细胞或与TGF-β、IL-1、PDGF等[13,14]细胞因子协同作用,刺激成纤维细胞增殖,诱导胶原合成增加,降低胶原酶活性,直接或间接影响胶原合成及降解代谢,导致组织纤维化。
, 百拇医药
本研究发现,ET-1存在于成纤维细胞的胞膜胞浆内,从分子水平证实了ET-1与OSF的关系。Kawaguchi等用ELISA和RT-PCR证实,体外培养的皮肤成纤维细胞能产生ET-1蛋白[15],其膜上亦表达ETaRmRNA[6]。由此推测,OSF中的成纤维细胞可能自身合成分泌ET-1,同时,也可能接受上皮、内皮细胞等产生的ET-1(旁分泌),因此,ET-1可能作为一种中间介质参与OSF的纤维化过程。
Zamora用放免法及Northern杂交证实了体外培养的角朊细胞能合成、分泌ET-1[16]。本研究发现OSF口腔上皮细胞胞浆胞膜存在明显的ET-1颗粒,空泡性变棘细胞亦有明显的ET-1表达,且上皮表达强于间质,提示OSF中上皮细胞可能具有合成分泌ET的功能,胞膜上可能还存在ET-1受体。OSF中上皮细胞ET-1超量表达,是否同槟榔咀嚼物相关成分刺激有关,尚需深入研究加以证实。
, http://www.100md.com
在某些病理条件下,ET的过度合成与释放与疾病的发生发展有着密切联系,ET是某些病理过程中机体的一种内源性致病因子。Lerman等[8]免疫组化研究表明,动脉粥样硬化血管壁中,血管内皮细胞、平滑肌细胞均有ET免疫反应物,ET由损伤的血管大量释放,又反馈地损伤血管,它是血管损伤程度的一种标记物。以往研究从病理形态学证实了OSF微血管病变的存在,本研究发现,OSF中微血管内皮及平滑肌细胞ET-1表达增强,进一步从分子水平提示了OSF微血管损伤的存在。过量的ET-1与平滑肌上ET-1受体结合,使血管强烈收缩,血流供给减少而引发营养障碍,导致胶原变性、上皮萎缩;ET-1持久作用刺激平滑肌增殖,引起OSF血管的病理性狭窄、闭锁。此外,我们又发现阳性血管周围的成纤维细胞ET-1明显阳性染色。有文献显示,血管周围活性成纤维细胞表达高水平的Ⅰ、Ⅲ型胶原,血管内皮细胞可调节成纤维细胞活性[17],因此推测,损伤的微血管内皮细胞释放的ET-1也可作用于周围的成纤维细胞。
, http://www.100md.com
本研究显示,OSF各组间也存在差别,OSF晚期上皮细胞ET-1含量显著低于早中期,可能因为纤维化早中期,细胞处于活化状态,晚期细胞活性下降,随着疾病进展,尤其到晚期,胶原等ECM成分大量堆积,血管闭锁、上皮萎缩,细胞成分明显减少,从而使ET-1结合位点随之减少[7],也可能与晚期血管数目减少,内皮源性ET减少有关。本研究认为,ET-1与OSF组织纤维化活跃程度和发病阶段密切相关。
参 考 文 献
[1] Yanagisawa M.kurihara H, Kimuras S, et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature, 1988;332:411~5
[2] Guarda E, Katwa LC,Myers PR,et al.Effects of endothelins on collagen turnover in cardiac fibroblasts. Cardiovascular Res, 1993;27:2130~4
, 百拇医药
[3] Kahaleh MB. Endothelin,an endothelial-dependent vasoconstrictor in scleroderma-enhanced production and profibrotic action. Arthritis Rheum,1991;34(8):978~83
[4] Giaid A, Michel RP, Stewart DJ, et al. Expression of endothelin-1 in lungs of patients with cryptogenic fibrosing alveolitis. Lancet,1993;341:1550~4
[5] Pinzani M,Milanis, Franco RD,et al.Endothelin-1 is overexpressed in human cirrhotic liver and exerts multiple effects on activated hepatic stellate cells. Gastrogenterology,1996;110:534~48
, 百拇医药
[6] Kihuchi K,Kadono T, Sato S, et al.Impaired growth response to endothelin-1 in scleroderma fibroblasts. Biochem Biophys Res Commun,1995;27(2):829~38
[7] Vancheeswaran R, Azam A, Black C, et al.Localization of endothelin-1 and its binding sites in scleroderma skin. J Rheumatol, 1994;21(7):1268~76
[8] Lerman A, Edwards BS, Hallett JW. Circulating and tissue endothelin immunoreactivity in advanced athero-sclerosis. N Engl J Med,1991;325:997~1001
, http://www.100md.com
[9] Pindborg JJ. Dral Submucous fibrosis. Oral Surg, 1966;22:764~7
[10] Li Q, Grimelius L, Zhang X, et al.Ultrastructural localization of endothelin-1 in nonneoplastic, hyperplastic,and neoplastic adoeal gland. Vitrastruet pathol,1995;19(6):489~94
[11] 杜宝东,杜波,张元德,等.增殖细胞核抗原在鼻咽癌中表达的定量研究.中华耳鼻喉科杂志,1997;32(1):21~3
[12] Murti PR, Bhonsle RB, Gupta PC, et al.Etiology of oral submucous fibrosis with special reference to the role of area nut chewing. J Oral Pathol Med, 1995;24(4):145~52
, 百拇医药
[13] Kanse SM, Takahashi R, Lam HC,et al.Cytokine stimulated endothelin release from endothelial cells. Life Sci, 1991;48:1739~84
[14] Taffer FE, Knauss TC, Poptic E, et al.Endothelin stimulates PDGF secretion in cultured human mesangial cells. Kidney,1990;38:1193~8
[15] Kawaguchi Y, Suauki K, Hara H,et al.Increased endothelin-1 production in fibroblasts derived from patients with systemic sclerosis. Ann Rheum Dis, 1994 Aug,53(38):506~10
, 百拇医药
[16] Zomora M, Morelli JG, Norris DA, et al.Cultured human keratinocytes synthesize and secrete endothelin-1. J Invest Dermatol, 1992;98:646
[17] Scharffeter K, Buttgeret BL, Krieg T.Location ofcollagen MRNA in normal and scleroderma skin by in site hybridization. Eur J Clin Invest, 1988;18:9~17
(收稿:1998—04—04), 百拇医药