维甲酸受体在乳腺癌中表达的研究*
作者:蔡三军 余黎明 邵志敏 韩企夏 沈镇宙
单位:上海医科大学肿瘤医院外科(上海 200032)
关键词:乳腺肿瘤;维甲酸;核受体;基因表达
肿瘤990115 维生素A族化合物包括维生素A及其衍生物,维甲酸属于此族化合物的一种。它们在预防肿瘤包括乳腺癌的发生及各种细胞的分化中起着重要的作用[1]。它们主要是通过与甾体激素同属核受体家族的维甲酸受体(RARs)和相关受体(RXRs)起作用,两类受体各分α、β、γ三种亚型[2]。研究表明RARα在维生素A族化合物(维甲酸)抑制乳腺癌细胞生长中起关键作用,可以作为一个指标,指导临床应用维甲酸治疗乳腺癌[3],其mRNA的表达与雌激素受体(ER)相关[4]。以往的实验都是应用Northern Blot检测mRNA的表达情况,本实验进一步应用Western Blot及免疫组化的方法研究了乳腺癌细胞株中RARα蛋白表达情况,同时用免疫组化的方法检测了58例乳腺癌标本中RARα蛋白的表达情况,以及其与ER的关系。
, 百拇医药
材料与方法
1.乳腺癌细胞株及乳腺癌肿瘤标本 乳腺癌细胞株MCF-7(ER阳性)、ZR-75(ER阴性)、MDA-MB-231(ER阴性)由美国马利兰大学癌症中心Dr. Fontana馈赠。58例原发乳腺癌标本来自上海医科大学肿瘤医院手术标本,均经病理证实为乳腺癌,其中单纯癌14例,浸润性导管癌20例,硬癌4例,髓样癌3例,腺癌5例,粘液腺癌6例,导管内癌5例,小叶癌1例。制成5微米厚的石蜡切片进行免疫组化的检测。
2.试剂 DMEM/Ham' F12培养基购自Gibco公司;小牛血清购自杭州四季青生物工程材料研究所;HEPES、G418购自Sigma公司;32P dCTP[1.17×104 Bq/mmol(3000 Ci/mmol)]购自Amersham公司:BCA试剂盒购自Pierce公司;免疫组化试剂盒购自DAKO公司;RARα单抗及Actin单抗分别购自Gene公司及Oncogene公司。
, 百拇医药
3.细胞培养和细胞爬片制作 乳腺癌细胞在含10%小牛血清,25 mmol HEPES,50 μg/ml庆大霉素的DMEM/Ham′F 12(1:1)培养液中培养,每2天换培养液。含培养液的100 mm培养皿中放入4~5块盖玻片,滴加含一定细胞数的细胞悬液,培养数天,取出盖玻片,PBS洗,丙酮固定后,保存于4°冰箱待用。
4.cDNA探针、RNA分离和Northern Blot RARα cDNA特异性片段经EcoR1限制性内切酶消化后,采用电泳分离法纯化600 bp片段,探针的制作采用Fienberg和Vogelstien方法[5],RNA的分离采用Chromczynski和Sacchi的方法[5]。25 μg的RNA在1%琼脂凝胶上分离,然后转移到硝酸纤维素膜上,与32P特异性探针杂交,经放射自显影,曝光显色。
5.Western Blot 收集细胞后,裂解液裂解细胞,用BCA法测定蛋白浓度,以确保各泳道上样量相等。10%SDS-聚丙烯酰胺凝胶电泳(100 V、2 h),纤维素膜室温下用阻断剂处理1 h,RARα单抗(1:1000)温育过夜,HRP标记的二抗(1:5000)作用2 h后,用ECL荧光显色系统,曝光显色。
, 百拇医药
6.免疫组化 按DAKO公司ABC免疫组化试剂盒方法。石蜡切片经二甲苯、酒精常规脱腊、水化后,用PBS洗,经过氧化氢及阻断剂处理,消除内源性过氧化物酶及非特异性抗原,一抗RARα、ER(1:400)室温过夜,PBS洗,二抗、三抗分别作用半小时,用DAB显色5~10 min,镜下满意后,双蒸水中止反应,晾干,二甲苯透明,中性树胶封片。阴性对照切片不加一抗。细胞爬片的免疫组化检测,除了不需脱蜡,其余步骤同石蜡切片。显微镜检查判断表达情况,肿瘤细胞核及浆中有棕黄色颗粒出现的为阳性细胞,选取有代表性的区域(不小于5个高倍视野),计数500个细胞中的阳性细胞数,以阳性细胞数占所计数的肿瘤细胞总数的百分比大于或等于25%的视为阳性,小于25%的为阴性。
7.乳腺癌标本中RARα蛋白的表达与ER表达的相关性比较用χ2检验。
结 果
1.Northern Blot检测RARα mRNA在乳腺癌细胞中的表达 如图1所示。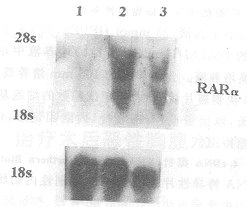
, 百拇医药
图1 Northern Blot检测RARα mRNA在人乳腺癌细胞株中的表达情况。1、为MDA-MB-231(ER阴性)。2、为ZR-75(ER阳性)。3、MCF-7(ER阳性)。可见ER阳性的乳腺癌细胞株中RARα RNA的表达明显高于ER阴性的乳腺癌细胞株。下图为18s杂交情况作为内对照。
2.Western Blot检测RARα蛋白的表达 如图2所示。
图2 Western Blot检测RARα蛋白在人乳腺癌细胞株中的表达情况。1、为MCF-7。2、为ZR-75。3、MDA-MB-231。可见ER阳性的乳腺癌细胞株中RARα蛋白的表达明显高于ER阴性的乳腺癌细胞株。RARα蛋白分子量大约在50 kD。下图为actin表达情况作为内对照。
3.免疫组化检测RARα蛋白在乳腺癌细胞株中的表达 (见插页第2页图3),RARα蛋白表达的ER阳性的MCF-7乳腺癌细胞株中明显高于ER阴性的MDA-MB-231细胞中的表达。
, 百拇医药
图3 免疫组化方法检测RAR α蛋白在人乳腺癌细胞株中的表达情况
MCF-7细胞(ER阳性)RAR α蛋白阳性着色在细胞膜
4、RARα蛋白、ER在乳腺癌组织标本中的表达及两者表达的相关性(见附表):在58例乳腺癌标本中,ER阳性的为37例,阳性率为63.8%,RARα阳性的为36例,阳性率为62.1%,在ER阳性的37例中RARα阳性的为28例,占75.5%,ER阴性的21例中RARα阴性的为13例,两者表达的相关性经χ2检验有统计学意义(P<0.01)(见附表)。
附表 58例乳腺癌组织ER和RARα表达情况
RARα阳性(%)
RARα阴性
总数(%)
, 百拇医药
ER阳性
28
9
37(63.8)
ER阴性
8
13
21
总数
36(62.1)
22
58
讨 论
, 百拇医药
维甲酸在乳腺癌的增殖和分化中起着重要的作用,其通过与维甲酸受体(RARs)及相关受体(RXRs)结合而起作用。研究发现维甲酸对乳腺癌细胞生长抑制作用与ER相关。ER阳性的乳腺癌细胞生长能被维甲酸抑制,而ER阴性的乳腺癌细胞对维甲酸耐受[6,7]。
Roman首先报道了在乳腺癌细胞中ER阳性细胞RARα mRNA的表达明显高于ER阴性的细胞,其他受体亚型的表达在两类细胞间无明显差别[4]。提示了RARα与ER以及维甲酸作用间存在一定的关系。Sheikh等应用基因转染技术,证明RARα mRNA的高表达与维甲酸抑制乳腺癌细胞生长有直接关系,说明在维甲酸抑制乳腺癌细胞生长中RARα起关键作用。提出RARα也许可作为指导临床上应用维甲酸治疗和预防乳腺癌的指标[3]。
本实验在应用Northern Blot的检测乳腺癌细胞株中RARα mRNA表达的同时,用Western Blot、免疫组化的方法检测了RARα蛋白的表达情况。发现RARα蛋白表达与其mRNA表达相一致,RARα mRNA表达高的ER阳性乳腺癌细胞中RARα蛋白表达也高,RARα mRNA蛋白表达都与ER状况相关,另外,从Western Blot检测可知,RARα蛋白分子量大约在46~47 kD之间。
, 百拇医药
维甲酸受体(RARs)及相关受体(RXRs)与ER、PR等甾体激素受体同属核受体家族,它们都以二聚体的形式起作用[2]。在乳腺癌细胞中,ER受体蛋白在胞浆和胞核均有分布,关于其定位及作用机制目前有Gorski的二步模式、King的一步模式、Sheridan的平衡模式三种学说[8]。本实验免疫组化的结果可知,不论是乳腺癌细胞株还是乳腺癌标本,RARα蛋白在胞浆和胞核均有分布,以核为主,但其作用机制是否也可以用ER作用的三种模式加以解释,还有待进一步研究。
RNA性质不稳定,其检测有一定的困难,且方法较复杂,实际工作中难以推广,而蛋白质性质相对稳定。本实验用Northern Blot、Western Blot、免疫组化三种不同的方法从mRNA及蛋白表达水平检测了RARα在乳腺癌细胞中的表达情况,得到一致的结果,说明三种检测方法都具可信性。实际工作中可以因地制宜的选用合适的检测方法为临床服务。免疫组化是一种简单可行的检测手段,在病理组织切片检测上,可以避免Norhtern Blot、Western Blot因组织异质性所致的偏差,阳性定位一目了然,有其特有的优点。
, 百拇医药
在58例乳腺癌治疗标本中,用免疫组化的方法检测了RARα的表达及其与ER的关系,发现ER阳性率为63.8%,与文献报道基本符合。RARα的阳性率为62.1%,37例ER阳性的肿瘤中28例为RARα阳性,21例ER阴性的肿瘤中13例为RARα阴性,两者的表达有相关性(P<0.01)。Roman及Sheikh曾报道在体外细胞培养中,雌激素在ER的介导下能提高RARα的表达[9,10]。作者在乳腺癌标本中发现RARα蛋白表达与ER表达有相关性,提示了在体内RARα的表达也可能与ER介导的雌激素调控有关。
第一作者简介 蔡三军,男,临床医学博士,副教授。
本文为国家自然科学基金资助课题
参 考 文 献
1 Sporn MB and Roberts AB, Interaction of retinoids and transforming growth factor-β in regulation of cell differentiation and proliferation. Mol Endocrinol. 1991, 5:3
, http://www.100md.com
2 Mangelsdorf DJ, Ong ES, Evans RM, et al. Nuclear receptor that identifies a novel retinoic acid response pathway. Nature, 1990, 345:224
3 Sheikh MS, Shao ZM, Li XS, et al. Retinoid-resistant estrogen receptor-negative human inhibition by retinoics. J Biol Chem. 1994, 268:21440
4 Roman SD, Charke CL, Hall RE, et al. Expression and regulation of retinoic acid receptors in human breast cancer cell. Cancer Res.1992, 52:2236
, 百拇医药
5 Fontana JA, Interaction of retinoids and tamoxifen on the inhibition of human mammary carcinoma cell proliferation. Exp Cell Res. 1987, 55:136
6 Li XS, Chen JC, et al. Retinoic acid inhibition of insulin-like growth factor I stimulation of c-fos mRNA levels in a breast cancer cell line. Exp Cell Res. 1994, 211:68
7 Fontana JA, Burrows-Mezu A. and Miranda D. Retinoid modulation of estradiol-stimulated growth and of protein sythesis and secretion in human breast carcinoma cells. Cancer Res. 1990, 50:1997
, 百拇医药
8 田 英. 甾体激素受体总论. 雌激素受体. 见吕宝璋,田英主编. 受体学概论. 第一版. 北京科学出版社,1991:239,274
9 Sheikh MS, Shao ZM, Chen JC, et al. Estrogen receptor-negative breast cancer cells transfected with the estrogen receptor exhibit increased RARα gene expression and sensitivity to growth inhibition by retinoic acid. J Cell Biochem. 1993, 53:394
10 Roman SD, Oumandy CJ, Manning DC, et al. Estrodiol induction of retinoic acid receptors in human breast cancer cells. Cancer Res. 1993, 53:5940
(收稿:1998-04-08 修回:1998-08-31), 百拇医药
单位:上海医科大学肿瘤医院外科(上海 200032)
关键词:乳腺肿瘤;维甲酸;核受体;基因表达
肿瘤990115 维生素A族化合物包括维生素A及其衍生物,维甲酸属于此族化合物的一种。它们在预防肿瘤包括乳腺癌的发生及各种细胞的分化中起着重要的作用[1]。它们主要是通过与甾体激素同属核受体家族的维甲酸受体(RARs)和相关受体(RXRs)起作用,两类受体各分α、β、γ三种亚型[2]。研究表明RARα在维生素A族化合物(维甲酸)抑制乳腺癌细胞生长中起关键作用,可以作为一个指标,指导临床应用维甲酸治疗乳腺癌[3],其mRNA的表达与雌激素受体(ER)相关[4]。以往的实验都是应用Northern Blot检测mRNA的表达情况,本实验进一步应用Western Blot及免疫组化的方法研究了乳腺癌细胞株中RARα蛋白表达情况,同时用免疫组化的方法检测了58例乳腺癌标本中RARα蛋白的表达情况,以及其与ER的关系。
, 百拇医药
材料与方法
1.乳腺癌细胞株及乳腺癌肿瘤标本 乳腺癌细胞株MCF-7(ER阳性)、ZR-75(ER阴性)、MDA-MB-231(ER阴性)由美国马利兰大学癌症中心Dr. Fontana馈赠。58例原发乳腺癌标本来自上海医科大学肿瘤医院手术标本,均经病理证实为乳腺癌,其中单纯癌14例,浸润性导管癌20例,硬癌4例,髓样癌3例,腺癌5例,粘液腺癌6例,导管内癌5例,小叶癌1例。制成5微米厚的石蜡切片进行免疫组化的检测。
2.试剂 DMEM/Ham' F12培养基购自Gibco公司;小牛血清购自杭州四季青生物工程材料研究所;HEPES、G418购自Sigma公司;32P dCTP[1.17×104 Bq/mmol(3000 Ci/mmol)]购自Amersham公司:BCA试剂盒购自Pierce公司;免疫组化试剂盒购自DAKO公司;RARα单抗及Actin单抗分别购自Gene公司及Oncogene公司。
, 百拇医药
3.细胞培养和细胞爬片制作 乳腺癌细胞在含10%小牛血清,25 mmol HEPES,50 μg/ml庆大霉素的DMEM/Ham′F 12(1:1)培养液中培养,每2天换培养液。含培养液的100 mm培养皿中放入4~5块盖玻片,滴加含一定细胞数的细胞悬液,培养数天,取出盖玻片,PBS洗,丙酮固定后,保存于4°冰箱待用。
4.cDNA探针、RNA分离和Northern Blot RARα cDNA特异性片段经EcoR1限制性内切酶消化后,采用电泳分离法纯化600 bp片段,探针的制作采用Fienberg和Vogelstien方法[5],RNA的分离采用Chromczynski和Sacchi的方法[5]。25 μg的RNA在1%琼脂凝胶上分离,然后转移到硝酸纤维素膜上,与32P特异性探针杂交,经放射自显影,曝光显色。
5.Western Blot 收集细胞后,裂解液裂解细胞,用BCA法测定蛋白浓度,以确保各泳道上样量相等。10%SDS-聚丙烯酰胺凝胶电泳(100 V、2 h),纤维素膜室温下用阻断剂处理1 h,RARα单抗(1:1000)温育过夜,HRP标记的二抗(1:5000)作用2 h后,用ECL荧光显色系统,曝光显色。
, 百拇医药
6.免疫组化 按DAKO公司ABC免疫组化试剂盒方法。石蜡切片经二甲苯、酒精常规脱腊、水化后,用PBS洗,经过氧化氢及阻断剂处理,消除内源性过氧化物酶及非特异性抗原,一抗RARα、ER(1:400)室温过夜,PBS洗,二抗、三抗分别作用半小时,用DAB显色5~10 min,镜下满意后,双蒸水中止反应,晾干,二甲苯透明,中性树胶封片。阴性对照切片不加一抗。细胞爬片的免疫组化检测,除了不需脱蜡,其余步骤同石蜡切片。显微镜检查判断表达情况,肿瘤细胞核及浆中有棕黄色颗粒出现的为阳性细胞,选取有代表性的区域(不小于5个高倍视野),计数500个细胞中的阳性细胞数,以阳性细胞数占所计数的肿瘤细胞总数的百分比大于或等于25%的视为阳性,小于25%的为阴性。
7.乳腺癌标本中RARα蛋白的表达与ER表达的相关性比较用χ2检验。
结 果
1.Northern Blot检测RARα mRNA在乳腺癌细胞中的表达 如图1所示。

, 百拇医药
图1 Northern Blot检测RARα mRNA在人乳腺癌细胞株中的表达情况。1、为MDA-MB-231(ER阴性)。2、为ZR-75(ER阳性)。3、MCF-7(ER阳性)。可见ER阳性的乳腺癌细胞株中RARα RNA的表达明显高于ER阴性的乳腺癌细胞株。下图为18s杂交情况作为内对照。
2.Western Blot检测RARα蛋白的表达 如图2所示。

图2 Western Blot检测RARα蛋白在人乳腺癌细胞株中的表达情况。1、为MCF-7。2、为ZR-75。3、MDA-MB-231。可见ER阳性的乳腺癌细胞株中RARα蛋白的表达明显高于ER阴性的乳腺癌细胞株。RARα蛋白分子量大约在50 kD。下图为actin表达情况作为内对照。
3.免疫组化检测RARα蛋白在乳腺癌细胞株中的表达 (见插页第2页图3),RARα蛋白表达的ER阳性的MCF-7乳腺癌细胞株中明显高于ER阴性的MDA-MB-231细胞中的表达。

, 百拇医药
图3 免疫组化方法检测RAR α蛋白在人乳腺癌细胞株中的表达情况
MCF-7细胞(ER阳性)RAR α蛋白阳性着色在细胞膜
4、RARα蛋白、ER在乳腺癌组织标本中的表达及两者表达的相关性(见附表):在58例乳腺癌标本中,ER阳性的为37例,阳性率为63.8%,RARα阳性的为36例,阳性率为62.1%,在ER阳性的37例中RARα阳性的为28例,占75.5%,ER阴性的21例中RARα阴性的为13例,两者表达的相关性经χ2检验有统计学意义(P<0.01)(见附表)。
附表 58例乳腺癌组织ER和RARα表达情况
RARα阳性(%)
RARα阴性
总数(%)
, 百拇医药
ER阳性
28
9
37(63.8)
ER阴性
8
13
21
总数
36(62.1)
22
58
讨 论
, 百拇医药
维甲酸在乳腺癌的增殖和分化中起着重要的作用,其通过与维甲酸受体(RARs)及相关受体(RXRs)结合而起作用。研究发现维甲酸对乳腺癌细胞生长抑制作用与ER相关。ER阳性的乳腺癌细胞生长能被维甲酸抑制,而ER阴性的乳腺癌细胞对维甲酸耐受[6,7]。
Roman首先报道了在乳腺癌细胞中ER阳性细胞RARα mRNA的表达明显高于ER阴性的细胞,其他受体亚型的表达在两类细胞间无明显差别[4]。提示了RARα与ER以及维甲酸作用间存在一定的关系。Sheikh等应用基因转染技术,证明RARα mRNA的高表达与维甲酸抑制乳腺癌细胞生长有直接关系,说明在维甲酸抑制乳腺癌细胞生长中RARα起关键作用。提出RARα也许可作为指导临床上应用维甲酸治疗和预防乳腺癌的指标[3]。
本实验在应用Northern Blot的检测乳腺癌细胞株中RARα mRNA表达的同时,用Western Blot、免疫组化的方法检测了RARα蛋白的表达情况。发现RARα蛋白表达与其mRNA表达相一致,RARα mRNA表达高的ER阳性乳腺癌细胞中RARα蛋白表达也高,RARα mRNA蛋白表达都与ER状况相关,另外,从Western Blot检测可知,RARα蛋白分子量大约在46~47 kD之间。
, 百拇医药
维甲酸受体(RARs)及相关受体(RXRs)与ER、PR等甾体激素受体同属核受体家族,它们都以二聚体的形式起作用[2]。在乳腺癌细胞中,ER受体蛋白在胞浆和胞核均有分布,关于其定位及作用机制目前有Gorski的二步模式、King的一步模式、Sheridan的平衡模式三种学说[8]。本实验免疫组化的结果可知,不论是乳腺癌细胞株还是乳腺癌标本,RARα蛋白在胞浆和胞核均有分布,以核为主,但其作用机制是否也可以用ER作用的三种模式加以解释,还有待进一步研究。
RNA性质不稳定,其检测有一定的困难,且方法较复杂,实际工作中难以推广,而蛋白质性质相对稳定。本实验用Northern Blot、Western Blot、免疫组化三种不同的方法从mRNA及蛋白表达水平检测了RARα在乳腺癌细胞中的表达情况,得到一致的结果,说明三种检测方法都具可信性。实际工作中可以因地制宜的选用合适的检测方法为临床服务。免疫组化是一种简单可行的检测手段,在病理组织切片检测上,可以避免Norhtern Blot、Western Blot因组织异质性所致的偏差,阳性定位一目了然,有其特有的优点。
, 百拇医药
在58例乳腺癌治疗标本中,用免疫组化的方法检测了RARα的表达及其与ER的关系,发现ER阳性率为63.8%,与文献报道基本符合。RARα的阳性率为62.1%,37例ER阳性的肿瘤中28例为RARα阳性,21例ER阴性的肿瘤中13例为RARα阴性,两者的表达有相关性(P<0.01)。Roman及Sheikh曾报道在体外细胞培养中,雌激素在ER的介导下能提高RARα的表达[9,10]。作者在乳腺癌标本中发现RARα蛋白表达与ER表达有相关性,提示了在体内RARα的表达也可能与ER介导的雌激素调控有关。
第一作者简介 蔡三军,男,临床医学博士,副教授。
本文为国家自然科学基金资助课题
参 考 文 献
1 Sporn MB and Roberts AB, Interaction of retinoids and transforming growth factor-β in regulation of cell differentiation and proliferation. Mol Endocrinol. 1991, 5:3
, http://www.100md.com
2 Mangelsdorf DJ, Ong ES, Evans RM, et al. Nuclear receptor that identifies a novel retinoic acid response pathway. Nature, 1990, 345:224
3 Sheikh MS, Shao ZM, Li XS, et al. Retinoid-resistant estrogen receptor-negative human inhibition by retinoics. J Biol Chem. 1994, 268:21440
4 Roman SD, Charke CL, Hall RE, et al. Expression and regulation of retinoic acid receptors in human breast cancer cell. Cancer Res.1992, 52:2236
, 百拇医药
5 Fontana JA, Interaction of retinoids and tamoxifen on the inhibition of human mammary carcinoma cell proliferation. Exp Cell Res. 1987, 55:136
6 Li XS, Chen JC, et al. Retinoic acid inhibition of insulin-like growth factor I stimulation of c-fos mRNA levels in a breast cancer cell line. Exp Cell Res. 1994, 211:68
7 Fontana JA, Burrows-Mezu A. and Miranda D. Retinoid modulation of estradiol-stimulated growth and of protein sythesis and secretion in human breast carcinoma cells. Cancer Res. 1990, 50:1997
, 百拇医药
8 田 英. 甾体激素受体总论. 雌激素受体. 见吕宝璋,田英主编. 受体学概论. 第一版. 北京科学出版社,1991:239,274
9 Sheikh MS, Shao ZM, Chen JC, et al. Estrogen receptor-negative breast cancer cells transfected with the estrogen receptor exhibit increased RARα gene expression and sensitivity to growth inhibition by retinoic acid. J Cell Biochem. 1993, 53:394
10 Roman SD, Oumandy CJ, Manning DC, et al. Estrodiol induction of retinoic acid receptors in human breast cancer cells. Cancer Res. 1993, 53:5940
(收稿:1998-04-08 修回:1998-08-31), 百拇医药