鼻咽癌细胞系SUNE中EBV-LMP1基因对上皮细胞增殖的影响
作者:陈宜芳 郭辉玉 汪慧民 李满枝
单位:陈宜芳(中山医科大学孙逸仙纪念医院(广州510089);郭辉玉(中山医科大学微生物学教研室);汪慧民 李满枝(中山医科大学肿瘤研究所)
关键词:EB病毒;潜伏膜蛋白1;上皮细胞,增殖
肿瘤990105 目的 研究鼻咽癌细胞系SUNE中EBV-LMP1基因对上皮细胞增殖的影响,探索LMP1在鼻咽癌发生中所起的作用。 方法 用LMP1基因真核表达质粒转染人胚肾上皮细胞,检测LMP1的表达,观察细胞在软琼脂中的集落形成能力,MTT吸收能力以及PCNA的表达情况。 结果 被LMP1基因转染的细胞生长旺盛,能在软琼脂中形成多个集落,MTT吸收能力增强,PCNA的表达水平增高。 结论 LMP1基因能明显改变上皮细胞的生物学行为,促进细胞的生长、增殖和转化,使转染的上皮细胞获得肿瘤细胞的生长特征。
, 百拇医药
INFLUENCE OF EBV LATENT MEMBRANE PROTEIN 1 GENE
ISOLATED FROM HUMAN NASOPHARYNGEAL CARCINOMA
CELL LINE SUNE ON THE PROLIFERATION OF EPITHELIAL CELLS
Chen Yifang,Guo Huiyu,Wang Huimin, et al.
Sun Yat-sen University of Medical Sciences, Guangzhou 510120
Objective:To study the influence of EBV latent membrane protein1 (LMP1) gene isolated from nasopharyngeal carcinoma cell line SUNE on the proliferation of epithelial cells and the role of LMP1 in tumorigenesis of nasopharyngeal carcinoma.Methods:EBV LMP1 gene eukaryotic expression plasmid was transfected into human embryo kidney epithelial cell.The expression of LMP1 protein in transfected cells was detected.The formation of colonies in soft agar,the value of MTT absorbed and the expression of PCNA were observed.Results:The transfected cells grew vigorously and formed more colonies in soft agar,the MTT uptake and PCNA expression were apparently increased.Conclusion:LMP1 gene could alter the biological behavior of epithelial cells,promote cell growth,proliferation and transformation,and endow the transfected cells with growth characteristics like tumor cells.
, 百拇医药
Key words Epstien-Barr virus Latent membrane protein 1 Epithelial cell,proliferation
鼻咽癌(Nasopharyngeal carcinoma,NPC)与EB病毒(Epstein-Barr Virus,EBV)密切相关,各种类型的NPC组织均存在EBV DNA。EBV潜伏膜蛋白1(latent membrane protein 1,LMP1)是NPC组织中表达的唯一与细胞转化有关的蛋白[1],LMP1基因已被认为是病毒的一种癌基因。以往对LMP1的研究资料大多来自于EBV原型株B95-8细胞,近年来学者们开始关注NPC组织中的LMP1的研究,并已发现不同地域来源,不同分化程度的NPC组织中的LMP1基因结构与功能似乎存在一定差异[2,3]。中国广东为世界上NPC的最高发区,本校肿瘤研究所建立了来自广东患者的NPC体外传代细胞系SUNE,多项实验证明该细胞携带有EBV,作者从SUNE中扩增出EBV LMP1全基因,并以B95-8细胞中LMP1为对照,同时建立了该基因的真核表达质粒。关于EBV LMP1对B淋巴细胞的转化作用已有较多实验[4,6],但关于LMP1对上皮细胞的影响认识尚浅。NPC为上皮细胞来源的肿瘤,深入研究LMP1对上皮细胞的作用将更能贴近于探讨LMP1与NPC的关系。本文用LMP1基因真核表达质粒转染到人胚肾上皮细胞,观察LMP1基因对上皮细胞增殖的影响,旨在探索LMP1在NPC发生中所起的作用。
, http://www.100md.com
材料与方法
1.EBV-LMP1基因真核表达质粒pcDNA3-(S)LMP1及pcDNA3-(B)LMP1:由本室制备,根据Gene Bank公布的EBV基因序列[7],利用National Biosciences公司编制的Oligo引物分析软件电脑辅助设计一对引物,用长片段DNA PCR扩增试剂盒(ExpandTM High Fidelity PCR System,Boehringer Mannheim公司产品)分别从SUNE细胞及B95-8细胞DNA中扩增出LMP1全基因,长度约为3.4 kb,相当于EBV基因组上的位置为166,608 nt~170,033 nt,包括LMP1基因的上游调控序列,LMP1编码序列的三个外显子,两个内含子及下游polyA信号序列。先将该片段连接于pUC18载体的Bam HI位点,再定向亚克隆于真核细胞表达载体pcDNA3。由SUNE细胞及由B95-8细胞来源的LMP1基因所建立的真核表达质粒分别命名为pcDNA3-(S)LMP1及pcDNA3-(B)LMP1。
, 百拇医药
2.真核细胞表达质粒转染293细胞(293细胞为永生化的人胚肾上皮细胞,由预防医学科学院曾毅院士惠赠):于25 cm2塑料培养瓶中接种5×105个细胞,用1640培养液培养24 h,细胞约为30%~50%汇合。用无血清、无双抗培养液轻洗单层细胞2遍。用Lipofetin reagent(Gibco公司产品)将质粒DNA转染入293细胞,传代于含200 μg/ml G418的选择培养液中(使未转染的293细胞全部死亡的G418浓度作为抗性质粒转染细胞的筛选浓度),直到抗性细胞克隆形成。挑取单个细胞克隆,用选择培养液扩增培养。
3.转染细胞中LMP1蛋白的检测:免疫组化染色。贴壁细胞经EDTA消化、收获,配成浓度为1×106/ml的细胞悬液,取0.1 ml滴加于无菌载玻片上,培养24 h后自然风干,冷丙酮固定。用EBV-LMP1单克隆抗体(CS1~4:由英国伯明翰大学肿瘤研究所姚庆云教授惠赠),按LSAB试剂盒(Dako公司产品)说明书操作。最后用2%甲基绿复染1 min。
, 百拇医药
4.软琼脂细胞集落形成试验:在六孔细胞培养中,每孔先加0.5%的下层琼脂3 ml(1.5 ml 1%的琼脂冷却至45℃左右,与1.5 ml 37 ℃预温的2×1640培养液混匀),冷至凝固后,加入0.33%的含5×104个细胞的顶层琼脂2 ml/孔,每种细胞均做复孔。置湿盒,37 ℃ CO2温箱培养及观察14天。
5.MTT试验:分别用105/ml的转染及未转染的293细胞悬液。接种于96孔细胞培养板,每孔100 μl,重复10孔,培养48 h后每孔加20 μl MTT(5 mg/ml,3-[4,5-Dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide,Sigma公司产品),继续培养4 h。吸弃培养液,加100 μl DMSO,稍加振荡后立即在酶标仪上测定570 nm、630 nm波长的OD值。求出每种细胞10个复孔的平均OD值,绘制直方图。
, http://www.100md.com
6.培养细胞中PCNA(增殖细胞核抗原)的检测:免疫组化染色。按LSAB试剂盒(Dako公司产品)说明书操作。最后用2%甲基绿复染1 min。
结 果
1.重组质粒转染293细胞抗性克隆的建立 重组质粒pcDNA3-(S)LMP1、pcDNA3-(B)LMP1及空白载体pcDNA3分别导入293细胞,经G418选择培养,10天后可见抗性细胞克隆出现,说明转染成功,转染后的293细胞分别命名为(S)LMP1-293、(B)LMP1-293及V-293细胞。
2.转染细胞中LMP1蛋白的表达 免疫组化染色显示,(S)LMP1-293、(B)LMP1-293细胞均呈阳性反应,LMP1主要分布于胞浆及膜上(见插页1图1),而V-293细胞及未转染293细胞均为阴性。
3.软琼脂集落形成能力 培养7天左右即可见LMP1基因转染细胞形成多个集落,至14天时集落明显增大,集落数目增多。而空载体转染及未转染细胞仅偶见个别较小集落,且在早期即停止生长。
, http://www.100md.com
4.MTT试验 由图1可见,LMP1基因转染细胞的MTT吸收值明显大于空载体转染及未转染细胞。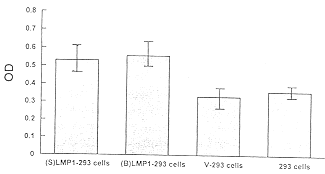
图1 MTT实验
5.培养细胞中PCNA的检测:对四种细胞的检测结果分别进行观察,每种细胞均在显微镜下随机选取10个视野进行计数,记录所计细胞总数及PCNA阳性细胞(附表,见插页1图2)。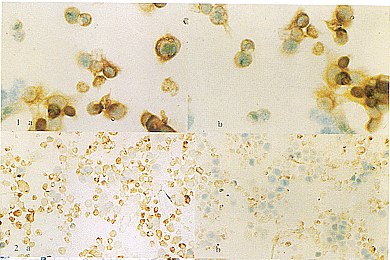
图1 LMP1转染细胞表达LMP1阳性(5×20)
A.(S)LMP1-293细胞 B.(B)LMP1-293细胞
图2 PCNA在培养细胞中的表达
, http://www.100md.com
A.(S)LMP1-293 B.V-293细胞
附表 培养细胞中PCNA表达的检测 细胞组
总细胞数
阳性细胞数
阳性率(%)
χ2检验*
(S)LMP1-293
3775
3021
80.0
P<0.01
, http://www.100md.com
(B)LMP1-293
3328
2612
78.5
P<0.01
V-293 cells
4213
2574
61.1
293 cells
3691
2301
, 百拇医药 62.3
*(S)LMP1-293、(B)LMP1-293分别与V-293及293 cells作卡方检验讨 论
尽管LMP1在NPC发生、发展中的作用已经受到学者的关注,但以往关于LMP1的研究资料大多来自于原型株B95-8细胞,而对NPC组织中LMP1的研究近年才有所报道。学者已经检测了来自中国上海的NPC细胞系CAO株[1]、来自台湾的NPC活检组织[8]、及来自非洲NPC的C15株[9]中LMP1基因序列、发现与B95-8细胞的EBV原型株相比,虽保留了原型株的基本结构,但均存在有一定的变异[1,3,8]。已经知道EBV在人群普遍易感且可终生携带,而NPC只发生于极少数人,并有明显的地域性,东南亚国家NPC的发病率比欧美国家提高100倍,且恶性程度较高。这种矛盾现象启发作者想到,是否由于某些特定地域或特定人群所感染的EBV-LMP1基因有所变异并导致其功能改变,从而促成这些地域或人群罹患NPC的危险性增加。因而作者对来自NPC高发区中国广东的NPC细胞系SUNE中的LMP1基因与原型株B95-8细胞中的LMP1基因在影响细胞生长增殖方面作了多项指标的比较。
, 百拇医药
作者发现,LMP1基因转染的上皮细胞呈现生长旺盛,失去接触抑制,在软琼脂中能够形成多个细胞集落。MTT实验结果表明LMP1基因转染后的细胞增殖功能增强。PCNA的检测结果表明,LMP1基因转染细胞的PCNA阳性率明显高于空载体转染及未转染细胞,显著性检验P<0.01。PCNA为一种核内蛋白质,它的出现明显与细胞增殖有关,且其量的变化与DNA合成相一致[11]。近年来,PCNA的免疫组织化学方法已被较成熟地用于研究细胞的增殖状态。
以上几项指标综合表明,(S)LMP1及(B)LMP1基因均能明显改变上皮细胞的生物学行为,促进细胞的生长、增殖和转化,使转染的上皮细胞获得肿瘤的生长特征。这两种不同来源的LMP1基因在体外对上皮细胞的转化功能似乎并无差别。为了比较这两种LMP1基因在有机体内的功能,作者已用(S)LMP1-293及(B)LMP1-293细胞分别接种10只裸鼠,发现(S)LMP1单独即可引起裸鼠成瘤(2/5),加上TPA处理可提高其致瘤能力(4/5),而(B)LMP1单独作用不能致瘤(0/5),但与TPA协同作用则可引起肿瘤(2/5)。瘤组织的免疫病理结果显示,瘤细胞的增殖状态及瘤体的生长活力与LMP1的表达水平有关(详细资料另文报道)。作者推测,尽管两种不同来源的LMP1在体外具有同等细胞转化能力,但进入动物体内后,不同来源的LMP1有可能因为其结构上的某些差异而造成它们在体内的表达情况不同,进而影响到它们致瘤能力的不同,这是值得深入研究的问题,它将有可能提示EBV的普遍感染与NPC的相对少发,以及NPC的地区性分布等矛盾现象的原因所在。本课题下一步的工作将对SUNE细胞中LMP1基因进行序列分析,以研究高发区NPC细胞中LMP1基因的结构特点,并探讨其与致瘤性的关系。
, 百拇医药
本课题受美国中华医学基金会资助,为博士学位论文部分工作
第一作者简介 陈宜芳,女,博士,讲师。
参 考 文 献
1 Hu LF,Eugene RZ,Fu C, et al. Isolation and sequencing of the Epstein-Barr virus BNLF-1 gene (LMP1) from a Chinese nasopharyngeal cancer.J Gen Virol,1991,72:2399
2 William EM,Rachel HE,Dennis MW, et al. Sequence variation in the Epstein-Barr virus latent membrane protein 1.J Gen Virol,1994,75:2729
, 百拇医药
3 苏玲,腾智平,赵全壁.高分化及低分化鼻咽癌细胞株中Epstein-Barr病毒潜伏感染膜蛋白(LMP1)基因的原位杂交与克隆及序列分析.病毒学报,1995,11:114
4 Wang F,Gregory C,Sample C,et al. Epstein-Barr virus latent membrane protein(LMP1) and nuclear proteins 2 and 3C are effectors of phenotypic changes in B lymphocytes:EBNA-2 and LMP1 cooperatively induce CD23.J Virol,1990,64:2309
5 Peng M,Lundgren E.Transient expression of the Epstein-Barr virus LMP1 gene in human primary B cells induces cellular activation and DNA synthesis.Oncogene,1992,7:1775
, 百拇医药
6 Wang D,Liebowitz D,Wang F, et al. Epstein-Barr virus latent infection membrane protein alters the human B-lymphocyte phenotype:deletion of the amino terminus abolishes activity J Virol,1988,62:6173
7 Baer R,Barkier AT,Biggin MD.DNA sequence and expression of the B95-8 Epstein-Barr virus genome.Nature,1984,310:207
8 Chen ML,Chi-Neu T,Chih-Lung L, et al. Cloning and characterization of the latent membrane protein(LMP) of a specific Epstein-Barr virus variant derived from the nasopharyngeal carcinoma in the Taiwanese population.Oncogene,1992,7:2131
, http://www.100md.com
9 Gilligan K,Sato H,Rajadurai P, et al. Novel transcription from the Epstein-Barr virus terminal Eco RI fragment,DIJhet,in a nasopharyngeal carcinoma.J Virol,1990,64:4948
10 Henderson S,Rowe M,Gregory C,et al. Induction of bcl-2 expression by Epstein-Barr virus latent membrane protein 1 protects infected B cells from programmed cell death.Cell,1991,65:1107
11 Olines DE,Olins AL,Caheiro LH, et al. Proliferating cell nuclear antigen/cyclin in the ciliate Euplotes eurystomus:localization in the replication band and in micronuclei.J Cell Biol,1989,109(4 Pt 1):1399
(收稿:1997-12-04 修回:1998-07-30), 百拇医药
单位:陈宜芳(中山医科大学孙逸仙纪念医院(广州510089);郭辉玉(中山医科大学微生物学教研室);汪慧民 李满枝(中山医科大学肿瘤研究所)
关键词:EB病毒;潜伏膜蛋白1;上皮细胞,增殖
肿瘤990105 目的 研究鼻咽癌细胞系SUNE中EBV-LMP1基因对上皮细胞增殖的影响,探索LMP1在鼻咽癌发生中所起的作用。 方法 用LMP1基因真核表达质粒转染人胚肾上皮细胞,检测LMP1的表达,观察细胞在软琼脂中的集落形成能力,MTT吸收能力以及PCNA的表达情况。 结果 被LMP1基因转染的细胞生长旺盛,能在软琼脂中形成多个集落,MTT吸收能力增强,PCNA的表达水平增高。 结论 LMP1基因能明显改变上皮细胞的生物学行为,促进细胞的生长、增殖和转化,使转染的上皮细胞获得肿瘤细胞的生长特征。
, 百拇医药
INFLUENCE OF EBV LATENT MEMBRANE PROTEIN 1 GENE
ISOLATED FROM HUMAN NASOPHARYNGEAL CARCINOMA
CELL LINE SUNE ON THE PROLIFERATION OF EPITHELIAL CELLS
Chen Yifang,Guo Huiyu,Wang Huimin, et al.
Sun Yat-sen University of Medical Sciences, Guangzhou 510120
Objective:To study the influence of EBV latent membrane protein1 (LMP1) gene isolated from nasopharyngeal carcinoma cell line SUNE on the proliferation of epithelial cells and the role of LMP1 in tumorigenesis of nasopharyngeal carcinoma.Methods:EBV LMP1 gene eukaryotic expression plasmid was transfected into human embryo kidney epithelial cell.The expression of LMP1 protein in transfected cells was detected.The formation of colonies in soft agar,the value of MTT absorbed and the expression of PCNA were observed.Results:The transfected cells grew vigorously and formed more colonies in soft agar,the MTT uptake and PCNA expression were apparently increased.Conclusion:LMP1 gene could alter the biological behavior of epithelial cells,promote cell growth,proliferation and transformation,and endow the transfected cells with growth characteristics like tumor cells.
, 百拇医药
Key words Epstien-Barr virus Latent membrane protein 1 Epithelial cell,proliferation
鼻咽癌(Nasopharyngeal carcinoma,NPC)与EB病毒(Epstein-Barr Virus,EBV)密切相关,各种类型的NPC组织均存在EBV DNA。EBV潜伏膜蛋白1(latent membrane protein 1,LMP1)是NPC组织中表达的唯一与细胞转化有关的蛋白[1],LMP1基因已被认为是病毒的一种癌基因。以往对LMP1的研究资料大多来自于EBV原型株B95-8细胞,近年来学者们开始关注NPC组织中的LMP1的研究,并已发现不同地域来源,不同分化程度的NPC组织中的LMP1基因结构与功能似乎存在一定差异[2,3]。中国广东为世界上NPC的最高发区,本校肿瘤研究所建立了来自广东患者的NPC体外传代细胞系SUNE,多项实验证明该细胞携带有EBV,作者从SUNE中扩增出EBV LMP1全基因,并以B95-8细胞中LMP1为对照,同时建立了该基因的真核表达质粒。关于EBV LMP1对B淋巴细胞的转化作用已有较多实验[4,6],但关于LMP1对上皮细胞的影响认识尚浅。NPC为上皮细胞来源的肿瘤,深入研究LMP1对上皮细胞的作用将更能贴近于探讨LMP1与NPC的关系。本文用LMP1基因真核表达质粒转染到人胚肾上皮细胞,观察LMP1基因对上皮细胞增殖的影响,旨在探索LMP1在NPC发生中所起的作用。
, http://www.100md.com
材料与方法
1.EBV-LMP1基因真核表达质粒pcDNA3-(S)LMP1及pcDNA3-(B)LMP1:由本室制备,根据Gene Bank公布的EBV基因序列[7],利用National Biosciences公司编制的Oligo引物分析软件电脑辅助设计一对引物,用长片段DNA PCR扩增试剂盒(ExpandTM High Fidelity PCR System,Boehringer Mannheim公司产品)分别从SUNE细胞及B95-8细胞DNA中扩增出LMP1全基因,长度约为3.4 kb,相当于EBV基因组上的位置为166,608 nt~170,033 nt,包括LMP1基因的上游调控序列,LMP1编码序列的三个外显子,两个内含子及下游polyA信号序列。先将该片段连接于pUC18载体的Bam HI位点,再定向亚克隆于真核细胞表达载体pcDNA3。由SUNE细胞及由B95-8细胞来源的LMP1基因所建立的真核表达质粒分别命名为pcDNA3-(S)LMP1及pcDNA3-(B)LMP1。
, 百拇医药
2.真核细胞表达质粒转染293细胞(293细胞为永生化的人胚肾上皮细胞,由预防医学科学院曾毅院士惠赠):于25 cm2塑料培养瓶中接种5×105个细胞,用1640培养液培养24 h,细胞约为30%~50%汇合。用无血清、无双抗培养液轻洗单层细胞2遍。用Lipofetin reagent(Gibco公司产品)将质粒DNA转染入293细胞,传代于含200 μg/ml G418的选择培养液中(使未转染的293细胞全部死亡的G418浓度作为抗性质粒转染细胞的筛选浓度),直到抗性细胞克隆形成。挑取单个细胞克隆,用选择培养液扩增培养。
3.转染细胞中LMP1蛋白的检测:免疫组化染色。贴壁细胞经EDTA消化、收获,配成浓度为1×106/ml的细胞悬液,取0.1 ml滴加于无菌载玻片上,培养24 h后自然风干,冷丙酮固定。用EBV-LMP1单克隆抗体(CS1~4:由英国伯明翰大学肿瘤研究所姚庆云教授惠赠),按LSAB试剂盒(Dako公司产品)说明书操作。最后用2%甲基绿复染1 min。
, 百拇医药
4.软琼脂细胞集落形成试验:在六孔细胞培养中,每孔先加0.5%的下层琼脂3 ml(1.5 ml 1%的琼脂冷却至45℃左右,与1.5 ml 37 ℃预温的2×1640培养液混匀),冷至凝固后,加入0.33%的含5×104个细胞的顶层琼脂2 ml/孔,每种细胞均做复孔。置湿盒,37 ℃ CO2温箱培养及观察14天。
5.MTT试验:分别用105/ml的转染及未转染的293细胞悬液。接种于96孔细胞培养板,每孔100 μl,重复10孔,培养48 h后每孔加20 μl MTT(5 mg/ml,3-[4,5-Dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide,Sigma公司产品),继续培养4 h。吸弃培养液,加100 μl DMSO,稍加振荡后立即在酶标仪上测定570 nm、630 nm波长的OD值。求出每种细胞10个复孔的平均OD值,绘制直方图。
, http://www.100md.com
6.培养细胞中PCNA(增殖细胞核抗原)的检测:免疫组化染色。按LSAB试剂盒(Dako公司产品)说明书操作。最后用2%甲基绿复染1 min。
结 果
1.重组质粒转染293细胞抗性克隆的建立 重组质粒pcDNA3-(S)LMP1、pcDNA3-(B)LMP1及空白载体pcDNA3分别导入293细胞,经G418选择培养,10天后可见抗性细胞克隆出现,说明转染成功,转染后的293细胞分别命名为(S)LMP1-293、(B)LMP1-293及V-293细胞。
2.转染细胞中LMP1蛋白的表达 免疫组化染色显示,(S)LMP1-293、(B)LMP1-293细胞均呈阳性反应,LMP1主要分布于胞浆及膜上(见插页1图1),而V-293细胞及未转染293细胞均为阴性。
3.软琼脂集落形成能力 培养7天左右即可见LMP1基因转染细胞形成多个集落,至14天时集落明显增大,集落数目增多。而空载体转染及未转染细胞仅偶见个别较小集落,且在早期即停止生长。
, http://www.100md.com
4.MTT试验 由图1可见,LMP1基因转染细胞的MTT吸收值明显大于空载体转染及未转染细胞。

图1 MTT实验
5.培养细胞中PCNA的检测:对四种细胞的检测结果分别进行观察,每种细胞均在显微镜下随机选取10个视野进行计数,记录所计细胞总数及PCNA阳性细胞(附表,见插页1图2)。

图1 LMP1转染细胞表达LMP1阳性(5×20)
A.(S)LMP1-293细胞 B.(B)LMP1-293细胞
图2 PCNA在培养细胞中的表达
, http://www.100md.com
A.(S)LMP1-293 B.V-293细胞
附表 培养细胞中PCNA表达的检测 细胞组
总细胞数
阳性细胞数
阳性率(%)
χ2检验*
(S)LMP1-293
3775
3021
80.0
P<0.01
, http://www.100md.com
(B)LMP1-293
3328
2612
78.5
P<0.01
V-293 cells
4213
2574
61.1
293 cells
3691
2301
, 百拇医药 62.3
*(S)LMP1-293、(B)LMP1-293分别与V-293及293 cells作卡方检验讨 论
尽管LMP1在NPC发生、发展中的作用已经受到学者的关注,但以往关于LMP1的研究资料大多来自于原型株B95-8细胞,而对NPC组织中LMP1的研究近年才有所报道。学者已经检测了来自中国上海的NPC细胞系CAO株[1]、来自台湾的NPC活检组织[8]、及来自非洲NPC的C15株[9]中LMP1基因序列、发现与B95-8细胞的EBV原型株相比,虽保留了原型株的基本结构,但均存在有一定的变异[1,3,8]。已经知道EBV在人群普遍易感且可终生携带,而NPC只发生于极少数人,并有明显的地域性,东南亚国家NPC的发病率比欧美国家提高100倍,且恶性程度较高。这种矛盾现象启发作者想到,是否由于某些特定地域或特定人群所感染的EBV-LMP1基因有所变异并导致其功能改变,从而促成这些地域或人群罹患NPC的危险性增加。因而作者对来自NPC高发区中国广东的NPC细胞系SUNE中的LMP1基因与原型株B95-8细胞中的LMP1基因在影响细胞生长增殖方面作了多项指标的比较。
, 百拇医药
作者发现,LMP1基因转染的上皮细胞呈现生长旺盛,失去接触抑制,在软琼脂中能够形成多个细胞集落。MTT实验结果表明LMP1基因转染后的细胞增殖功能增强。PCNA的检测结果表明,LMP1基因转染细胞的PCNA阳性率明显高于空载体转染及未转染细胞,显著性检验P<0.01。PCNA为一种核内蛋白质,它的出现明显与细胞增殖有关,且其量的变化与DNA合成相一致[11]。近年来,PCNA的免疫组织化学方法已被较成熟地用于研究细胞的增殖状态。
以上几项指标综合表明,(S)LMP1及(B)LMP1基因均能明显改变上皮细胞的生物学行为,促进细胞的生长、增殖和转化,使转染的上皮细胞获得肿瘤的生长特征。这两种不同来源的LMP1基因在体外对上皮细胞的转化功能似乎并无差别。为了比较这两种LMP1基因在有机体内的功能,作者已用(S)LMP1-293及(B)LMP1-293细胞分别接种10只裸鼠,发现(S)LMP1单独即可引起裸鼠成瘤(2/5),加上TPA处理可提高其致瘤能力(4/5),而(B)LMP1单独作用不能致瘤(0/5),但与TPA协同作用则可引起肿瘤(2/5)。瘤组织的免疫病理结果显示,瘤细胞的增殖状态及瘤体的生长活力与LMP1的表达水平有关(详细资料另文报道)。作者推测,尽管两种不同来源的LMP1在体外具有同等细胞转化能力,但进入动物体内后,不同来源的LMP1有可能因为其结构上的某些差异而造成它们在体内的表达情况不同,进而影响到它们致瘤能力的不同,这是值得深入研究的问题,它将有可能提示EBV的普遍感染与NPC的相对少发,以及NPC的地区性分布等矛盾现象的原因所在。本课题下一步的工作将对SUNE细胞中LMP1基因进行序列分析,以研究高发区NPC细胞中LMP1基因的结构特点,并探讨其与致瘤性的关系。
, 百拇医药
本课题受美国中华医学基金会资助,为博士学位论文部分工作
第一作者简介 陈宜芳,女,博士,讲师。
参 考 文 献
1 Hu LF,Eugene RZ,Fu C, et al. Isolation and sequencing of the Epstein-Barr virus BNLF-1 gene (LMP1) from a Chinese nasopharyngeal cancer.J Gen Virol,1991,72:2399
2 William EM,Rachel HE,Dennis MW, et al. Sequence variation in the Epstein-Barr virus latent membrane protein 1.J Gen Virol,1994,75:2729
, 百拇医药
3 苏玲,腾智平,赵全壁.高分化及低分化鼻咽癌细胞株中Epstein-Barr病毒潜伏感染膜蛋白(LMP1)基因的原位杂交与克隆及序列分析.病毒学报,1995,11:114
4 Wang F,Gregory C,Sample C,et al. Epstein-Barr virus latent membrane protein(LMP1) and nuclear proteins 2 and 3C are effectors of phenotypic changes in B lymphocytes:EBNA-2 and LMP1 cooperatively induce CD23.J Virol,1990,64:2309
5 Peng M,Lundgren E.Transient expression of the Epstein-Barr virus LMP1 gene in human primary B cells induces cellular activation and DNA synthesis.Oncogene,1992,7:1775
, 百拇医药
6 Wang D,Liebowitz D,Wang F, et al. Epstein-Barr virus latent infection membrane protein alters the human B-lymphocyte phenotype:deletion of the amino terminus abolishes activity J Virol,1988,62:6173
7 Baer R,Barkier AT,Biggin MD.DNA sequence and expression of the B95-8 Epstein-Barr virus genome.Nature,1984,310:207
8 Chen ML,Chi-Neu T,Chih-Lung L, et al. Cloning and characterization of the latent membrane protein(LMP) of a specific Epstein-Barr virus variant derived from the nasopharyngeal carcinoma in the Taiwanese population.Oncogene,1992,7:2131
, http://www.100md.com
9 Gilligan K,Sato H,Rajadurai P, et al. Novel transcription from the Epstein-Barr virus terminal Eco RI fragment,DIJhet,in a nasopharyngeal carcinoma.J Virol,1990,64:4948
10 Henderson S,Rowe M,Gregory C,et al. Induction of bcl-2 expression by Epstein-Barr virus latent membrane protein 1 protects infected B cells from programmed cell death.Cell,1991,65:1107
11 Olines DE,Olins AL,Caheiro LH, et al. Proliferating cell nuclear antigen/cyclin in the ciliate Euplotes eurystomus:localization in the replication band and in micronuclei.J Cell Biol,1989,109(4 Pt 1):1399
(收稿:1997-12-04 修回:1998-07-30), 百拇医药