川崎病患者外周血淋巴细胞凋亡降低及其机理的研究
作者:易岂建 李成荣 杨锡强 刘恩梅 王莉佳 张远维
单位:重庆医科大学儿童医院
关键词:川崎病;细胞凋亡;P53基因;IL-6
重庆医学990201 摘 要 为探讨外周血单个核细胞(PBMC)凋亡在川崎病(KD)发病中的作用。以正常儿童PBMC为对照,观察KD患者PBMC体外经anti-CD3刺激培养后的凋亡细胞百分率和片断DNA分析;测定PBMC体外PHA诱导培养产生IL-6水平,并利用流式细胞仪和斑点杂交检测外周血淋巴细胞P53基因表达水平。与正常对照比较,KD患者PBMC体外培养产生IL-6水平明显增高,凋亡细胞百分率降低(P<0.001),片断DNA出现时间延迟,外周血淋巴细胞P53mRNA及P53蛋白表达水平降低(P<0.005);当PBMC体外培养加入抗IL-6单抗时,IL-6水平显著降低,PBMC凋亡细胞百分率的降低及片断DNA梯度的延迟发生逆转,P53基因mRNA和P53蛋白水平提高。提示急性期KD患者PBMC凋亡产生延迟,其机理可能与本病患者异常升高的IL-6抑制外周淋巴细胞P53基因表达有关。
, http://www.100md.com
Study on the Mechanism of Inhibited Peripheral Blood Lymphocyte
Apoptosis in Children with Acute Kawasaki Disease
Children's Hospital,Chongqing University of Medical Sciences,Chongqing400014
Yi Qijan,Li Chengrong,Yang Siqiang,et al.
Abstract:To observe the role of peripheral blood lymphocyte apoptosis in the pathogenesis of Kawasaki disease(KD).Calculating percentage of apoptotic cells and assaying DNA fragmentation in peripheral blood mononuclear cell(PBMC)stimulated by anti-CD3 mAb for 0h,12h,24h,48h,72h in vitro from 30 KD patients and 20 age-matched healthychildren,measuring in vitro production of IL-6 by ELISA,defermining the expression of PBMC p53 gene mRNA and P53 protein using dot-blot and flow cytometry(FCM) were carried out.The results revealed that apoptotic cell percentage was markedly decreased(P<0.001) and DNA fragmentation delayed,compared with those in normal controls,which could reach the states of control group only by 72h culture,Remarkedely increased production of IL-6 in cultrued supernatant of PBMC induced by phytohemagglutinin(PHA)from KD patients was found,and the expression of PBMC p53 gene mRNA and P53 protein was decreased in KD patients.Adding anti-IL-6mAb to the culture led to significantly decreased production of Il-6(P<0.001),and reversed decreased apoptotic cell percentage and delayed DNA fragmentation,and the expression of PBMC p53 gene mRNA and P53 protein increased.The data suggeted that peripheral blood lymphocyte apoptosis was delayed in KD patient.It might be related to over-production of IL-6 which inhibites the expression of p53 gene.
, 百拇医药
Key words:Kawasaki disease Apoptosis p53 gene IL-6
川崎病(Kawasaki disease,KD)是一种原因不明的小儿急性弥漫性血管炎。本病呈自限性,有约20%的病人可伴发冠状动脉损害,如冠状动脉瘤,动脉扩张或狭窄,部分病人发生冠状动脉局部出血,心肌梗塞甚至猝死,目前认为本病是小儿后天性心脏病的主要原因之一,亦是成人冠状动脉疾病的高危因素[1]。以往的研究推测本病与感染、免疫功能失衡等多种因素有关,细胞凋亡是细胞生理性死亡的主要形式,对维持机体免疫功能稳定和免疫耐受极为重要,凋亡过度或不足都会引起免疫活性细胞数量失衡,导致临床疾病[2]。本研究首次证实急性期KD患者外周血单个核细胞(PBMC)体外存在凋亡产生延迟,并在此基础上进一步探讨其发生的基因调控机理。
材料及方法
一、材料
, 百拇医药
1.KD病人:30例住院患者,均符合日本MCLS研究会诊断标准,其中男17例,女13例,年龄8月~6.5岁(平均2.8±1.3岁)。
2.正常对照组:门诊体检健康儿童20例,其中男12例,女8例,年龄1~6.2岁(平均2.6±1.2岁)。
二、方法
1.细胞分离及培养:常规分离PBMC,用含10%小牛血清的RPMI-1640培养液调PBMC浓度至1×106/ml,置24孔培养板,加anti-CD3单抗(军事医学科学院,终浓度为100μg/ml),抗IL-6单抗(第四军医大学,终浓度为1∶1000),于37℃,5%CO2孵箱分别培养0h,24h,48h,72h。
2.流式细胞仪(FCM)检测PBMC细胞凋亡:采用碘化丙啶(PI)染色法[3]。
, 百拇医药
3.片断DNA梯度分析:按文献[4]方法处理培养PBMC,用RNaseA(20ug/ml,北京华美公司)去除RNA,1%琼脂糖凝胶电泳,紫外灯透照下观察片断DNA梯度并照相记录。
4.IL-6测定:无菌收集各种条件PBMC经PHA(20ug/ml,广州医药工业研究所)刺激48小时后培养上清,按试剂盒(第四军医大学产品)说明书操作。
5.探针标记:P质粒由美国华盛顿大学Dr Riddle赠送。经转化、扩增、提取后,XbaI和SmaI酶切获得目的片断,按Dig标记试剂盒(德国宝灵曼公司产品)说明书进行探针标记。
6.斑点杂交检测P53基因mRNA表达:按文献[5]方法,RNA样品加变性液处理后,采用加样器点样法点于预先用ddH2O和20×SSC浸湿的硝酸纤维素滤膜(德国宝灵曼公司产品)上,RNA杂交浓度为200ug/ml,80℃烤膜2小时,预杂交和杂交时间分别为6小时和24小时,根据斑点的有无和显色强弱,判断P53基因mRNA的相对表达强度。
, 百拇医药
7.FCM检测P53阳性细胞百分率:PBMC经洗涤,固定等处理后加抗P53单抗(1ug/ml,德国宝灵曼公司)200ul,室温下孵育60分钟,加羊抗鼠IgG-FITC(1∶50),室温下孵育30分钟,移入FCM测试管,检测10000个细胞中P53阳性细胞百分率。
8.细胞总RNA提取及电泳:用TRIZOLTMKit(Gibico,USA)抽提,甲醛变性凝胶电泳检测RNA抽提效果。
结 果
一、KD患者PBMC凋亡出现延迟:PI染色后,经FCM检测结果显示,KD患者PBMC凋亡发生明显延迟(图1)。其中培养24h,48h后,KD患者PBMC凋亡细胞百分率(分别为10.89±3.61和18.67±5.68)较正常对照组(分别为21.48±3.41和31.48±4.46)明显降低,两组比较差异显著(P均<0.001)。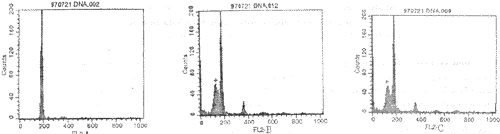
, 百拇医药
图1 流式细胞仪检测PBMC发生凋亡示意图
注:A,KD组;B,正常组(+);C,加抗IL-6单抗培养组(+)
当KD患者PBMC加入抗IL-6单抗培养,凋亡发生率(24h,48h分别为20.83±7.98,29.33±8.19)显著增高,接近正常水平。
二、片断DNA梯度分析:正常儿童PBMC经anti-CD3单抗刺激培养24小时可见DNA片断化倾向,并随时间延长而明显;KD患者PBMC需72小时才有微量DNA片断,加入抗IL-6单抗培养,DNA片断化明显提前(图2)。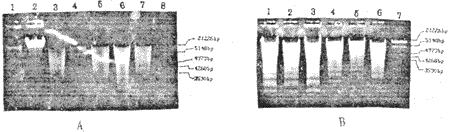
图2 片断DNA梯度分析
注:A.1,2,3,分别为KD病人PBMC培养0h,24h,48h;4,5,6,7,分别为正常儿童PBMC培养0h,24h,48h,72h;8,为Marker(EcoRI/HIndIII):B.1,2,3和4,5,6分别为KD病人一、病人二PBMC抗IL-6单抗培养24h,48h,72h;7为Marker。
, 百拇医药
三、IL-6水平:KD患者PBMC体外经PHA刺激产生IL-6水平(为374.8±162.1pg/ml)较正常对照组(为103.4+96.7pg/ml)高(P<0.001),当KD患者PBMC体外培养加入抗IL-6单抗,其上清IL-6水平(46.8±12.7pg/ml)极低,与无抗IL-6单抗组相比较,差异显著(P<0.001)。
四、P53基因mRNA及蛋白质表达水平:
RNA斑点杂交显示,KD患者PBMC体外经anti-CD3单抗刺激培养,P53mRNA表达水平降低,加入抗IL-6单抗培养,P53mRNA表达水平明显提高(图3)。
图3 RNA斑点杂交检测p53mRNA表达示意图
, 百拇医药
注:1,KD组;2,正常组;3,4分别为KD病例一、二PBMC加抗IL-6单抗培养
KD患者外周淋巴细胞P53蛋白阳性细胞百分率(98.1±21.7)较正常对照组(305.7±153.8)明显降低(t=5.028,P<0.001);PBMC体外培养加入抗IL-6单抗,P53蛋白阳性细胞百分率(298.1±136.8)显著增高(t=5.019,P<0.001)(图4)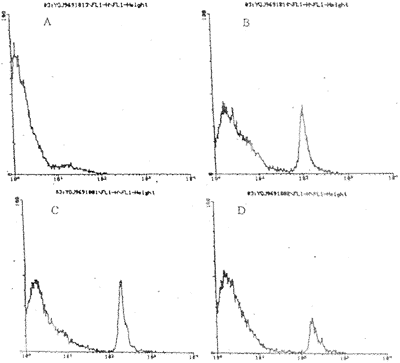
图4 流式细胞仪检测P53蛋白表达示意图
注:A,KD组;B,正常组(+);C,D分别为KD病例一、二PBMC加抗IL-6单抗培养(+)
讨 论
, http://www.100md.com
凋亡是受遗传基因控制的细胞主动死亡过程。机体细胞增殖和死亡过程达到动态平衡是维持自身恒定的必要条件,凋亡过度或不足都会引起细胞数量失衡,导致临床疾病。近年研究发生凋亡减少可能与某些自身免疫性疾病的发生有关[6]。
本组研究发现正常儿童PBMC体外anti-CD3单抗刺激培养24小时出现凋亡细胞形态改变和DNA片断化,与Wesselborg[7]的结果一致。KD患者PBMC培养72小时凋亡细胞百分率和DNA片断化才接近正常水平,表明KD患者存在有淋巴细胞凋亡产生延迟。淋巴细胞凋亡是免疫系统通过克隆清除维持自身免疫耐受的重要机制之一。本文结果提示KD患者淋巴细胞凋亡产生延迟可能参与本病自身免疫反应及发病。
IL-6与淋巴细胞凋亡的关系近来颇引人注目。刘佳[8]发现IL-6可抑制小鼠(B杂交瘤)7TD1细胞凋亡。本研究通过PBMC体外培养加入抗IL-6单抗培养时PBMC产生IL-6水平明显降低,凋亡细胞百分率增高,片断DNA梯度出现时间提前,据此推测KD患者外周血淋巴细胞凋亡延迟可能与异常增高的IL-6有关。
, 百拇医药
最近的研究揭示凋亡至少有两条途径,P53依赖性凋亡和P53非依赖性凋亡。P53是重要的抑癌基因,野生型P53是损伤后细胞凋亡不可缺少的信号[9]。文献[10]报道IL-6可抑制野生型P53表达和P53诱导的骨髓白血病细胞的凋亡。本组KD患者PBMC体外anti-CD3单抗刺激培养,P53基因mRNA和P53蛋白表达水平均较正常对照低,当加入抗IL-6单抗培养时,P53基因mRNA和P53蛋白表达水平提高。表明本病异常增高的IL-6对外周淋巴细胞P53基因表达有抑制作用。因此推测KD患者异常增高的IL-6通过抑制外周血淋巴细胞P53基因表达而导致淋巴细胞凋亡延迟,使活化的免疫细胞持续存活,产生更多炎症性介质,形成恶性循环,诱发和加重血管内皮损伤,同时免疫耐受遭到破坏,从而参与KD的发病。
, 百拇医药
参考文献
1 Pietra BA,De Inocercio J,Giamrini EH,et al.TCR V beta family repertoire and T cell activation markers in kawasaki disease.J Immunol,1994,153∶1881~1888
2 石运伯,石若翔,时玉舫.细胞凋亡的分子机理.生命科学,1996,8(3):8~14
3 Nicoletti I,Migliorati G,Pagliacci MC,et al.A rapid and simpie method for measuring thymocyte apoptosis by propidium iodide staining and flow cytomerty.J Immunol Methods,1991,139∶272~279
, http://www.100md.com
4 Nigtorati G,Nicoletti I,Crocicchio F,et al.Heat shock induces apoptosis in mouse thymocytes and protects them from glucocorticoid induced cell death.Cellular Immuno,1992,143∶348~358
5 Sanbrokk J,Fritsch EF and Maniatis T. Moleculat Cloning.A Laboratory Manual,2eds,Cold Spring Harbor Lab press,1989,362~373
6 Wu JG,Zhou T,ZHqng JJ,et al.Correction of accelerated autoimmune disease by early replacement of the mutated lpr gene with the normalfas apoptosis gene in the T cells of trangenic MRL-lpr/lpr mice.Proc Natl Acad Sci USA,1994,91∶2344~2356
, http://www.100md.com
7 Wesselborg S,Janssen D and Kabelitz D. Iduction of activation driven death(apoptosis)in actvated but not resting peripheral blood T cells.J Immunol,1993,150∶4338~4352
8 刘佳,李宏,Hamou MF等.IL-6对小鼠(B杂交瘤)7TD1细胞凋亡的调控作用.中华微生物学和免疫学杂志,1995,15∶382~386
9 Sai jun F.p53 gene mutations are associated with decreased sensitivity of human lymphocyte to DNA damaging agents.Cancer Res,1994,54∶5824~5839
10 Yonish-Rouach E,Resnitzky D,Lotern J,et al.Wild-type p53 induces apoptosis of myeloid leukaemic cells that is inhibited by interleukin-6.Nature,1991,352∶345~349, 百拇医药
单位:重庆医科大学儿童医院
关键词:川崎病;细胞凋亡;P53基因;IL-6
重庆医学990201 摘 要 为探讨外周血单个核细胞(PBMC)凋亡在川崎病(KD)发病中的作用。以正常儿童PBMC为对照,观察KD患者PBMC体外经anti-CD3刺激培养后的凋亡细胞百分率和片断DNA分析;测定PBMC体外PHA诱导培养产生IL-6水平,并利用流式细胞仪和斑点杂交检测外周血淋巴细胞P53基因表达水平。与正常对照比较,KD患者PBMC体外培养产生IL-6水平明显增高,凋亡细胞百分率降低(P<0.001),片断DNA出现时间延迟,外周血淋巴细胞P53mRNA及P53蛋白表达水平降低(P<0.005);当PBMC体外培养加入抗IL-6单抗时,IL-6水平显著降低,PBMC凋亡细胞百分率的降低及片断DNA梯度的延迟发生逆转,P53基因mRNA和P53蛋白水平提高。提示急性期KD患者PBMC凋亡产生延迟,其机理可能与本病患者异常升高的IL-6抑制外周淋巴细胞P53基因表达有关。
, http://www.100md.com
Study on the Mechanism of Inhibited Peripheral Blood Lymphocyte
Apoptosis in Children with Acute Kawasaki Disease
Children's Hospital,Chongqing University of Medical Sciences,Chongqing400014
Yi Qijan,Li Chengrong,Yang Siqiang,et al.
Abstract:To observe the role of peripheral blood lymphocyte apoptosis in the pathogenesis of Kawasaki disease(KD).Calculating percentage of apoptotic cells and assaying DNA fragmentation in peripheral blood mononuclear cell(PBMC)stimulated by anti-CD3 mAb for 0h,12h,24h,48h,72h in vitro from 30 KD patients and 20 age-matched healthychildren,measuring in vitro production of IL-6 by ELISA,defermining the expression of PBMC p53 gene mRNA and P53 protein using dot-blot and flow cytometry(FCM) were carried out.The results revealed that apoptotic cell percentage was markedly decreased(P<0.001) and DNA fragmentation delayed,compared with those in normal controls,which could reach the states of control group only by 72h culture,Remarkedely increased production of IL-6 in cultrued supernatant of PBMC induced by phytohemagglutinin(PHA)from KD patients was found,and the expression of PBMC p53 gene mRNA and P53 protein was decreased in KD patients.Adding anti-IL-6mAb to the culture led to significantly decreased production of Il-6(P<0.001),and reversed decreased apoptotic cell percentage and delayed DNA fragmentation,and the expression of PBMC p53 gene mRNA and P53 protein increased.The data suggeted that peripheral blood lymphocyte apoptosis was delayed in KD patient.It might be related to over-production of IL-6 which inhibites the expression of p53 gene.
, 百拇医药
Key words:Kawasaki disease Apoptosis p53 gene IL-6
川崎病(Kawasaki disease,KD)是一种原因不明的小儿急性弥漫性血管炎。本病呈自限性,有约20%的病人可伴发冠状动脉损害,如冠状动脉瘤,动脉扩张或狭窄,部分病人发生冠状动脉局部出血,心肌梗塞甚至猝死,目前认为本病是小儿后天性心脏病的主要原因之一,亦是成人冠状动脉疾病的高危因素[1]。以往的研究推测本病与感染、免疫功能失衡等多种因素有关,细胞凋亡是细胞生理性死亡的主要形式,对维持机体免疫功能稳定和免疫耐受极为重要,凋亡过度或不足都会引起免疫活性细胞数量失衡,导致临床疾病[2]。本研究首次证实急性期KD患者外周血单个核细胞(PBMC)体外存在凋亡产生延迟,并在此基础上进一步探讨其发生的基因调控机理。
材料及方法
一、材料
, 百拇医药
1.KD病人:30例住院患者,均符合日本MCLS研究会诊断标准,其中男17例,女13例,年龄8月~6.5岁(平均2.8±1.3岁)。
2.正常对照组:门诊体检健康儿童20例,其中男12例,女8例,年龄1~6.2岁(平均2.6±1.2岁)。
二、方法
1.细胞分离及培养:常规分离PBMC,用含10%小牛血清的RPMI-1640培养液调PBMC浓度至1×106/ml,置24孔培养板,加anti-CD3单抗(军事医学科学院,终浓度为100μg/ml),抗IL-6单抗(第四军医大学,终浓度为1∶1000),于37℃,5%CO2孵箱分别培养0h,24h,48h,72h。
2.流式细胞仪(FCM)检测PBMC细胞凋亡:采用碘化丙啶(PI)染色法[3]。
, 百拇医药
3.片断DNA梯度分析:按文献[4]方法处理培养PBMC,用RNaseA(20ug/ml,北京华美公司)去除RNA,1%琼脂糖凝胶电泳,紫外灯透照下观察片断DNA梯度并照相记录。
4.IL-6测定:无菌收集各种条件PBMC经PHA(20ug/ml,广州医药工业研究所)刺激48小时后培养上清,按试剂盒(第四军医大学产品)说明书操作。
5.探针标记:P质粒由美国华盛顿大学Dr Riddle赠送。经转化、扩增、提取后,XbaI和SmaI酶切获得目的片断,按Dig标记试剂盒(德国宝灵曼公司产品)说明书进行探针标记。
6.斑点杂交检测P53基因mRNA表达:按文献[5]方法,RNA样品加变性液处理后,采用加样器点样法点于预先用ddH2O和20×SSC浸湿的硝酸纤维素滤膜(德国宝灵曼公司产品)上,RNA杂交浓度为200ug/ml,80℃烤膜2小时,预杂交和杂交时间分别为6小时和24小时,根据斑点的有无和显色强弱,判断P53基因mRNA的相对表达强度。
, 百拇医药
7.FCM检测P53阳性细胞百分率:PBMC经洗涤,固定等处理后加抗P53单抗(1ug/ml,德国宝灵曼公司)200ul,室温下孵育60分钟,加羊抗鼠IgG-FITC(1∶50),室温下孵育30分钟,移入FCM测试管,检测10000个细胞中P53阳性细胞百分率。
8.细胞总RNA提取及电泳:用TRIZOLTMKit(Gibico,USA)抽提,甲醛变性凝胶电泳检测RNA抽提效果。
结 果
一、KD患者PBMC凋亡出现延迟:PI染色后,经FCM检测结果显示,KD患者PBMC凋亡发生明显延迟(图1)。其中培养24h,48h后,KD患者PBMC凋亡细胞百分率(分别为10.89±3.61和18.67±5.68)较正常对照组(分别为21.48±3.41和31.48±4.46)明显降低,两组比较差异显著(P均<0.001)。

, 百拇医药
图1 流式细胞仪检测PBMC发生凋亡示意图
注:A,KD组;B,正常组(+);C,加抗IL-6单抗培养组(+)
当KD患者PBMC加入抗IL-6单抗培养,凋亡发生率(24h,48h分别为20.83±7.98,29.33±8.19)显著增高,接近正常水平。
二、片断DNA梯度分析:正常儿童PBMC经anti-CD3单抗刺激培养24小时可见DNA片断化倾向,并随时间延长而明显;KD患者PBMC需72小时才有微量DNA片断,加入抗IL-6单抗培养,DNA片断化明显提前(图2)。

图2 片断DNA梯度分析
注:A.1,2,3,分别为KD病人PBMC培养0h,24h,48h;4,5,6,7,分别为正常儿童PBMC培养0h,24h,48h,72h;8,为Marker(EcoRI/HIndIII):B.1,2,3和4,5,6分别为KD病人一、病人二PBMC抗IL-6单抗培养24h,48h,72h;7为Marker。
, 百拇医药
三、IL-6水平:KD患者PBMC体外经PHA刺激产生IL-6水平(为374.8±162.1pg/ml)较正常对照组(为103.4+96.7pg/ml)高(P<0.001),当KD患者PBMC体外培养加入抗IL-6单抗,其上清IL-6水平(46.8±12.7pg/ml)极低,与无抗IL-6单抗组相比较,差异显著(P<0.001)。
四、P53基因mRNA及蛋白质表达水平:
RNA斑点杂交显示,KD患者PBMC体外经anti-CD3单抗刺激培养,P53mRNA表达水平降低,加入抗IL-6单抗培养,P53mRNA表达水平明显提高(图3)。

图3 RNA斑点杂交检测p53mRNA表达示意图
, 百拇医药
注:1,KD组;2,正常组;3,4分别为KD病例一、二PBMC加抗IL-6单抗培养
KD患者外周淋巴细胞P53蛋白阳性细胞百分率(98.1±21.7)较正常对照组(305.7±153.8)明显降低(t=5.028,P<0.001);PBMC体外培养加入抗IL-6单抗,P53蛋白阳性细胞百分率(298.1±136.8)显著增高(t=5.019,P<0.001)(图4)

图4 流式细胞仪检测P53蛋白表达示意图
注:A,KD组;B,正常组(+);C,D分别为KD病例一、二PBMC加抗IL-6单抗培养(+)
讨 论
, http://www.100md.com
凋亡是受遗传基因控制的细胞主动死亡过程。机体细胞增殖和死亡过程达到动态平衡是维持自身恒定的必要条件,凋亡过度或不足都会引起细胞数量失衡,导致临床疾病。近年研究发生凋亡减少可能与某些自身免疫性疾病的发生有关[6]。
本组研究发现正常儿童PBMC体外anti-CD3单抗刺激培养24小时出现凋亡细胞形态改变和DNA片断化,与Wesselborg[7]的结果一致。KD患者PBMC培养72小时凋亡细胞百分率和DNA片断化才接近正常水平,表明KD患者存在有淋巴细胞凋亡产生延迟。淋巴细胞凋亡是免疫系统通过克隆清除维持自身免疫耐受的重要机制之一。本文结果提示KD患者淋巴细胞凋亡产生延迟可能参与本病自身免疫反应及发病。
IL-6与淋巴细胞凋亡的关系近来颇引人注目。刘佳[8]发现IL-6可抑制小鼠(B杂交瘤)7TD1细胞凋亡。本研究通过PBMC体外培养加入抗IL-6单抗培养时PBMC产生IL-6水平明显降低,凋亡细胞百分率增高,片断DNA梯度出现时间提前,据此推测KD患者外周血淋巴细胞凋亡延迟可能与异常增高的IL-6有关。
, 百拇医药
最近的研究揭示凋亡至少有两条途径,P53依赖性凋亡和P53非依赖性凋亡。P53是重要的抑癌基因,野生型P53是损伤后细胞凋亡不可缺少的信号[9]。文献[10]报道IL-6可抑制野生型P53表达和P53诱导的骨髓白血病细胞的凋亡。本组KD患者PBMC体外anti-CD3单抗刺激培养,P53基因mRNA和P53蛋白表达水平均较正常对照低,当加入抗IL-6单抗培养时,P53基因mRNA和P53蛋白表达水平提高。表明本病异常增高的IL-6对外周淋巴细胞P53基因表达有抑制作用。因此推测KD患者异常增高的IL-6通过抑制外周血淋巴细胞P53基因表达而导致淋巴细胞凋亡延迟,使活化的免疫细胞持续存活,产生更多炎症性介质,形成恶性循环,诱发和加重血管内皮损伤,同时免疫耐受遭到破坏,从而参与KD的发病。
, 百拇医药
参考文献
1 Pietra BA,De Inocercio J,Giamrini EH,et al.TCR V beta family repertoire and T cell activation markers in kawasaki disease.J Immunol,1994,153∶1881~1888
2 石运伯,石若翔,时玉舫.细胞凋亡的分子机理.生命科学,1996,8(3):8~14
3 Nicoletti I,Migliorati G,Pagliacci MC,et al.A rapid and simpie method for measuring thymocyte apoptosis by propidium iodide staining and flow cytomerty.J Immunol Methods,1991,139∶272~279
, http://www.100md.com
4 Nigtorati G,Nicoletti I,Crocicchio F,et al.Heat shock induces apoptosis in mouse thymocytes and protects them from glucocorticoid induced cell death.Cellular Immuno,1992,143∶348~358
5 Sanbrokk J,Fritsch EF and Maniatis T. Moleculat Cloning.A Laboratory Manual,2eds,Cold Spring Harbor Lab press,1989,362~373
6 Wu JG,Zhou T,ZHqng JJ,et al.Correction of accelerated autoimmune disease by early replacement of the mutated lpr gene with the normalfas apoptosis gene in the T cells of trangenic MRL-lpr/lpr mice.Proc Natl Acad Sci USA,1994,91∶2344~2356
, http://www.100md.com
7 Wesselborg S,Janssen D and Kabelitz D. Iduction of activation driven death(apoptosis)in actvated but not resting peripheral blood T cells.J Immunol,1993,150∶4338~4352
8 刘佳,李宏,Hamou MF等.IL-6对小鼠(B杂交瘤)7TD1细胞凋亡的调控作用.中华微生物学和免疫学杂志,1995,15∶382~386
9 Sai jun F.p53 gene mutations are associated with decreased sensitivity of human lymphocyte to DNA damaging agents.Cancer Res,1994,54∶5824~5839
10 Yonish-Rouach E,Resnitzky D,Lotern J,et al.Wild-type p53 induces apoptosis of myeloid leukaemic cells that is inhibited by interleukin-6.Nature,1991,352∶345~349, 百拇医药