应用亲和层析分离纯化人小脑乙酰胆碱酯酶的初步研究
作者:张兴梅 石玉生 张 翰
单位:第一军医大学1生化教研室,南方医院放疗科,广州,510515;军事医学科学院毒物药物研究所,北京,100850
关键词:免疫亲和层析;小脑;乙酰胆碱酯酶;交叉免疫反应性
摘要摘要:目的 分离纯化人小脑乙酰胆碱酯酶 (AChE)。材料和方法 采用ConA和B10亲和层析法纯化人小脑AChE。以纯化的人小脑AChE为免疫原,免疫6只BALB/c小鼠制备小鼠抗人小脑AChE抗血清,并检测其与电鳐AChE和人红细胞膜AChE的交叉免疫反应性。结果 SDS-PAGE还原状态下呈一条主带,相对分子质量为67 000,比活性为373 U/mg。结论 免疫亲和层析法操作简单,可快速纯化人小脑AChE。
中图分类号:Q556; R392
, 百拇医药
A preliminary study of the purification acetylcholinesterase from human cerebellum by immuno-affinity chromatography
Zhang Xingmei1, Shi Yusheng2, Zhang Han3
1Department of Biochemistry, Department of Radiotherapy of 2Nanfang Hospital, First Military Medical University, Guangzhou, 510515;3 Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing ,100850Abstract: Objective To purify acetylcholinesterase (AChE) from human cerebellum. Materials and Methods By using ConA and B10 Sepharose affinity chromatographies to purify AChE. To prepare the mouse anti-human brain AChE antiserum, six BALB/c mice were immunized with the purified human cerebellum AChE. The cross-immunoreactivities of the antiserum with Torpedo AChE and human RBC membrane AChE were also detected. Results SDS-PAGE of the purified AChE which had a specific activity of 373 U/mg under reduced condition showed one main band corresponding to a molecular weight of 67 000. Conclusion Immuno-affinity chromatography is very simple and can be used to purify AChE from human cerebellum quickly.
, 百拇医药
Key words: immuno-affinity chromatography; cerebellum; acetylcholinesterase; cross-immunoreactivity
乙酰胆碱酯酶(AChE, EC 3.1.1.7)广泛分布于人的神经组织,其主要功能是催化胆碱能神经末梢释放的乙酰胆碱的水解,维持正常的神经活动。因此,AChE的生化研究受到广泛的重视。人脑组织中AChE含量很低,所以分离纯化较困难。Sorensen等[1]1982年首次纯化了人脑尾状核AChE,Rakonczay等[2]1988年纯化了人小脑AChE,并制备了三株单克隆抗体。国内朱美财等[3]报道了用含特异亲和配基的亲和层析柱来纯化人脑AChE,但其合成带有特异亲和配基的凝胶的方法很复杂。我们尝试应用B10抗人脑AChE单克隆抗体[4]制备的免疫亲和层析柱来分离纯化人小脑AChE。
, 百拇医药
1 材料和方法
1.1材料 人脑组织取自意外死亡的正常成年人(24 h内取材),-20℃保存;微型紫外记录仪为日本ATTO公司产品;纯化B10抗人脑AChE单克隆抗体的浓度为2 g/L,抗体滴度1:48 000,由军事医学科学院六所五室提供;人脑AChE标准样品、电鳐AChE和人红细胞膜AChE均达电泳纯,空军总医院朱美财教授惠赠;BALB/c小鼠购自军事医学科学院动物中心;ConA-Sepharose4B为Sigma公司产品;CNBr活化的Sepharose4B购自Pharmacia公司;其余试剂为国产分析纯。
1.2 B10免疫亲和层析柱的制备[5] 将纯化B10抗人脑AChE单克隆抗体与一定量的湿润膨胀及洗涤后的CNBr-Sepharose 4B混合,过夜。次日去上清,加入1 mol/L乙醇胺(pH 9.0)阻断未与单抗结合的活性集团,再用5~10倍0.1 mol/L磷酸钠缓冲液(pH 8.0)及0.1 mol/L乙酸缓冲液(pH 5.0)洗涤,去除未与载体结合的单抗。缓慢自然沉降法装柱,用0.1 mol/L磷酸钠缓冲液(pH 8.0)平衡。
, 百拇医药
1.3 人小脑AChE的分离纯化 取人小脑270 g,去除大的血管组织,剪碎,按1: 3(w/v)加入20 mmol/L Tris- HCl (pH 7.4)- 0.15 mol/L NaCl 溶液,1 min ´ 5次慢速捣碎成匀浆,加10 % Triton X-100至匀浆中使其终浓度为1 %,4 ℃搅拌4 h,超速离心取上清液。首先将ConA-Sepharose 4B柱(柱床100 ml)预先用缓冲液20 mmol/L Tris- HCl (pH 7.4)- 0.15 mol/L NaCl-0.1 %Triton X-100平衡。样品上柱后以平衡缓冲液洗脱杂蛋白,用含0.5 mol/L a -甲基-D-甘露糖苷的平衡缓冲液洗脱被吸附的AChE。将得到的洗脱液上预先用0.1 mol/L磷酸钠缓冲液(pH 8.0)平衡好的B10亲和层析柱(柱床16 ml,每ml凝胶结合5 mg的单抗),4℃过夜,平衡液洗脱杂蛋白,0.1 mol/L乙酸-0.15 mol/L NaCl 洗脱吸附于亲和层析柱的AChE,流速为10 ml/h,紫外280 nm检测,按峰收集。洗脱出的液体立即以1 mol/L Tris-HCl(pH 8.5)中和至中性,经超滤浓缩得纯化样品。蛋白质浓度测定采用Lowry’s法[6],酶活性测定采用DTNB法[7]。
, 百拇医药
1.4 纯化样品的SDS-PAGE电泳鉴定 按Laemmli法[8]进行垂直板电泳,浓缩胶4%,分离胶10 %。用银染法进行蛋白质的染色。
1.5 抗血清的制备及与各种AChE的反应 将纯化的人小脑AChE与等量的完全福氏佐剂混合后,免疫6只BALB/c小鼠,每次每只30 m g,经2~3个月4次加强注射后,取血清。抗原抗体反应的间接ELISA检测:各种AChE(人脑AChE标准样品、电鳐AChE和人红细胞膜AChE)经稀释至浓度为1.6 mg/L,每孔100 m l加至聚苯乙烯微孔板,4 ℃过夜,加入1 %BSA封闭,冲洗后加入不同稀释度的小鼠抗人小脑AChE抗血清100 m l/孔,37℃孵温1 h,冲洗后再加入辣根过氧化物酶标羊抗鼠抗体。底物液为OPD,终止液为2 mol/L H2SO4,用酶标仪在490 nm处测定Dλ值。
2 结果
, 百拇医药
纯化的人小脑AChE的比活性为373 U/mg,标准品的比活性为1 900 U/mg,SDS-PAGE电泳显示在还原状态下呈一条主带,相对分子质量为 67 000(图1)。每200 g人小脑组织可获得纯化样品约0.1 mg。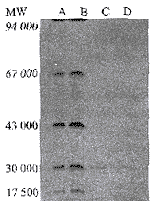
图1 纯化的人小脑AchE的SDS-PAGE图
Fig. 1 SDS-PAGE of purified human cerebellum AChE
A. purified AChE from human cerebellum; B. standard sample of human brain AChE; C~D. molecular weight standards
, 百拇医药
人小脑AChE免疫BALB/c小鼠产生的抗血清,以ELISA检测抗体的滴度可达1:12 000。小鼠抗人小脑AChE抗血清与电鳐AChE有较强的交叉免疫反应,而与人红细胞膜AChE的反应很弱(表 1)。
表1 小鼠抗人脑AChE抗血清和不同抗原的ELISA反应
Tab.1 ELISA of mouse anti-human brain AChE antiserum with various antigens
Antigen
Antiserum
Normal Serum
1:1500
, 百拇医药
1:3000
1:6000
1:12000
1:1500
Human brain AChE
1.348± 0.128
0.947± 0.181
0.527± 0.218
0.227± 0.021
0.092± 0.016
Human RBC AChE
, 百拇医药
0.083± 0.013
0.069± 0.010
0.029± 0.020
0.016± 0.010
0.013± 0.009
Torpedo AChE
0.834± 0.115
0.672± 0.121
0.438± 0.111
0.259± 0.024
0.060± 0.016
, http://www.100md.com
n=3, ±SD,absorbance at 492nm;Titer is the reciprocal of dilution
±SD,absorbance at 492nm;Titer is the reciprocal of dilution
3 讨论
免疫亲和纯化是蛋白质分离最有效的技术之一,它可快速纯化抗原,亲和柱可重复使用,同时可制备纯化的抗原。本实验采用B10抗人脑AChE单克隆抗体制备的免疫亲和层析柱来进行人小脑AChE的分离纯化。人脑AChE是一种糖蛋白,为了增加AChE活性回收率,首先经ConA亲和层析柱可去除一些竞争性干扰物质[3]。所得纯化样品达电泳纯,具有很强的抗原性,但酶的比活性较低,这可能有以下几个原因:首先,亲和层析苛刻的洗脱条件使酶容易变性;而且制备亲和层析柱时的抗体和抗原的亲和力是免疫亲和纯化中的主要问题;另外不同的层析条件,所使用的溶剂等因素也可使酶有不同程度的变性。总之,本法的优点是可快速纯化人脑AChE,亲和凝胶柱的制备简单,成本较低,所得样品纯度较高,具有很高的抗原性,但样品的酶活性较低,所以此法可适用于人脑AChE的抗体制备及其免疫学检测等研究。
, 百拇医药
不同种属的AChE分子的一级结构不同,但其有部分的同源性。利用小鼠抗人小脑AChE抗血清与各种AChE进行的抗原抗体反应的结果表明,人脑AChE与电鳐AChE有共同保守的抗原决定簇,这与文献报道一致[3]。
参考文献
Sorensen K, Gentinetta R, Brodbeck U. An amphiphile dependent form of human brain caudate nucleus acetylcholinesterase: purification and properties. J Neurochem, 1982, 399(9): 1050Rakonczay Z, Brimijoin S. Monoclonal antibodies to human brain acetylcholinesterase: properties and applications. Cell Mol Neurobiol, 1988, 8(1): 85 朱美财,辛颜彬,孙曼霁等. 人脑乙酰胆碱酯酶的分离纯化及特性。中国科学(B辑), 1992, 8(8): 835 辛颜彬,朱美财,孙曼霁. 抗人脑乙酰胆碱酯酶单克隆抗体. 中国药理学与毒理学杂志,1994, 8(2): 218 朱 平,冯书章. 抗体实验技术. 长春:长春出版社, 1994. 323~324Lowry OH, Rosebroug N, Farr AL et al. Protein measurement with folin phenol regent. J Biol Chem, 1957, 193(3): 265Ellman GL, Courtney DK, Andres V et al. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol, 1961, 7(1): 88Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(7): 680(收稿日期:1998-10-27), http://www.100md.com
单位:第一军医大学1生化教研室,南方医院放疗科,广州,510515;军事医学科学院毒物药物研究所,北京,100850
关键词:免疫亲和层析;小脑;乙酰胆碱酯酶;交叉免疫反应性
摘要摘要:目的 分离纯化人小脑乙酰胆碱酯酶 (AChE)。材料和方法 采用ConA和B10亲和层析法纯化人小脑AChE。以纯化的人小脑AChE为免疫原,免疫6只BALB/c小鼠制备小鼠抗人小脑AChE抗血清,并检测其与电鳐AChE和人红细胞膜AChE的交叉免疫反应性。结果 SDS-PAGE还原状态下呈一条主带,相对分子质量为67 000,比活性为373 U/mg。结论 免疫亲和层析法操作简单,可快速纯化人小脑AChE。
中图分类号:Q556; R392
, 百拇医药
A preliminary study of the purification acetylcholinesterase from human cerebellum by immuno-affinity chromatography
Zhang Xingmei1, Shi Yusheng2, Zhang Han3
1Department of Biochemistry, Department of Radiotherapy of 2Nanfang Hospital, First Military Medical University, Guangzhou, 510515;3 Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Beijing ,100850Abstract: Objective To purify acetylcholinesterase (AChE) from human cerebellum. Materials and Methods By using ConA and B10 Sepharose affinity chromatographies to purify AChE. To prepare the mouse anti-human brain AChE antiserum, six BALB/c mice were immunized with the purified human cerebellum AChE. The cross-immunoreactivities of the antiserum with Torpedo AChE and human RBC membrane AChE were also detected. Results SDS-PAGE of the purified AChE which had a specific activity of 373 U/mg under reduced condition showed one main band corresponding to a molecular weight of 67 000. Conclusion Immuno-affinity chromatography is very simple and can be used to purify AChE from human cerebellum quickly.
, 百拇医药
Key words: immuno-affinity chromatography; cerebellum; acetylcholinesterase; cross-immunoreactivity
乙酰胆碱酯酶(AChE, EC 3.1.1.7)广泛分布于人的神经组织,其主要功能是催化胆碱能神经末梢释放的乙酰胆碱的水解,维持正常的神经活动。因此,AChE的生化研究受到广泛的重视。人脑组织中AChE含量很低,所以分离纯化较困难。Sorensen等[1]1982年首次纯化了人脑尾状核AChE,Rakonczay等[2]1988年纯化了人小脑AChE,并制备了三株单克隆抗体。国内朱美财等[3]报道了用含特异亲和配基的亲和层析柱来纯化人脑AChE,但其合成带有特异亲和配基的凝胶的方法很复杂。我们尝试应用B10抗人脑AChE单克隆抗体[4]制备的免疫亲和层析柱来分离纯化人小脑AChE。
, 百拇医药
1 材料和方法
1.1材料 人脑组织取自意外死亡的正常成年人(24 h内取材),-20℃保存;微型紫外记录仪为日本ATTO公司产品;纯化B10抗人脑AChE单克隆抗体的浓度为2 g/L,抗体滴度1:48 000,由军事医学科学院六所五室提供;人脑AChE标准样品、电鳐AChE和人红细胞膜AChE均达电泳纯,空军总医院朱美财教授惠赠;BALB/c小鼠购自军事医学科学院动物中心;ConA-Sepharose4B为Sigma公司产品;CNBr活化的Sepharose4B购自Pharmacia公司;其余试剂为国产分析纯。
1.2 B10免疫亲和层析柱的制备[5] 将纯化B10抗人脑AChE单克隆抗体与一定量的湿润膨胀及洗涤后的CNBr-Sepharose 4B混合,过夜。次日去上清,加入1 mol/L乙醇胺(pH 9.0)阻断未与单抗结合的活性集团,再用5~10倍0.1 mol/L磷酸钠缓冲液(pH 8.0)及0.1 mol/L乙酸缓冲液(pH 5.0)洗涤,去除未与载体结合的单抗。缓慢自然沉降法装柱,用0.1 mol/L磷酸钠缓冲液(pH 8.0)平衡。
, 百拇医药
1.3 人小脑AChE的分离纯化 取人小脑270 g,去除大的血管组织,剪碎,按1: 3(w/v)加入20 mmol/L Tris- HCl (pH 7.4)- 0.15 mol/L NaCl 溶液,1 min ´ 5次慢速捣碎成匀浆,加10 % Triton X-100至匀浆中使其终浓度为1 %,4 ℃搅拌4 h,超速离心取上清液。首先将ConA-Sepharose 4B柱(柱床100 ml)预先用缓冲液20 mmol/L Tris- HCl (pH 7.4)- 0.15 mol/L NaCl-0.1 %Triton X-100平衡。样品上柱后以平衡缓冲液洗脱杂蛋白,用含0.5 mol/L a -甲基-D-甘露糖苷的平衡缓冲液洗脱被吸附的AChE。将得到的洗脱液上预先用0.1 mol/L磷酸钠缓冲液(pH 8.0)平衡好的B10亲和层析柱(柱床16 ml,每ml凝胶结合5 mg的单抗),4℃过夜,平衡液洗脱杂蛋白,0.1 mol/L乙酸-0.15 mol/L NaCl 洗脱吸附于亲和层析柱的AChE,流速为10 ml/h,紫外280 nm检测,按峰收集。洗脱出的液体立即以1 mol/L Tris-HCl(pH 8.5)中和至中性,经超滤浓缩得纯化样品。蛋白质浓度测定采用Lowry’s法[6],酶活性测定采用DTNB法[7]。
, 百拇医药
1.4 纯化样品的SDS-PAGE电泳鉴定 按Laemmli法[8]进行垂直板电泳,浓缩胶4%,分离胶10 %。用银染法进行蛋白质的染色。
1.5 抗血清的制备及与各种AChE的反应 将纯化的人小脑AChE与等量的完全福氏佐剂混合后,免疫6只BALB/c小鼠,每次每只30 m g,经2~3个月4次加强注射后,取血清。抗原抗体反应的间接ELISA检测:各种AChE(人脑AChE标准样品、电鳐AChE和人红细胞膜AChE)经稀释至浓度为1.6 mg/L,每孔100 m l加至聚苯乙烯微孔板,4 ℃过夜,加入1 %BSA封闭,冲洗后加入不同稀释度的小鼠抗人小脑AChE抗血清100 m l/孔,37℃孵温1 h,冲洗后再加入辣根过氧化物酶标羊抗鼠抗体。底物液为OPD,终止液为2 mol/L H2SO4,用酶标仪在490 nm处测定Dλ值。
2 结果
, 百拇医药
纯化的人小脑AChE的比活性为373 U/mg,标准品的比活性为1 900 U/mg,SDS-PAGE电泳显示在还原状态下呈一条主带,相对分子质量为 67 000(图1)。每200 g人小脑组织可获得纯化样品约0.1 mg。

图1 纯化的人小脑AchE的SDS-PAGE图
Fig. 1 SDS-PAGE of purified human cerebellum AChE
A. purified AChE from human cerebellum; B. standard sample of human brain AChE; C~D. molecular weight standards
, 百拇医药
人小脑AChE免疫BALB/c小鼠产生的抗血清,以ELISA检测抗体的滴度可达1:12 000。小鼠抗人小脑AChE抗血清与电鳐AChE有较强的交叉免疫反应,而与人红细胞膜AChE的反应很弱(表 1)。
表1 小鼠抗人脑AChE抗血清和不同抗原的ELISA反应
Tab.1 ELISA of mouse anti-human brain AChE antiserum with various antigens
Antigen
Antiserum
Normal Serum
1:1500
, 百拇医药
1:3000
1:6000
1:12000
1:1500
Human brain AChE
1.348± 0.128
0.947± 0.181
0.527± 0.218
0.227± 0.021
0.092± 0.016
Human RBC AChE
, 百拇医药
0.083± 0.013
0.069± 0.010
0.029± 0.020
0.016± 0.010
0.013± 0.009
Torpedo AChE
0.834± 0.115
0.672± 0.121
0.438± 0.111
0.259± 0.024
0.060± 0.016
, http://www.100md.com
n=3,
3 讨论
免疫亲和纯化是蛋白质分离最有效的技术之一,它可快速纯化抗原,亲和柱可重复使用,同时可制备纯化的抗原。本实验采用B10抗人脑AChE单克隆抗体制备的免疫亲和层析柱来进行人小脑AChE的分离纯化。人脑AChE是一种糖蛋白,为了增加AChE活性回收率,首先经ConA亲和层析柱可去除一些竞争性干扰物质[3]。所得纯化样品达电泳纯,具有很强的抗原性,但酶的比活性较低,这可能有以下几个原因:首先,亲和层析苛刻的洗脱条件使酶容易变性;而且制备亲和层析柱时的抗体和抗原的亲和力是免疫亲和纯化中的主要问题;另外不同的层析条件,所使用的溶剂等因素也可使酶有不同程度的变性。总之,本法的优点是可快速纯化人脑AChE,亲和凝胶柱的制备简单,成本较低,所得样品纯度较高,具有很高的抗原性,但样品的酶活性较低,所以此法可适用于人脑AChE的抗体制备及其免疫学检测等研究。
, 百拇医药
不同种属的AChE分子的一级结构不同,但其有部分的同源性。利用小鼠抗人小脑AChE抗血清与各种AChE进行的抗原抗体反应的结果表明,人脑AChE与电鳐AChE有共同保守的抗原决定簇,这与文献报道一致[3]。
参考文献
Sorensen K, Gentinetta R, Brodbeck U. An amphiphile dependent form of human brain caudate nucleus acetylcholinesterase: purification and properties. J Neurochem, 1982, 399(9): 1050Rakonczay Z, Brimijoin S. Monoclonal antibodies to human brain acetylcholinesterase: properties and applications. Cell Mol Neurobiol, 1988, 8(1): 85 朱美财,辛颜彬,孙曼霁等. 人脑乙酰胆碱酯酶的分离纯化及特性。中国科学(B辑), 1992, 8(8): 835 辛颜彬,朱美财,孙曼霁. 抗人脑乙酰胆碱酯酶单克隆抗体. 中国药理学与毒理学杂志,1994, 8(2): 218 朱 平,冯书章. 抗体实验技术. 长春:长春出版社, 1994. 323~324Lowry OH, Rosebroug N, Farr AL et al. Protein measurement with folin phenol regent. J Biol Chem, 1957, 193(3): 265Ellman GL, Courtney DK, Andres V et al. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol, 1961, 7(1): 88Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(7): 680(收稿日期:1998-10-27), http://www.100md.com