尖吻蝮蛇毒类凝血酶在兔体内的药代动力学研究
作者:高 涌 龙启才
单位:高 涌 广州医学院广州蛇毒研究所;龙启才 中山医科大学临床药理教研室
关键词:尖吻蝮蛇;类凝血酶;核素药动学
广州医学院学报990202
提要 目的:研究单一组份尖吻蝮蛇毒类凝血酶在兔体内的药动学过程。方法:采用放射性核素示踪动力法和聚丙烯酰胺凝胶电泳相结合,检测体液中的原形物浓度,药-时数据用3P87程序处理。结果:兔静脉注射尖吻蝮蛇毒类凝血酶0.5、1、1.5U/kg三个剂量后,t1/2α(快分布相半衰期)在12.6~16.5min范围内,t1/2β(慢分布相半哀期)在131.6~164.7min范围内,1/2γ(消除相半衰期)在988~1292min范围内。AUC0→24h(药-时曲线下面积)分别为2833±312、5780±275和10707±12ng/min/ml比例为1∶2∶04∶3.77。结论:兔静脉注射尖吻蝮蛇毒类凝血酶三个剂量后,药-时曲线经拟合符合三房室模型特征,三个时相的半衰期各剂量组之间无显著性差异,AUC与剂量成正比,表明药物在兔体内的分布和消除为一级线性动力学过程,排泄以肾脏为主。
, http://www.100md.com
中图分类号 R969.1
The Study of Pharmacokinetics of a Pure Fraction
from Snake Venom with Thrombin-like Enzyme
Activity in Rabbits
Gao Yong1,Long QiCai2
(1 Guangzhou Research Institute of Snake Venom, Guangzhou Medical
College, Guangzhou 510182; 2 Department of Clinical Pharmacology,Sun Yat-sen University of Medical Sciences, Guangzhou 510089)
, 百拇医药
Obiective:To study the pharmacokinetics of a pure fraction from Agkistrodon acutus snake venom with thrombin-like enzyme activity(Aa-TLE)in rabbits.Methods:The concentrations of Aa-TLE in plasma was assayed by the method of radioactive nuclide-tracing kinetics combined with PAGE.The concentration-time data were processed with Aa-TLE at three doses(0.5,1,1.5 U/Kg),it was ob-served that t1/2a(half-life of fast distribution phase)was between 12.6 and 164.7 min ,and t1/2r (half-life of excretion phase)was between 988 and 1292 min.AUCO→24h (area under concentration-time curve)at different dos-es were 2833±312,5780±275,and 10707±612ng/min/ml,respectively,the ratio was 1:2.04:3.77.Conclusion :The concentration-time curves were fit for a three-compartment model,and the half-lives of three phases were with no statistically significant difference among groups of three doses ,with AUC being directly proprtional to doses.The above findings demonstrate the distri-bution of Aa-TLE in rabbits was a linear kinetic process,an it was excreted mainly by kideney.
, 百拇医药
Key words Agkistrodon acutus snake;Thrombin-like enzyme;Nuclide pharmacokinetics
蛇毒类凝血酶(Thrombin-Like Enzyme;TLE)是蝮亚科蛇毒中一个具有促凝血活性的组份[1]。1936年Klobusitky首先在巴西矛头蝮蛇的毒液中分离精制出TLE,该制剂已应用于临床,商品名即立止血[2]。70年代起,国内的一些科研机构利用不同的层析分离方法,从我国特有的蛇种尖吻蝮蛇(Agkistrodon acutus)的毒液中也成功地分离出TLE,并进行了大量的药理学及毒理学的实验,总结出它的一些基本特性:尖吻蝮TLE为酸性糖蛋白,是一种丝氨酸类蛋白酶,对精氨酸酰肽键有高度的专一性。能直接作用于纤维蛋白原,但不激活凝血XⅢ因子,使形成的纤维蛋白微凝块较为脆弱,易被体内纤溶系统消除[3~5]。该酶活性不受肝素抑制。福建蛇毒研究所应用双抗体夹心ELISA法研究了该酶(为三种同工酶的合剂)在兔体内的药动学过程[6]。本实验采用核素示踪动力学和聚丙烯胺凝胶电泳相结合的方法,对比性地研究了单一组份的尖吻蝮TLE在兔体内的药动学过程。
, 百拇医药
1 实验材料
尖吻蝮蛇毒类凝血酶(Aa-TLE):由广州燕塘生物化学制药有限公司制备。Na-I125:北京原子能研究所产品。SephadexG-50、丙烯酰胺(Acr)、N,N-亚甲基双丙烯酰胺(Bis):瑞典Pharmacia公司。其它试剂均为国产分析纯。Mini Protein Ⅱ型电泳仪:美国Bio-Rad公司产品。FMJ-182型放射免疫γ计数器:中科院上海原子能研究所日环仪器厂产品。新西兰兔:由中山医科大学动物实验中心提供。
2 实验方法
2.1 125I-Aa-TLE的制备
2.1.1 Aa-TLE的标记
氯胺T法:取浓度为1.0mg/ml的Aa-TLE 100μl,加入20μl125I-Nal(185 MBq)和20μl mg/ml新鲜配制的氯胺T,室温下振荡反应3min,然后加入20μl 2.6mg/ml新鲜配制的偏重亚硫酸钠,搅拌1min,加入5%碘化钾100μl终止反应。
, 百拇医药
2.1.2 125I-Aa-TLE的分离纯化
用处理过的阴离子交换树脂装柱纯化上述Aa-TLE碘标记物。用含有EDTA和偏重亚硫酸钠的磷酸缓冲液洗脱。用部分收集器收集洗脱液,再用放射性活度计检测洗脱峰,合并所需的125I-Aa-TLE管,置4℃冰箱保存备用。
2.1.3 125I-Aa-TLE放射性化学纯度的测定
纸层析法:用新华普通定性层析纸,展开系统为2NHCI∶5%KI=1∶1(V/V),展开高度9cm,取出吹干,分段测量每分钟放射性记数(cpm),然后除以0.6换算成放射性衰减计数(dpm)。
电泳法:聚丙烯酰胺凝胶电泳法,将电泳条带分段测定,计算125I-Aa-TLE所在的放射峰占总放的百分比。
, 百拇医药
2.2 Aa-TLE标记前后生物活性鉴定
生物学活性测定:两组标记和未标记的Aa-TLE,各稀释成100ng/ml浓度溶液,每个浓度点10个样品,水浴37℃下,分别与0.2ml 4mg/ml浓度的牛纤维蛋白原溶液反应,记录出现纤维蛋白凝块的时间。
2.3 药代动力学实验设计
2.3.1 血浆药代动力学研究
三组新西兰兔,每组8只,雌雄各半。各组兔在清醒状态下,自耳缘静脉分别i.v125I-Aa-TLE 0.5、1和1.5U/kg三个剂量(lU=8ng),于给药前及给药后2、5、10、20、30、60、120、240、300、360、480、600、720、1440min,分别自另侧耳缘静脉取血0.5ml,置于肝素化塑料离心管中,离心分离上清血浆,置冰箱备用。
, 百拇医药
2.3.2 药物的排泄研究
兔一组,共5只。自耳缘静脉给药1U/kg后分别收集0~24、~48、~72h三个时间段的尿液,并记录各段尿量;同时收集给药后0~24、~48、~72h排泄的大便,烤干后称重。
2.4 样品中Aa-TLE原形物的检测方法
2.4.1 聚丙烯胺凝胶电泳
电泳条件:12%分离胶,5%浓缩胶,5×Tris-甘氨酸电泳缓冲液,40%甘油凝胶加样缓冲液。
电泳操作:取血浆30μl,加50μl 40%甘油及pH7.8Tris缓冲液30μl,混匀后上样30μl。样品在浓缩胶中的电压为150V,在分离胶中的电压为260V。分离胶总长度为5cm。电泳到溴酚蓝距分离胶上缘5cm时,停止电泳。
, 百拇医药
胶处理:胶片自浓缩胶开始,依次切成浓缩胶1片(1cm)、分离胶共4片胶(长度分别为2、1.5、1和1.5cm)、封底胶1片(0.5cm),分别装入测量管中,用γ计数器测量cpm,并换算成dpm。
2.4.2 标准曲线的制备
用空白血浆将注射用的125I-Aa-TLE配成不同浓度,取30μl,加50μl 40%甘油及pH7.8Tris缓冲液30μl,混匀后上样30μl。电泳后切胶,测定各片胶cpm值,换算成dpm值。作出125I-Aa-TLE片胶dpm值与血浆浓度的电泳标准曲线,并计算回收率和变异系数。
2.5 数据处理
将125I-Aa-TLE注射入兔后收集的血浆样品电泳后切胶,测量各片胶cpm,然后把125I-Aa-TLE片胶的换算dpm值代入电泳标准曲线就可得到样品中Aa-TLE原形物的浓度。
, http://www.100md.com
药动学参数用张文贵等编制的3P87程序计算。数据处理方法是将逐个动物的血药浓度-时间数据作曲线拟合,算出各药动学参数,然后计算平均值。
3 实验结果
3.1 125I-Aa-TLE制备结果
标记后经阴离于交换树脂分离纯化过的125I-Aa-TLE,用纸层析法和电泳法鉴定放化纯度,分别为97.8±0.5和97.1±0.9%(P>0.05)。
3.2 125I-Aa-TLE标记前后生物学活性的鉴定
100ng/ml浓度的Aa-TLE和125I-Aa-TLE与纤维蛋白原反应出现凝块的时间分别为726±5.7和75.6±5min(P>0.05),t检验无显著性差异,说明在标记前后Aa-TLE的活性无变化。
, http://www.100md.com
3.3 125I标记示踪与PAGE相结合方法的可靠性鉴定
电泳以一定量的Aa-TLE作为参考物,用考马斯亮蓝染色,以确定原形物的位置。以125I-Aa-TLE和125I分别作为原形物和游离125I的参照物,以确定它们在电泳条带上的位置。从电泳染色结果及电泳后所切凝胶片的检测图谱中,见图1,可以看出:Aa-TLE和125I-Aa-TLE的迁移距离相同,均在距分离胶上缘4.5cm处,而125I-Aa-TLE的放射性测量峰所在位置与Aa-TLE染色带的位置也相同。同时,Aa-TLE可以很好地与生物样品(血浆、组织匀浆)中的其它蛋白分离开,而且,生物样品中的这些蛋白对Aa-TLE及125I-Aa-TLE的电泳迁移率也没有影响。因此,根据电泳的移动位置可有效地分离出样品中Aa-TLE原形物。
, 百拇医药
图1 Aa-TLE及兔血浆电泳
1.Aa-TLE 2.125I-Aa-TLE 3.Na125I
4.空白兔血浆 5.125I-Aa-TLE+空白兔血浆
6.空白肺组织匀浆 7.空白肺组织匀浆+125I-Aa-TLE
3.4 标准曲线制备
标准曲线的制备采用五点法,最高点和最低点的选定是根据实验中兔的2min和1440min点的dpm值而定。
静脉注射0.5U/kg组:24、8、2.67、0.89、0.3ng/ml系列浓度的标准曲线见图2。静脉注射1U/kg组:75、30、12、4.8、1.92ng/ml系列浓度的标准曲线见图3。静脉注射1.5u/kg组:100、40、16、6.4、2.56系列浓度的标准曲线见图4。
, 百拇医药
图2 Aa-TLE低剂量标准曲线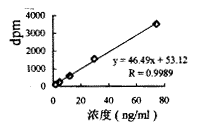
图3 Aa-TLE中剂量标准曲线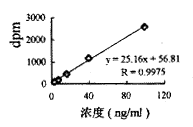
图4 Aa-TLE高剂量标准曲线
3.5 血浆浓度变化及药动学参数
兔静脉注射125I-Aa-TLE三个剂量后的平均血药浓度-时间曲线,见图5。药-时曲线经拟合符合三房室模型特征,权重系数取1/C2,AUC计算采用统计矩法,算出的药代动力学参数见表1。
, 百拇医药 图5 三个剂量药-时曲线
iv.Aa-TLE
表1 三个剂量药动学参数 参数
剂量(U/kg)
0.5
1
1.5
Vd/(L/kg)
0.1353
0.132
0.1268
t1/2α(min)
, http://www.100md.com
11.12
10.06
9.79
t1/2β(min)
118.5
115.8
100.9
t1/2γ(min)
970
983.5
957
AUC0-24h
, 百拇医药
5812
11686
18167#
MRT(min)
395.7
392.9
391
#比例为1∶2.01∶3.12
从图5可见:静脉给药后血药浓度迅速下降,到2h之后下降缓慢。药-时曲线拟合符合三房室模型特征,分为快分布、慢分布和消除三个时相。由表1可见:三个时相的半衰期各剂量组之间无显著性差异,AUC0→24h与剂量成正比,表明在0.5~1.5U/kg剂量范围,药物在兔体内的消除为一级线性动力学过程。
, 百拇医药
3.6 药物的排泄
静脉注射125I-Aa-TLE后72h尿平均累积标记物排泄率为给药量的81.8±8.8%,粪便累积排泄率为2.1±0.3%。
4 讨论
蛋白质多肽类药物的医学应用,是90年代国内外关注的课题。为了正确评价蛋白质多肽类药物在人体中的疗效和安全,必须研究其在动物和人体内的药代动力学,即吸收、分布、代谢和排泄的规律,这是蛋白质多肽类药物进行临床试验必不可少的重要资料[7]。
药代动力学研究的前提是建立可靠的测定方法,优良的测定方法的主要标志是:特异性好、灵敏度高、重现性好、回收率高、线性范围宽。核素示踪动力法是活性蛋白质多肽临床前动物药代动力学研究的主要手段之一,可获得血液药物浓度变化动力学、分布代谢和排泄的全面资料。该法灵敏度高,可达到ng(10-9g)水平,但必须结合层析或电泳等其他方法才能识别原形药物和降解代谢物,缺点是不能进行人体药代动力学研究。然而单独使用该法存在一个缺陷,即样品总放射性并不代表原型核素标记生物因子浓度,因为外源性蛋白质多肽在机体内可被降解,产生有放射性的代谢碎片,故必须引入分离分析蛋白质的其它方法,将原型物和降解产物进行有效地分离。另外,酶联免疫吸附分析法也常用于药动学的研究,它的特点是特异性好,灵敏、迅速、可成批处理。缺点是由于代谢产物、抗体生成等的干扰,可出现假阳性结果。就目前而言,在蛋白质多肽临床前动物药动学研究上,核素示踪动力法的应用更为广泛。
, 百拇医药
本实验结果与福建医学院曾报道的尖吻蝮类凝血酶药动学研究结果有相似之处,但他们采用的是双抗体夹心ELISA法[6],且使用的酶为三种同工酶的合剂,得出药物在兔的动力学模型也为三房室模型,分布和消除为一级线性动力学过程。两实验结果的消除相半衰期均接近20h,表明药物在体内的消除较为缓慢。Aa-TLE作为一种异物蛋白质被静注到动物体内,主要在哪个器官或组织被分解代谢,并且速度如此缓慢,其中机制有待进一步研究。
所有兔血浆样品电泳后均未发现明显的代谢物区带,这也许与药物被代谢成小分子物质,而PAGE不能检测出来有关。
参考文献
1 陈远聪,陈文杰.蛇毒的生化、毒理和应用.北京:科学出版社,1983:20~60
2 容建材,廖锡麟.立止血的药理作用.临产应用与安全性.江西医学,1994;5:312~314
, 百拇医药
3 刘广芬.福建产尖吻蝮蛇毒柱层析分离及酶活力和某些生理效应的测定.动物学研究,1980;1:107~113
4 张洪基,肖昌华.尖吻蝮蛇毒的分离及其生物活性的研究.动物学研究,1980;5:155~159
5 腾国强.五步蛇毒的分离及凝血样酶等活性的测定.中国药理学报,1982;3(1):21~
6 朱龙祥,王睛川,刘广芬.尖吻蝮蛇凝血样酶在兔体内的药物动力学.中国药理学与毒理学杂志,1990;4:213~215
7 汤仲明,刘秀文,屠敏.蛋白质多肽类药物药代动力学研究的方法学和实验设计.中国药理学与毒理学杂志,1996;10:161~168
(收稿:1999-06-17), 百拇医药
单位:高 涌 广州医学院广州蛇毒研究所;龙启才 中山医科大学临床药理教研室
关键词:尖吻蝮蛇;类凝血酶;核素药动学
广州医学院学报990202
提要 目的:研究单一组份尖吻蝮蛇毒类凝血酶在兔体内的药动学过程。方法:采用放射性核素示踪动力法和聚丙烯酰胺凝胶电泳相结合,检测体液中的原形物浓度,药-时数据用3P87程序处理。结果:兔静脉注射尖吻蝮蛇毒类凝血酶0.5、1、1.5U/kg三个剂量后,t1/2α(快分布相半衰期)在12.6~16.5min范围内,t1/2β(慢分布相半哀期)在131.6~164.7min范围内,1/2γ(消除相半衰期)在988~1292min范围内。AUC0→24h(药-时曲线下面积)分别为2833±312、5780±275和10707±12ng/min/ml比例为1∶2∶04∶3.77。结论:兔静脉注射尖吻蝮蛇毒类凝血酶三个剂量后,药-时曲线经拟合符合三房室模型特征,三个时相的半衰期各剂量组之间无显著性差异,AUC与剂量成正比,表明药物在兔体内的分布和消除为一级线性动力学过程,排泄以肾脏为主。
, http://www.100md.com
中图分类号 R969.1
The Study of Pharmacokinetics of a Pure Fraction
from Snake Venom with Thrombin-like Enzyme
Activity in Rabbits
Gao Yong1,Long QiCai2
(1 Guangzhou Research Institute of Snake Venom, Guangzhou Medical
College, Guangzhou 510182; 2 Department of Clinical Pharmacology,Sun Yat-sen University of Medical Sciences, Guangzhou 510089)
, 百拇医药
Obiective:To study the pharmacokinetics of a pure fraction from Agkistrodon acutus snake venom with thrombin-like enzyme activity(Aa-TLE)in rabbits.Methods:The concentrations of Aa-TLE in plasma was assayed by the method of radioactive nuclide-tracing kinetics combined with PAGE.The concentration-time data were processed with Aa-TLE at three doses(0.5,1,1.5 U/Kg),it was ob-served that t1/2a(half-life of fast distribution phase)was between 12.6 and 164.7 min ,and t1/2r (half-life of excretion phase)was between 988 and 1292 min.AUCO→24h (area under concentration-time curve)at different dos-es were 2833±312,5780±275,and 10707±612ng/min/ml,respectively,the ratio was 1:2.04:3.77.Conclusion :The concentration-time curves were fit for a three-compartment model,and the half-lives of three phases were with no statistically significant difference among groups of three doses ,with AUC being directly proprtional to doses.The above findings demonstrate the distri-bution of Aa-TLE in rabbits was a linear kinetic process,an it was excreted mainly by kideney.
, 百拇医药
Key words Agkistrodon acutus snake;Thrombin-like enzyme;Nuclide pharmacokinetics
蛇毒类凝血酶(Thrombin-Like Enzyme;TLE)是蝮亚科蛇毒中一个具有促凝血活性的组份[1]。1936年Klobusitky首先在巴西矛头蝮蛇的毒液中分离精制出TLE,该制剂已应用于临床,商品名即立止血[2]。70年代起,国内的一些科研机构利用不同的层析分离方法,从我国特有的蛇种尖吻蝮蛇(Agkistrodon acutus)的毒液中也成功地分离出TLE,并进行了大量的药理学及毒理学的实验,总结出它的一些基本特性:尖吻蝮TLE为酸性糖蛋白,是一种丝氨酸类蛋白酶,对精氨酸酰肽键有高度的专一性。能直接作用于纤维蛋白原,但不激活凝血XⅢ因子,使形成的纤维蛋白微凝块较为脆弱,易被体内纤溶系统消除[3~5]。该酶活性不受肝素抑制。福建蛇毒研究所应用双抗体夹心ELISA法研究了该酶(为三种同工酶的合剂)在兔体内的药动学过程[6]。本实验采用核素示踪动力学和聚丙烯胺凝胶电泳相结合的方法,对比性地研究了单一组份的尖吻蝮TLE在兔体内的药动学过程。
, 百拇医药
1 实验材料
尖吻蝮蛇毒类凝血酶(Aa-TLE):由广州燕塘生物化学制药有限公司制备。Na-I125:北京原子能研究所产品。SephadexG-50、丙烯酰胺(Acr)、N,N-亚甲基双丙烯酰胺(Bis):瑞典Pharmacia公司。其它试剂均为国产分析纯。Mini Protein Ⅱ型电泳仪:美国Bio-Rad公司产品。FMJ-182型放射免疫γ计数器:中科院上海原子能研究所日环仪器厂产品。新西兰兔:由中山医科大学动物实验中心提供。
2 实验方法
2.1 125I-Aa-TLE的制备
2.1.1 Aa-TLE的标记
氯胺T法:取浓度为1.0mg/ml的Aa-TLE 100μl,加入20μl125I-Nal(185 MBq)和20μl mg/ml新鲜配制的氯胺T,室温下振荡反应3min,然后加入20μl 2.6mg/ml新鲜配制的偏重亚硫酸钠,搅拌1min,加入5%碘化钾100μl终止反应。
, 百拇医药
2.1.2 125I-Aa-TLE的分离纯化
用处理过的阴离子交换树脂装柱纯化上述Aa-TLE碘标记物。用含有EDTA和偏重亚硫酸钠的磷酸缓冲液洗脱。用部分收集器收集洗脱液,再用放射性活度计检测洗脱峰,合并所需的125I-Aa-TLE管,置4℃冰箱保存备用。
2.1.3 125I-Aa-TLE放射性化学纯度的测定
纸层析法:用新华普通定性层析纸,展开系统为2NHCI∶5%KI=1∶1(V/V),展开高度9cm,取出吹干,分段测量每分钟放射性记数(cpm),然后除以0.6换算成放射性衰减计数(dpm)。
电泳法:聚丙烯酰胺凝胶电泳法,将电泳条带分段测定,计算125I-Aa-TLE所在的放射峰占总放的百分比。
, 百拇医药
2.2 Aa-TLE标记前后生物活性鉴定
生物学活性测定:两组标记和未标记的Aa-TLE,各稀释成100ng/ml浓度溶液,每个浓度点10个样品,水浴37℃下,分别与0.2ml 4mg/ml浓度的牛纤维蛋白原溶液反应,记录出现纤维蛋白凝块的时间。
2.3 药代动力学实验设计
2.3.1 血浆药代动力学研究
三组新西兰兔,每组8只,雌雄各半。各组兔在清醒状态下,自耳缘静脉分别i.v125I-Aa-TLE 0.5、1和1.5U/kg三个剂量(lU=8ng),于给药前及给药后2、5、10、20、30、60、120、240、300、360、480、600、720、1440min,分别自另侧耳缘静脉取血0.5ml,置于肝素化塑料离心管中,离心分离上清血浆,置冰箱备用。
, 百拇医药
2.3.2 药物的排泄研究
兔一组,共5只。自耳缘静脉给药1U/kg后分别收集0~24、~48、~72h三个时间段的尿液,并记录各段尿量;同时收集给药后0~24、~48、~72h排泄的大便,烤干后称重。
2.4 样品中Aa-TLE原形物的检测方法
2.4.1 聚丙烯胺凝胶电泳
电泳条件:12%分离胶,5%浓缩胶,5×Tris-甘氨酸电泳缓冲液,40%甘油凝胶加样缓冲液。
电泳操作:取血浆30μl,加50μl 40%甘油及pH7.8Tris缓冲液30μl,混匀后上样30μl。样品在浓缩胶中的电压为150V,在分离胶中的电压为260V。分离胶总长度为5cm。电泳到溴酚蓝距分离胶上缘5cm时,停止电泳。
, 百拇医药
胶处理:胶片自浓缩胶开始,依次切成浓缩胶1片(1cm)、分离胶共4片胶(长度分别为2、1.5、1和1.5cm)、封底胶1片(0.5cm),分别装入测量管中,用γ计数器测量cpm,并换算成dpm。
2.4.2 标准曲线的制备
用空白血浆将注射用的125I-Aa-TLE配成不同浓度,取30μl,加50μl 40%甘油及pH7.8Tris缓冲液30μl,混匀后上样30μl。电泳后切胶,测定各片胶cpm值,换算成dpm值。作出125I-Aa-TLE片胶dpm值与血浆浓度的电泳标准曲线,并计算回收率和变异系数。
2.5 数据处理
将125I-Aa-TLE注射入兔后收集的血浆样品电泳后切胶,测量各片胶cpm,然后把125I-Aa-TLE片胶的换算dpm值代入电泳标准曲线就可得到样品中Aa-TLE原形物的浓度。
, http://www.100md.com
药动学参数用张文贵等编制的3P87程序计算。数据处理方法是将逐个动物的血药浓度-时间数据作曲线拟合,算出各药动学参数,然后计算平均值。
3 实验结果
3.1 125I-Aa-TLE制备结果
标记后经阴离于交换树脂分离纯化过的125I-Aa-TLE,用纸层析法和电泳法鉴定放化纯度,分别为97.8±0.5和97.1±0.9%(P>0.05)。
3.2 125I-Aa-TLE标记前后生物学活性的鉴定
100ng/ml浓度的Aa-TLE和125I-Aa-TLE与纤维蛋白原反应出现凝块的时间分别为726±5.7和75.6±5min(P>0.05),t检验无显著性差异,说明在标记前后Aa-TLE的活性无变化。
, http://www.100md.com
3.3 125I标记示踪与PAGE相结合方法的可靠性鉴定
电泳以一定量的Aa-TLE作为参考物,用考马斯亮蓝染色,以确定原形物的位置。以125I-Aa-TLE和125I分别作为原形物和游离125I的参照物,以确定它们在电泳条带上的位置。从电泳染色结果及电泳后所切凝胶片的检测图谱中,见图1,可以看出:Aa-TLE和125I-Aa-TLE的迁移距离相同,均在距分离胶上缘4.5cm处,而125I-Aa-TLE的放射性测量峰所在位置与Aa-TLE染色带的位置也相同。同时,Aa-TLE可以很好地与生物样品(血浆、组织匀浆)中的其它蛋白分离开,而且,生物样品中的这些蛋白对Aa-TLE及125I-Aa-TLE的电泳迁移率也没有影响。因此,根据电泳的移动位置可有效地分离出样品中Aa-TLE原形物。

, 百拇医药
图1 Aa-TLE及兔血浆电泳
1.Aa-TLE 2.125I-Aa-TLE 3.Na125I
4.空白兔血浆 5.125I-Aa-TLE+空白兔血浆
6.空白肺组织匀浆 7.空白肺组织匀浆+125I-Aa-TLE
3.4 标准曲线制备
标准曲线的制备采用五点法,最高点和最低点的选定是根据实验中兔的2min和1440min点的dpm值而定。
静脉注射0.5U/kg组:24、8、2.67、0.89、0.3ng/ml系列浓度的标准曲线见图2。静脉注射1U/kg组:75、30、12、4.8、1.92ng/ml系列浓度的标准曲线见图3。静脉注射1.5u/kg组:100、40、16、6.4、2.56系列浓度的标准曲线见图4。

, 百拇医药
图2 Aa-TLE低剂量标准曲线

图3 Aa-TLE中剂量标准曲线

图4 Aa-TLE高剂量标准曲线
3.5 血浆浓度变化及药动学参数
兔静脉注射125I-Aa-TLE三个剂量后的平均血药浓度-时间曲线,见图5。药-时曲线经拟合符合三房室模型特征,权重系数取1/C2,AUC计算采用统计矩法,算出的药代动力学参数见表1。

, 百拇医药 图5 三个剂量药-时曲线
iv.Aa-TLE
表1 三个剂量药动学参数 参数
剂量(U/kg)
0.5
1
1.5
Vd/(L/kg)
0.1353
0.132
0.1268
t1/2α(min)
, http://www.100md.com
11.12
10.06
9.79
t1/2β(min)
118.5
115.8
100.9
t1/2γ(min)
970
983.5
957
AUC0-24h
, 百拇医药
5812
11686
18167#
MRT(min)
395.7
392.9
391
#比例为1∶2.01∶3.12
从图5可见:静脉给药后血药浓度迅速下降,到2h之后下降缓慢。药-时曲线拟合符合三房室模型特征,分为快分布、慢分布和消除三个时相。由表1可见:三个时相的半衰期各剂量组之间无显著性差异,AUC0→24h与剂量成正比,表明在0.5~1.5U/kg剂量范围,药物在兔体内的消除为一级线性动力学过程。
, 百拇医药
3.6 药物的排泄
静脉注射125I-Aa-TLE后72h尿平均累积标记物排泄率为给药量的81.8±8.8%,粪便累积排泄率为2.1±0.3%。
4 讨论
蛋白质多肽类药物的医学应用,是90年代国内外关注的课题。为了正确评价蛋白质多肽类药物在人体中的疗效和安全,必须研究其在动物和人体内的药代动力学,即吸收、分布、代谢和排泄的规律,这是蛋白质多肽类药物进行临床试验必不可少的重要资料[7]。
药代动力学研究的前提是建立可靠的测定方法,优良的测定方法的主要标志是:特异性好、灵敏度高、重现性好、回收率高、线性范围宽。核素示踪动力法是活性蛋白质多肽临床前动物药代动力学研究的主要手段之一,可获得血液药物浓度变化动力学、分布代谢和排泄的全面资料。该法灵敏度高,可达到ng(10-9g)水平,但必须结合层析或电泳等其他方法才能识别原形药物和降解代谢物,缺点是不能进行人体药代动力学研究。然而单独使用该法存在一个缺陷,即样品总放射性并不代表原型核素标记生物因子浓度,因为外源性蛋白质多肽在机体内可被降解,产生有放射性的代谢碎片,故必须引入分离分析蛋白质的其它方法,将原型物和降解产物进行有效地分离。另外,酶联免疫吸附分析法也常用于药动学的研究,它的特点是特异性好,灵敏、迅速、可成批处理。缺点是由于代谢产物、抗体生成等的干扰,可出现假阳性结果。就目前而言,在蛋白质多肽临床前动物药动学研究上,核素示踪动力法的应用更为广泛。
, 百拇医药
本实验结果与福建医学院曾报道的尖吻蝮类凝血酶药动学研究结果有相似之处,但他们采用的是双抗体夹心ELISA法[6],且使用的酶为三种同工酶的合剂,得出药物在兔的动力学模型也为三房室模型,分布和消除为一级线性动力学过程。两实验结果的消除相半衰期均接近20h,表明药物在体内的消除较为缓慢。Aa-TLE作为一种异物蛋白质被静注到动物体内,主要在哪个器官或组织被分解代谢,并且速度如此缓慢,其中机制有待进一步研究。
所有兔血浆样品电泳后均未发现明显的代谢物区带,这也许与药物被代谢成小分子物质,而PAGE不能检测出来有关。
参考文献
1 陈远聪,陈文杰.蛇毒的生化、毒理和应用.北京:科学出版社,1983:20~60
2 容建材,廖锡麟.立止血的药理作用.临产应用与安全性.江西医学,1994;5:312~314
, 百拇医药
3 刘广芬.福建产尖吻蝮蛇毒柱层析分离及酶活力和某些生理效应的测定.动物学研究,1980;1:107~113
4 张洪基,肖昌华.尖吻蝮蛇毒的分离及其生物活性的研究.动物学研究,1980;5:155~159
5 腾国强.五步蛇毒的分离及凝血样酶等活性的测定.中国药理学报,1982;3(1):21~
6 朱龙祥,王睛川,刘广芬.尖吻蝮蛇凝血样酶在兔体内的药物动力学.中国药理学与毒理学杂志,1990;4:213~215
7 汤仲明,刘秀文,屠敏.蛋白质多肽类药物药代动力学研究的方法学和实验设计.中国药理学与毒理学杂志,1996;10:161~168
(收稿:1999-06-17), 百拇医药