重组P53基因转染的肝癌细胞克隆株的建立及其生物学活性观察
作者:杨晓红 任碧轩 唐恩洁 李仁 冯莉
单位:(川北医学院分子生物研究室 南充 637000)
关键词:野生型P53基因;人肝癌细胞系;基因治疗
川北医学院学报/990204提 要 人P53基因位于17号染色体短臂上(17p13.1),编码一个由393个氨基酸组成的核磷酸蛋白,有调控细胞的生长,维持基因组的稳定,其突变、缺失在恶性肿瘤发生发展中起着非常重要的作用。为进一步探讨野生型P53基因的抗肿瘤特性,我室采用分子克隆方法构建了重组野生型P53真核表达载体(pxT1—P53),用磷酸钙—DNA共沉淀法将其导入人肝癌HepG-2细胞内,通过标记基因NeOR筛选带外源P53基因的G418抗药性克隆,对G418抗药性克隆细胞的生长增殖和粘附能力进行观察。结果表明,导入野生型P53基因能使肝癌HepG-2细胞的生长增殖速度较对照细胞明显减慢,细胞粘附能力下降。提示野生型P53基因能抑制肝癌细胞的生长。本研究为肝癌的P53实验性基因治疗提供了一定的依据。
, http://www.100md.com
文章编号:1005-3697(1999)02-0010-02 中图分类号:R730.23 文献标识码:A
Observation of the Biological Characteristics of
the Tumor Cells Transfected with Recombinant P53
Yang Xiaohong, Ren Bixuan,Tang Enjie et al
Department of Molecular Biology, North Sichuan Medical College
ABSTRACT P53 gene is located on the short arm of human chromosome 17 at position 17p13.1. This gene encodes a 393-amino acid nuclear phosphoprotein which involves in the regulation of cell proliferation. Loss of normal P53 function is associated with the cell transformation in vitro and the development of neoplasms in vivo. More than one-half of human malignancies were shown to contain an altered P53 gene. To gain more insight into the functional role of wild-type P53 in human carcinoma, we constructed recombinant wild-type-pxT1-P53 expression vector. We performed experiments to transfer wild-type P53 gene into human hepatoma cell line(HepG-2) with the calcium phosphate precipitation method. We assessed cell growth properties and the changes of adhesive. The results demonstrated that human wild-type P53 gene can suppress the phenotype of HepG-2 cell line. These results encourage us to do further experiments on tumor cell targeted P53 therapy.
, 百拇医药
Key Words wild-type P53 gene HepG-2 gene therapy
人P53基因是一种抑癌基因,P53蛋白作为一种细胞增殖的负调节因子,控制细胞的生长。该基因的突变、缺失在恶性肿瘤发生发展中起着重要作用[1]。为进一步探讨P53基因的抗肿瘤特性,我们用分子克隆方法构建了人野生型P53(WT-P53)基因真核表达载体(pxT1-P53)[2]。通过磷酸钙介导的贴壁细胞转染法将WT-P53基因导入人肝癌细胞株HepG-2,观察了靶细胞的转化子克隆形成,生长速度及细胞粘附能力的变化。
1 材料与方法
1.1 材料
, http://www.100md.com
1.1.1 重组P53真核表达载体由本室构建、制备及鉴定。RPMI1640培养基购自Gibco公司。G418和MTT购自Sigma公司。多聚左旋赖氨酸及BSA等购于B.M公司。
1.1.2 人肿瘤细胞株HepG-2由重庆医大任红教授惠赠、本室传代保存。
1.2 方法
1.2.1 P53基因导入HepG-2细胞及转化细胞筛选
HepG-2细胞贴壁生长在含10 %~15 %小牛血清及青链霉素的RPMI1640培养液中。细胞培养、克隆筛选及生长测试等均在5%CO2浓度、 饱和湿度及37 ℃培养条件下进行。HepG-2细胞G418筛选浓度为400 ug/ml,维持浓度为200 ug/ml。
, 百拇医药
按文献3介绍的磷酸钙介导的贴壁细胞转染法,将纯化的pxT1-P53转至处于对数生长期的HepG-2细胞,并设未转染细胞作对照。加完全培养基培养48 h,换入含G418的筛选培养基选择培养2~3周(每3~5 d更换培养液),获取G418抗药性细胞,并在G418培养基中扩大培养,分离稳定的转化体作进一步分析用(P53的表达另文发表)。
1.2.2 细胞生长曲线测定
参照文献4取对数生长期的细胞100 ul(2×106/ml),加入96孔板中,每组设三个复孔。置37 ℃,5 %CO2培养48 h后,加入2 ulMTT(5 mg/ml)继续培养4 h,弃上清,每孔加入100 ulDMSO振摇5 min,在Model 550(BIO-RAD公司、美国)酶标仪,630 nm波长下测OD值。
, http://www.100md.com
体外观察HepG-2细胞生长能力时,按文献4方法,将HepG-2和HepG-2-P53以1×104/ml起始浓度5 ml分别加入各相同规格的培养瓶中,每日取1瓶用台盼兰染色汁数活细胞数量。
1.2.3 细胞粘附能力测定
取96孔平底培养板用BSA(30 ug/ml)和多聚左旋赖氨酸(30 ug/ml)预包板作为测定孔和阳性对照孔。置25 ℃,30 min,弃包被液每孔分别加入HepG-2和HepG-2-P53细胞200ul(1.5×105/ml),设三个复孔,37℃培养1 h,0.1M pH7.4PBS洗涤去除非粘附细胞。用甲苯氨兰染色粘附细胞30 min,洗涤晾干后,加100 ul2% SDS溶解细胞染料,630nm波长下用酶标仪测OD值[5]。
2 结果
, http://www.100md.com
2.1 P53基因转染的HepG-2细胞的获取
用磷酸钙介导的贴壁细胞转染法将pxT1-P53重组体导入HepG-2细胞。转染组和正常HepG-2对照组分别加入G418培养液筛选。第3 d后两组细胞均有大量死亡而漂浮于培养基中。电镜观察漂浮细胞有明显的细胞凋亡特征如细胞膜鼓泡、核固缩及凋亡小体出现等。继续用G418培养液维持培养,约4周后转染组细胞较稳定生长,继续培养传代备用。
2.2 基因转染后HepG-2细胞增殖能力
导入WT-P53基因的肝癌细胞(HepG-2+pxT1-P53)生长速度较对照细胞HepG-2明显减慢,结果如图1、2所示。说明P53基因能抑制肝癌细胞生长。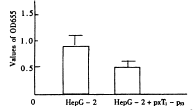
, 百拇医药
图1 MTT法检测HepG-2和HepG-2+pxT1-p53增殖能力的比较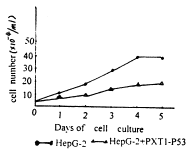
图2 细胞生长曲线
2.3 基因转染后细胞粘附能力观察
本实验观察到P53基因转导后肝癌细胞(Hep-2+pxT1-P53)较对照细胞(HepG-2)的粘附能力减弱(p<0.05),测定结果见图3。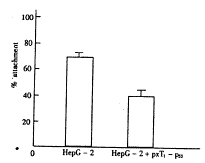
图3 不同组HepG-2细胞的粘附能力
3 讨论
, 百拇医药
我室用分子克隆方法构建了重组野生型P53基因真核表达载体(pxT1-P53),并以肝癌细胞(HepG-2)为研究对象,采用磷酸钙-DNA共沉淀法将pxT1-P53转染至HepG-2细胞内,用Southern blot和免疫荧光法检测P53基因及表达(另文发表)。用MTT法和细胞生长曲线测定法观察到导入野生型P53基因的肝癌细胞其生长速度较对照细胞明显减慢。同时本实验观察到转染有外源性P53基因的HepG-2细胞粘附能力下降。Chang J[6]等报道他们将转染有野生型P53基因的急性淋巴母细胞白血病细胞繁殖成系,发现这些细胞生长速度减慢或倍增时间延长。说明野生型P53基因对肿瘤细胞有一定的抑制作用。
P53基因产生上述生物学效应的机理目前尚未完全明了,可能是导入外源P53基因后靶细胞内的P53蛋白表达增加。P53蛋白作为一种转导因子,能刺激或诱导WAF1/CIP1基因产生21KD蛋白(P21WAF1/CIP1),有野生型P53基因的细胞DNA损伤之后,P21WAF1/CIP1量的增加能抑制促使细胞通过细胞周期和进入有丝分裂的激酶(cdks),因此细胞增殖受到抑制或发生细胞凋亡[7]。笔者曾用细胞凋亡染色和电镜观察到P53基因转染的肿瘤细胞发生凋亡的现象(资料待发)。
, 百拇医药
通过体外实验观察到重组P53基因转染的肝癌HepG-2细胞生长增殖和粘附能力改变,肿瘤细胞生物学活性受到一定的抑制。但肿瘤细胞在体内的生长增殖过程极为复杂,因而有必要进一步实验观察转染细胞在动物体内的免疫学和其他生物学活性状态。
参考文献
1 Chang FJ, Syrijanen S,Kurvinen K efal. The P53 tumor suppressor gen as a common cellular target in human carcinogenesis.Am J Gastroenterol, 1993;88(2):174
2 李仁,任碧轩,杨晓红等.重组P53真核表达载体的构建.川北医学院学报,1998;13(1):1
, 百拇医药 3 Ausubel MF, Brentk, Kingstone ER et al. Short protocols in molecular blalogy, 3rded John wiley % Sons. Inc, USA 1995;1~21
4 韩锐主编.抗癌药物研究与实验技术.北京:北京医大协合医大联合出版社,1997;第一版,284,282
5 钱玉昆主编.实用免疫学新技术.北京:北京医大协合医大联合出版社,1994;43
6 Cheng J, Yee sk, yeargin J et al. Suppression of acute lymphoblastic leukemia by the human wild-type p53 gene. Cancer Res, 1992;52:222
7 Marx J. How p53 suppresses cell growth. Science, 1993;262:1644
(收稿日期:1999-04-08), 百拇医药
单位:(川北医学院分子生物研究室 南充 637000)
关键词:野生型P53基因;人肝癌细胞系;基因治疗
川北医学院学报/990204提 要 人P53基因位于17号染色体短臂上(17p13.1),编码一个由393个氨基酸组成的核磷酸蛋白,有调控细胞的生长,维持基因组的稳定,其突变、缺失在恶性肿瘤发生发展中起着非常重要的作用。为进一步探讨野生型P53基因的抗肿瘤特性,我室采用分子克隆方法构建了重组野生型P53真核表达载体(pxT1—P53),用磷酸钙—DNA共沉淀法将其导入人肝癌HepG-2细胞内,通过标记基因NeOR筛选带外源P53基因的G418抗药性克隆,对G418抗药性克隆细胞的生长增殖和粘附能力进行观察。结果表明,导入野生型P53基因能使肝癌HepG-2细胞的生长增殖速度较对照细胞明显减慢,细胞粘附能力下降。提示野生型P53基因能抑制肝癌细胞的生长。本研究为肝癌的P53实验性基因治疗提供了一定的依据。
, http://www.100md.com
文章编号:1005-3697(1999)02-0010-02 中图分类号:R730.23 文献标识码:A
Observation of the Biological Characteristics of
the Tumor Cells Transfected with Recombinant P53
Yang Xiaohong, Ren Bixuan,Tang Enjie et al
Department of Molecular Biology, North Sichuan Medical College
ABSTRACT P53 gene is located on the short arm of human chromosome 17 at position 17p13.1. This gene encodes a 393-amino acid nuclear phosphoprotein which involves in the regulation of cell proliferation. Loss of normal P53 function is associated with the cell transformation in vitro and the development of neoplasms in vivo. More than one-half of human malignancies were shown to contain an altered P53 gene. To gain more insight into the functional role of wild-type P53 in human carcinoma, we constructed recombinant wild-type-pxT1-P53 expression vector. We performed experiments to transfer wild-type P53 gene into human hepatoma cell line(HepG-2) with the calcium phosphate precipitation method. We assessed cell growth properties and the changes of adhesive. The results demonstrated that human wild-type P53 gene can suppress the phenotype of HepG-2 cell line. These results encourage us to do further experiments on tumor cell targeted P53 therapy.
, 百拇医药
Key Words wild-type P53 gene HepG-2 gene therapy
人P53基因是一种抑癌基因,P53蛋白作为一种细胞增殖的负调节因子,控制细胞的生长。该基因的突变、缺失在恶性肿瘤发生发展中起着重要作用[1]。为进一步探讨P53基因的抗肿瘤特性,我们用分子克隆方法构建了人野生型P53(WT-P53)基因真核表达载体(pxT1-P53)[2]。通过磷酸钙介导的贴壁细胞转染法将WT-P53基因导入人肝癌细胞株HepG-2,观察了靶细胞的转化子克隆形成,生长速度及细胞粘附能力的变化。
1 材料与方法
1.1 材料
, http://www.100md.com
1.1.1 重组P53真核表达载体由本室构建、制备及鉴定。RPMI1640培养基购自Gibco公司。G418和MTT购自Sigma公司。多聚左旋赖氨酸及BSA等购于B.M公司。
1.1.2 人肿瘤细胞株HepG-2由重庆医大任红教授惠赠、本室传代保存。
1.2 方法
1.2.1 P53基因导入HepG-2细胞及转化细胞筛选
HepG-2细胞贴壁生长在含10 %~15 %小牛血清及青链霉素的RPMI1640培养液中。细胞培养、克隆筛选及生长测试等均在5%CO2浓度、 饱和湿度及37 ℃培养条件下进行。HepG-2细胞G418筛选浓度为400 ug/ml,维持浓度为200 ug/ml。
, 百拇医药
按文献3介绍的磷酸钙介导的贴壁细胞转染法,将纯化的pxT1-P53转至处于对数生长期的HepG-2细胞,并设未转染细胞作对照。加完全培养基培养48 h,换入含G418的筛选培养基选择培养2~3周(每3~5 d更换培养液),获取G418抗药性细胞,并在G418培养基中扩大培养,分离稳定的转化体作进一步分析用(P53的表达另文发表)。
1.2.2 细胞生长曲线测定
参照文献4取对数生长期的细胞100 ul(2×106/ml),加入96孔板中,每组设三个复孔。置37 ℃,5 %CO2培养48 h后,加入2 ulMTT(5 mg/ml)继续培养4 h,弃上清,每孔加入100 ulDMSO振摇5 min,在Model 550(BIO-RAD公司、美国)酶标仪,630 nm波长下测OD值。
, http://www.100md.com
体外观察HepG-2细胞生长能力时,按文献4方法,将HepG-2和HepG-2-P53以1×104/ml起始浓度5 ml分别加入各相同规格的培养瓶中,每日取1瓶用台盼兰染色汁数活细胞数量。
1.2.3 细胞粘附能力测定
取96孔平底培养板用BSA(30 ug/ml)和多聚左旋赖氨酸(30 ug/ml)预包板作为测定孔和阳性对照孔。置25 ℃,30 min,弃包被液每孔分别加入HepG-2和HepG-2-P53细胞200ul(1.5×105/ml),设三个复孔,37℃培养1 h,0.1M pH7.4PBS洗涤去除非粘附细胞。用甲苯氨兰染色粘附细胞30 min,洗涤晾干后,加100 ul2% SDS溶解细胞染料,630nm波长下用酶标仪测OD值[5]。
2 结果
, http://www.100md.com
2.1 P53基因转染的HepG-2细胞的获取
用磷酸钙介导的贴壁细胞转染法将pxT1-P53重组体导入HepG-2细胞。转染组和正常HepG-2对照组分别加入G418培养液筛选。第3 d后两组细胞均有大量死亡而漂浮于培养基中。电镜观察漂浮细胞有明显的细胞凋亡特征如细胞膜鼓泡、核固缩及凋亡小体出现等。继续用G418培养液维持培养,约4周后转染组细胞较稳定生长,继续培养传代备用。
2.2 基因转染后HepG-2细胞增殖能力
导入WT-P53基因的肝癌细胞(HepG-2+pxT1-P53)生长速度较对照细胞HepG-2明显减慢,结果如图1、2所示。说明P53基因能抑制肝癌细胞生长。

, 百拇医药
图1 MTT法检测HepG-2和HepG-2+pxT1-p53增殖能力的比较

图2 细胞生长曲线
2.3 基因转染后细胞粘附能力观察
本实验观察到P53基因转导后肝癌细胞(Hep-2+pxT1-P53)较对照细胞(HepG-2)的粘附能力减弱(p<0.05),测定结果见图3。

图3 不同组HepG-2细胞的粘附能力
3 讨论
, 百拇医药
我室用分子克隆方法构建了重组野生型P53基因真核表达载体(pxT1-P53),并以肝癌细胞(HepG-2)为研究对象,采用磷酸钙-DNA共沉淀法将pxT1-P53转染至HepG-2细胞内,用Southern blot和免疫荧光法检测P53基因及表达(另文发表)。用MTT法和细胞生长曲线测定法观察到导入野生型P53基因的肝癌细胞其生长速度较对照细胞明显减慢。同时本实验观察到转染有外源性P53基因的HepG-2细胞粘附能力下降。Chang J[6]等报道他们将转染有野生型P53基因的急性淋巴母细胞白血病细胞繁殖成系,发现这些细胞生长速度减慢或倍增时间延长。说明野生型P53基因对肿瘤细胞有一定的抑制作用。
P53基因产生上述生物学效应的机理目前尚未完全明了,可能是导入外源P53基因后靶细胞内的P53蛋白表达增加。P53蛋白作为一种转导因子,能刺激或诱导WAF1/CIP1基因产生21KD蛋白(P21WAF1/CIP1),有野生型P53基因的细胞DNA损伤之后,P21WAF1/CIP1量的增加能抑制促使细胞通过细胞周期和进入有丝分裂的激酶(cdks),因此细胞增殖受到抑制或发生细胞凋亡[7]。笔者曾用细胞凋亡染色和电镜观察到P53基因转染的肿瘤细胞发生凋亡的现象(资料待发)。
, 百拇医药
通过体外实验观察到重组P53基因转染的肝癌HepG-2细胞生长增殖和粘附能力改变,肿瘤细胞生物学活性受到一定的抑制。但肿瘤细胞在体内的生长增殖过程极为复杂,因而有必要进一步实验观察转染细胞在动物体内的免疫学和其他生物学活性状态。
参考文献
1 Chang FJ, Syrijanen S,Kurvinen K efal. The P53 tumor suppressor gen as a common cellular target in human carcinogenesis.Am J Gastroenterol, 1993;88(2):174
2 李仁,任碧轩,杨晓红等.重组P53真核表达载体的构建.川北医学院学报,1998;13(1):1
, 百拇医药 3 Ausubel MF, Brentk, Kingstone ER et al. Short protocols in molecular blalogy, 3rded John wiley % Sons. Inc, USA 1995;1~21
4 韩锐主编.抗癌药物研究与实验技术.北京:北京医大协合医大联合出版社,1997;第一版,284,282
5 钱玉昆主编.实用免疫学新技术.北京:北京医大协合医大联合出版社,1994;43
6 Cheng J, Yee sk, yeargin J et al. Suppression of acute lymphoblastic leukemia by the human wild-type p53 gene. Cancer Res, 1992;52:222
7 Marx J. How p53 suppresses cell growth. Science, 1993;262:1644
(收稿日期:1999-04-08), 百拇医药