重组P53基因在HepG-2中的表达及作用
作者:任碧轩 李仁 冯莉 唐恩洁 杨晓红 赵明才 杨健 张紫福 张艳艳 魏祥云
单位:任碧轩 李 仁 冯 莉 唐恩洁(川北医学院分子生物学研究室 南充 637000);杨晓红 赵明才 杨健(微生物学教研室);张紫福 张艳艳 魏祥云(电镜室)
关键词:重组P53基因、HepG-2细胞、表达
川北医学院学报/990201提 要 为进一步探索正常P53对肿瘤细胞增殖的抑制作用,本文用磷酸钙-DNA共沉淀法,将本室构建的PXT1-P53真核表达细胞转移至HepG-2肝癌细胞系内,经斑点杂交技术和间接免疫荧光技术证实,外源性P53基因已在HepG-2细胞中稳定表达,导入的P53基因亦能抑制HepG-2肝癌细胞系增殖并诱导其凋亡。实验结果提示正常P53基因可成为治疗不同肿瘤的重要靶分子之一。
, http://www.100md.com
文章编号:1005-3697(1999)02-0001-04 中图分类号:R392.2 文献标识码:A
Expression in the HepG-2 and Effect on
HepG-2 of the Recombinant P53 Gene
Ren Bi Xuan, Li Ren, Tang EnJie et al
North Sichuan Medical College
ABSTRACT In order to investigate further(normal P53 gene inhibits the proliferation of Tumor, the recombinant P53 gene was transferred into the HepG-2 cell line using the calcium phosphate-DNA Coprecipitation method. The Dig-P53 probe and anti -P53 were used to analyze the expression in HepG-2 by Dot blot hybridization and indirect immunofluorecent labeling technique. It was confirmed the HepG-2 could express the recombinant P53 gene. Meanwhile, it has been observed that the transferred P53 gene could inhibit the proliferation of HepG-2 and induce the apoptosis of HepG-2. The experimental results suggested normol P53 gene may be an important therapeutic targeting used to treat the different tumors.
, 百拇医药
Key Words recombinant P53 gene HepG-2 cell line
DNA一旦遭受损伤,真核细胞即可使用G1、G2关卡控制系统延迟细胞周期进程。关卡(Check Point)延迟为在S期DNA复制前,M期染色质单体分离前修复损伤的DNA提供了时间。在许多情形下DNA损伤应答途径均是经抑制能加速细胞周期进程的细胞周期依赖蛋白活性而实现的。G1期延迟是因P53活化,继而诱导细胞周期依赖激酶抑制剂—P21等转录的结果[1~2]。野生型P53基因表达产物阻断细胞生长,诱导细胞死亡,抑制肿瘤生长等众多生理功能,已使其成为研究肿瘤分子病理机制的重要靶分子[3]。为进一步探索P53基因对肿瘤细胞生长的影响作用,我室将已构建的PXT1-P53[4],转移至HepG-2细胞系,并观察了P53基因在HepG-2细胞中的表达及作用。
, 百拇医药
1 材料与方法
1.1 扩增、分离、纯化PXT1-P53的方法见文献5。
1.2 将已构建的重组PXT1-P53导入HepG-2细胞(重医大肝炎研究所任红教授赠 ),按文献6介绍的磷酸钙贴壁细胞转染法,将PXT1-P53转移至处于对数生长期的HepG-2细胞内,然后加含G418(400ng/ml)的1640完全培养基,筛选稳定表达P53基因的阳性克隆。
1.3 P53在HePG-2细胞中的表达鉴定
1.3.1 斑点杂交试验
1.3.1.1 制备P53探针:按Rapid DNA Ligation Kit(BM)说明将经BamHI酶切的P53cDNA片段(1.8Kb)连结于BamHI酶切,牛小肠碱性磷酸酶(CIP)去磷酸化的PBluescriptIIKs穿梭载体(PBSKT,2.96Kb)中,再转化XL1-blue,经含Amp,X-gal和IPTG的LB平板筛选含PBSKT-P53的阳性克隆(白色菌落),再扩增,分离PBSKT-P53,经BamHI酶切,低熔点琼脂糖分离、纯化克隆的P53片断,最后按DIG High prime Labeling and Detection Start Kitl说明,标记P53,获得Dig-P53探针。
, 百拇医药
1.3.1.2 分离HepG-2细胞DNA,按常规的蛋白酶K裂解,酚、氯仿抽提纯化,乙醇沉淀浓缩方法,分别分离、纯化转染和未转染P53的HepG-2细胞DNA。
1.3.1.3 斑点杂交(Dot blot)法检测HepG-2细胞中的P53基因。
将HepG-2和HepG-2-P53DNA点于尼龙膜(BM)上,经紫外交叉联结,固定于膜上后,加标准杂交液于58℃预杂交1.5 h,然后加Dig-P53探针杂交3 h,经严格洗涤后再用抗-Dig-AP和NBT/BCIP检测Dig-P53探针。
1.3.2 用间接免疫荧光技术检测P53在HepG-2细胞中的表达方法见文献5。
1.4 P53对HepG-2细胞的影响作用观察。
, 百拇医药
1.4.1 转染P53的HepG-2细胞生长速度测定,按文献8介绍的方法,分别测定转染和未转染P53的HepG-2细胞的生长曲线,然后比较分析其生长速度。
1.4.2 P53诱导HepG-2细胞凋亡观察。
1.4.2.1 形态学观察
1.4.2.1a 用倒置显微镜,透射电镜观察转染和未转染P53的HepG-2细胞形态改变特征,以确定细胞凋亡情况。
1.4.2.1b 荧光显微镜观察:按文献8和9介绍的方法,用双苯咪唑类荧光染料Hoechst33258对HepG-2细胞DNA染色,然后于荧光显微镜下观察染色结果。
1.4.2.2 用琼脂糖凝胶电泳检测DNA降解,按常规方法提取HepG-2细胞DNA,经1%琼脂糖凝胶电泳分离后,置紫外 拍照并观察结果。
, 百拇医药
2 结果
2.1 重组PXT1-P53转染的HepG-2细胞筛选及鉴定结果。
用地高辛标记的P53探针(Dig-P53)与冻存复苏的、G418筛选的抗性HepG-2细胞克隆的DNA进行斑点杂交,再经碱性磷酸酶标记的抗Dig抗体(抗Dig-Ap)和NBT/BCIP显色底物检测,其杂交斑点呈兰灰色;同时采用间接免疫荧光技术亦观察到,G418抗性细胞可与抗P53单抗结合,在荧光显微镜下呈黄绿色荧光,而未转染PXT1-P53的HepG-2细胞斑点杂交和间接免疫荧光均呈阴性反应,表明已获能稳定表达外源性P53基因的HepG-2细胞克隆。
2.2 转染的外源性P53基因对HepG-2细胞影响作用观察。
, 百拇医药
2.2.1 对生长速度影响的观察结果对培养中的HepG-2和HepG-2-P53生长情况观察发现后者生长速度明显较前者缓慢,对比分析生长曲线结果亦表明HepG-2-P53细胞的增殖速度明显减慢,在培养5 d后尤为明显(待发表资料)。
2.2.2 P53诱导HepG-2细胞凋亡的观察结果。
2.2.2a 倒置显微镜观察结果,经倒置显微镜观察到转染P53的HepG-2细胞培养数天后即有部分细胞肿胀、变园,继而脱离瓶壁,漂浮于培养液中。漂浮细胞园缩,胞浆膜明显鼓泡或内陷似将细胞分割成若干园形的小体(见图1),亦可见漏出的少量染色体;未转染P53的细胞也可见少量此现象,但发生凋亡的细胞明显少于转染P53的细胞。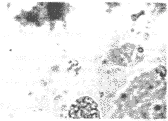
, 百拇医药
图1-1 部分细胞变园,失去与周围细胞粘附的特征(200X)
图1-2 脱离瓶壁的漂浮细胞。(400X)
2.2.2b 透射电镜观察结果见图2 用电镜观察到漂浮细胞多数表现曲型的细胞凋亡特征,如染色质凝固,胞质膜鼓泡,内质网肿胀等,同时亦可见吞噬大量凋亡小体的HepG-2细胞。
图2-1 可见细胞微绒毛脱落染色质凝聚,位于核
周边,内质网肿胀,细胞外似有脱落的凋亡小体(3000X)。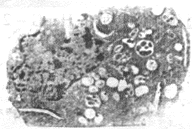
, 百拇医药
图2-2 呈现曲型的细胞质膜鼓泡的形态改变特征(5000X)。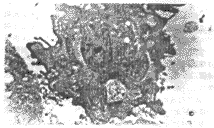
图2-3 胞浆内有大量吞噬的凋亡小体(10000X)
2.2.2c 荧光显微镜观察结果 由图3可见转染P53的漂浮HepG-2细胞经Hoechst 33258染色后,呈非常强的荧光,而未转染P53的细胞经染色后,仅呈微弱荧光。
图3-1 未转染P53的HepG-2细胞,呈现弱荧光(200X)。
图3-2 转染P53的HepG-2细胞,因大量凋亡细胞染色质凝固,且凋亡细胞对Hoechst细胞摄取能力增强,故呈现很强的荧光(200X)。
, 百拇医药
2.2.3 DNA降解片段检测结果 由图4可见转染P53的HepG-2细胞呈现DNA“Ladder”现象(7,8行),8行所呈现的电泳条带较弱,可能因漂浮(F)细胞较少,所获DNA量较少之故,而未转染P53的HepG-2细胞未见DNA断裂现象。
图4 琼脂糖凝胶电泳检测DNA断裂结果。电泳图中第6泳道是未转染P53的HepG-2DNA,无DNA断裂现象,7、8两泳道为转染P53的HepG-2DNA,可见DNA“梯形”特征。
3 讨论
正常P53在细胞周期中的G1关卡作用及其转录因子活性,已使其成为调控细胞增殖的关键分子,几乎所有的肿瘤均可见P53缺失、突变、表达抑制或表达产物在细胞内异位分布等事实,无疑表明正常P53在控制肿瘤发生、发展中具重要作用;同时提示P53肿瘤抑制基因将成为治疗不同肿瘤的共同靶分子[10~12]。难怪Schering公司在1998年内就分别与Transgene SA基因治疗公司和Genezyme Molecular Oncology公司达成了研制P53基因传递系统的2项协议,以便用P53基因治疗肿瘤等疾病;同时该公司目前亦正用P53基因-腺V传递系统进行非小细胞肺癌,头颈癌,子宫癌和肝癌的临床治疗试验[13]。P53抑制肿瘤发生发展的重要机制与其G1关卡作用及转录因子活性有关。P53可通过其G1关卡作用及转录因子活性诱导细胞周期抑制蛋白合成,阻止DNA受损细胞进入S期,从而有助于受损DNA修复,避免异常DNA复制;同时亦可能通过转录因子活性,诱导Fas等凋亡分子表达,从而诱导不能修复受损DNA的细胞凋亡,避免突变细胞增殖,从而阻止肿瘤发生[14],故P53基因异常是恶性肿瘤最常见的现象之一。转染P53的HepG-2细胞生长速度明显减慢及有大量细胞发生凋亡的实验结果不仅证实P53基因确实可抑制突变细胞增殖,诱导肿瘤细胞死亡,同时亦表明恢复P53正常功能,可能将成为治疗肿瘤的重要手段之一。
, 百拇医药
经倒置显微镜观察贴壁的HepG-2细胞凋亡,将经历肿胀、变园、失去与周围细胞的粘附,从瓶壁脱落、漂浮,并出现曲型形态学改变特征一系列过程与Des Jar Dins等观察结果一致[15];表明转染P53的HepG-2细胞亦可作为研究细胞凋亡不同阶段形态和分子变化的细胞模型,同时亦可能成为研究P53诱导细胞凋亡的分子机制的细胞模型。
在本实验中还观察到P53转染细胞在体外培养数天后,不仅产生大量细胞膜完整的凋亡细胞,而且亦可见细胞膜损伤、染色质漏出的现象,该现象是细胞凋亡过程之一或是因细胞坏死所致,尚待进一步确定。
综上所述表明在肿瘤细胞内导入野生型P53基因,恢复P53正常功能,将有助于抑制肿瘤增殖。进一步探索P53抑制肿瘤发生、发展的分子机制,不仅将有助于进一步阐明肿瘤发生的分子病因,而且有助于建立更有效的肿瘤防治手段。
, 百拇医药
参考文献
1 Blasina A, Weyer-VI, Laus CM et al. Current Biology, 1999; Vol 9(1):Research Paper 1~10
2 EI-Diry WA, Tokino T, Veleulesca VE et al:Cell 1993; 75:817~825
3 谭伟等综述,中国肿瘤生物治疗杂志1998;5(3):217~219
4 李仁、任碧轩、杨晓红等.重组P53真核表达载体的构建.川北医学院学报,1998;13(1):1
5 李仁、任碧轩、杨晓红等.重组P53基因表达及其Fas关系初探.川北医学院学报,1998;13(2):1
, 百拇医药
6 Sambrook J, Fritsch FE, Manint is E K et al.Molecular Clouing, A Laboratory, 2nded, Cold Spring Harbor, New York 1989;786~795
7 Ausubel MF Brent K, King-stone ER el al. Short protocols, in Molecular biology, 3rded, John wiley & Sons Inc, USa 1995;1~21
8 韩锐主编.抗癌药物研究与实验技术.北京:北京医科大学,中国协和医科大学联合出版社,1997;第1版,282、393~394
9 Yan GM IRwin PR, Lin sz et al. J.Pharmacology and Experimental Therapeutics, 1995;274(2):983~990
, 百拇医药
10 邱晓彦综述,杨觉贞审阅.国外医学.免疫学分册.1996;3:117~120
11 邱双健综述,叶胜龙校.中国肿瘤生物治疗杂志.1998;5(1):57~59
12 Beaudry AG, Bertelsen HA, Sherman IM et al. Current opinion in biotechnology. 1996;7:592~600
13 黄淑慧译.Biotechnology News. 1998;8(4):1(中国微生物学会通讯、1998;3:9)
14 Oren M, Cell, 1997;90:829~832
15 Des-Jardins ML, MACMANUS PJ
(收稿日期:1999-03-16), http://www.100md.com
单位:任碧轩 李 仁 冯 莉 唐恩洁(川北医学院分子生物学研究室 南充 637000);杨晓红 赵明才 杨健(微生物学教研室);张紫福 张艳艳 魏祥云(电镜室)
关键词:重组P53基因、HepG-2细胞、表达
川北医学院学报/990201提 要 为进一步探索正常P53对肿瘤细胞增殖的抑制作用,本文用磷酸钙-DNA共沉淀法,将本室构建的PXT1-P53真核表达细胞转移至HepG-2肝癌细胞系内,经斑点杂交技术和间接免疫荧光技术证实,外源性P53基因已在HepG-2细胞中稳定表达,导入的P53基因亦能抑制HepG-2肝癌细胞系增殖并诱导其凋亡。实验结果提示正常P53基因可成为治疗不同肿瘤的重要靶分子之一。
, http://www.100md.com
文章编号:1005-3697(1999)02-0001-04 中图分类号:R392.2 文献标识码:A
Expression in the HepG-2 and Effect on
HepG-2 of the Recombinant P53 Gene
Ren Bi Xuan, Li Ren, Tang EnJie et al
North Sichuan Medical College
ABSTRACT In order to investigate further(normal P53 gene inhibits the proliferation of Tumor, the recombinant P53 gene was transferred into the HepG-2 cell line using the calcium phosphate-DNA Coprecipitation method. The Dig-P53 probe and anti -P53 were used to analyze the expression in HepG-2 by Dot blot hybridization and indirect immunofluorecent labeling technique. It was confirmed the HepG-2 could express the recombinant P53 gene. Meanwhile, it has been observed that the transferred P53 gene could inhibit the proliferation of HepG-2 and induce the apoptosis of HepG-2. The experimental results suggested normol P53 gene may be an important therapeutic targeting used to treat the different tumors.
, 百拇医药
Key Words recombinant P53 gene HepG-2 cell line
DNA一旦遭受损伤,真核细胞即可使用G1、G2关卡控制系统延迟细胞周期进程。关卡(Check Point)延迟为在S期DNA复制前,M期染色质单体分离前修复损伤的DNA提供了时间。在许多情形下DNA损伤应答途径均是经抑制能加速细胞周期进程的细胞周期依赖蛋白活性而实现的。G1期延迟是因P53活化,继而诱导细胞周期依赖激酶抑制剂—P21等转录的结果[1~2]。野生型P53基因表达产物阻断细胞生长,诱导细胞死亡,抑制肿瘤生长等众多生理功能,已使其成为研究肿瘤分子病理机制的重要靶分子[3]。为进一步探索P53基因对肿瘤细胞生长的影响作用,我室将已构建的PXT1-P53[4],转移至HepG-2细胞系,并观察了P53基因在HepG-2细胞中的表达及作用。
, 百拇医药
1 材料与方法
1.1 扩增、分离、纯化PXT1-P53的方法见文献5。
1.2 将已构建的重组PXT1-P53导入HepG-2细胞(重医大肝炎研究所任红教授赠 ),按文献6介绍的磷酸钙贴壁细胞转染法,将PXT1-P53转移至处于对数生长期的HepG-2细胞内,然后加含G418(400ng/ml)的1640完全培养基,筛选稳定表达P53基因的阳性克隆。
1.3 P53在HePG-2细胞中的表达鉴定
1.3.1 斑点杂交试验
1.3.1.1 制备P53探针:按Rapid DNA Ligation Kit(BM)说明将经BamHI酶切的P53cDNA片段(1.8Kb)连结于BamHI酶切,牛小肠碱性磷酸酶(CIP)去磷酸化的PBluescriptIIKs穿梭载体(PBSKT,2.96Kb)中,再转化XL1-blue,经含Amp,X-gal和IPTG的LB平板筛选含PBSKT-P53的阳性克隆(白色菌落),再扩增,分离PBSKT-P53,经BamHI酶切,低熔点琼脂糖分离、纯化克隆的P53片断,最后按DIG High prime Labeling and Detection Start Kitl说明,标记P53,获得Dig-P53探针。
, 百拇医药
1.3.1.2 分离HepG-2细胞DNA,按常规的蛋白酶K裂解,酚、氯仿抽提纯化,乙醇沉淀浓缩方法,分别分离、纯化转染和未转染P53的HepG-2细胞DNA。
1.3.1.3 斑点杂交(Dot blot)法检测HepG-2细胞中的P53基因。
将HepG-2和HepG-2-P53DNA点于尼龙膜(BM)上,经紫外交叉联结,固定于膜上后,加标准杂交液于58℃预杂交1.5 h,然后加Dig-P53探针杂交3 h,经严格洗涤后再用抗-Dig-AP和NBT/BCIP检测Dig-P53探针。
1.3.2 用间接免疫荧光技术检测P53在HepG-2细胞中的表达方法见文献5。
1.4 P53对HepG-2细胞的影响作用观察。
, 百拇医药
1.4.1 转染P53的HepG-2细胞生长速度测定,按文献8介绍的方法,分别测定转染和未转染P53的HepG-2细胞的生长曲线,然后比较分析其生长速度。
1.4.2 P53诱导HepG-2细胞凋亡观察。
1.4.2.1 形态学观察
1.4.2.1a 用倒置显微镜,透射电镜观察转染和未转染P53的HepG-2细胞形态改变特征,以确定细胞凋亡情况。
1.4.2.1b 荧光显微镜观察:按文献8和9介绍的方法,用双苯咪唑类荧光染料Hoechst33258对HepG-2细胞DNA染色,然后于荧光显微镜下观察染色结果。
1.4.2.2 用琼脂糖凝胶电泳检测DNA降解,按常规方法提取HepG-2细胞DNA,经1%琼脂糖凝胶电泳分离后,置紫外 拍照并观察结果。
, 百拇医药
2 结果
2.1 重组PXT1-P53转染的HepG-2细胞筛选及鉴定结果。
用地高辛标记的P53探针(Dig-P53)与冻存复苏的、G418筛选的抗性HepG-2细胞克隆的DNA进行斑点杂交,再经碱性磷酸酶标记的抗Dig抗体(抗Dig-Ap)和NBT/BCIP显色底物检测,其杂交斑点呈兰灰色;同时采用间接免疫荧光技术亦观察到,G418抗性细胞可与抗P53单抗结合,在荧光显微镜下呈黄绿色荧光,而未转染PXT1-P53的HepG-2细胞斑点杂交和间接免疫荧光均呈阴性反应,表明已获能稳定表达外源性P53基因的HepG-2细胞克隆。
2.2 转染的外源性P53基因对HepG-2细胞影响作用观察。
, 百拇医药
2.2.1 对生长速度影响的观察结果对培养中的HepG-2和HepG-2-P53生长情况观察发现后者生长速度明显较前者缓慢,对比分析生长曲线结果亦表明HepG-2-P53细胞的增殖速度明显减慢,在培养5 d后尤为明显(待发表资料)。
2.2.2 P53诱导HepG-2细胞凋亡的观察结果。
2.2.2a 倒置显微镜观察结果,经倒置显微镜观察到转染P53的HepG-2细胞培养数天后即有部分细胞肿胀、变园,继而脱离瓶壁,漂浮于培养液中。漂浮细胞园缩,胞浆膜明显鼓泡或内陷似将细胞分割成若干园形的小体(见图1),亦可见漏出的少量染色体;未转染P53的细胞也可见少量此现象,但发生凋亡的细胞明显少于转染P53的细胞。

, 百拇医药
图1-1 部分细胞变园,失去与周围细胞粘附的特征(200X)

图1-2 脱离瓶壁的漂浮细胞。(400X)
2.2.2b 透射电镜观察结果见图2 用电镜观察到漂浮细胞多数表现曲型的细胞凋亡特征,如染色质凝固,胞质膜鼓泡,内质网肿胀等,同时亦可见吞噬大量凋亡小体的HepG-2细胞。

图2-1 可见细胞微绒毛脱落染色质凝聚,位于核
周边,内质网肿胀,细胞外似有脱落的凋亡小体(3000X)。

, 百拇医药
图2-2 呈现曲型的细胞质膜鼓泡的形态改变特征(5000X)。

图2-3 胞浆内有大量吞噬的凋亡小体(10000X)
2.2.2c 荧光显微镜观察结果 由图3可见转染P53的漂浮HepG-2细胞经Hoechst 33258染色后,呈非常强的荧光,而未转染P53的细胞经染色后,仅呈微弱荧光。

图3-1 未转染P53的HepG-2细胞,呈现弱荧光(200X)。
图3-2 转染P53的HepG-2细胞,因大量凋亡细胞染色质凝固,且凋亡细胞对Hoechst细胞摄取能力增强,故呈现很强的荧光(200X)。
, 百拇医药
2.2.3 DNA降解片段检测结果 由图4可见转染P53的HepG-2细胞呈现DNA“Ladder”现象(7,8行),8行所呈现的电泳条带较弱,可能因漂浮(F)细胞较少,所获DNA量较少之故,而未转染P53的HepG-2细胞未见DNA断裂现象。

图4 琼脂糖凝胶电泳检测DNA断裂结果。电泳图中第6泳道是未转染P53的HepG-2DNA,无DNA断裂现象,7、8两泳道为转染P53的HepG-2DNA,可见DNA“梯形”特征。
3 讨论
正常P53在细胞周期中的G1关卡作用及其转录因子活性,已使其成为调控细胞增殖的关键分子,几乎所有的肿瘤均可见P53缺失、突变、表达抑制或表达产物在细胞内异位分布等事实,无疑表明正常P53在控制肿瘤发生、发展中具重要作用;同时提示P53肿瘤抑制基因将成为治疗不同肿瘤的共同靶分子[10~12]。难怪Schering公司在1998年内就分别与Transgene SA基因治疗公司和Genezyme Molecular Oncology公司达成了研制P53基因传递系统的2项协议,以便用P53基因治疗肿瘤等疾病;同时该公司目前亦正用P53基因-腺V传递系统进行非小细胞肺癌,头颈癌,子宫癌和肝癌的临床治疗试验[13]。P53抑制肿瘤发生发展的重要机制与其G1关卡作用及转录因子活性有关。P53可通过其G1关卡作用及转录因子活性诱导细胞周期抑制蛋白合成,阻止DNA受损细胞进入S期,从而有助于受损DNA修复,避免异常DNA复制;同时亦可能通过转录因子活性,诱导Fas等凋亡分子表达,从而诱导不能修复受损DNA的细胞凋亡,避免突变细胞增殖,从而阻止肿瘤发生[14],故P53基因异常是恶性肿瘤最常见的现象之一。转染P53的HepG-2细胞生长速度明显减慢及有大量细胞发生凋亡的实验结果不仅证实P53基因确实可抑制突变细胞增殖,诱导肿瘤细胞死亡,同时亦表明恢复P53正常功能,可能将成为治疗肿瘤的重要手段之一。
, 百拇医药
经倒置显微镜观察贴壁的HepG-2细胞凋亡,将经历肿胀、变园、失去与周围细胞的粘附,从瓶壁脱落、漂浮,并出现曲型形态学改变特征一系列过程与Des Jar Dins等观察结果一致[15];表明转染P53的HepG-2细胞亦可作为研究细胞凋亡不同阶段形态和分子变化的细胞模型,同时亦可能成为研究P53诱导细胞凋亡的分子机制的细胞模型。
在本实验中还观察到P53转染细胞在体外培养数天后,不仅产生大量细胞膜完整的凋亡细胞,而且亦可见细胞膜损伤、染色质漏出的现象,该现象是细胞凋亡过程之一或是因细胞坏死所致,尚待进一步确定。
综上所述表明在肿瘤细胞内导入野生型P53基因,恢复P53正常功能,将有助于抑制肿瘤增殖。进一步探索P53抑制肿瘤发生、发展的分子机制,不仅将有助于进一步阐明肿瘤发生的分子病因,而且有助于建立更有效的肿瘤防治手段。
, 百拇医药
参考文献
1 Blasina A, Weyer-VI, Laus CM et al. Current Biology, 1999; Vol 9(1):Research Paper 1~10
2 EI-Diry WA, Tokino T, Veleulesca VE et al:Cell 1993; 75:817~825
3 谭伟等综述,中国肿瘤生物治疗杂志1998;5(3):217~219
4 李仁、任碧轩、杨晓红等.重组P53真核表达载体的构建.川北医学院学报,1998;13(1):1
5 李仁、任碧轩、杨晓红等.重组P53基因表达及其Fas关系初探.川北医学院学报,1998;13(2):1
, 百拇医药
6 Sambrook J, Fritsch FE, Manint is E K et al.Molecular Clouing, A Laboratory, 2nded, Cold Spring Harbor, New York 1989;786~795
7 Ausubel MF Brent K, King-stone ER el al. Short protocols, in Molecular biology, 3rded, John wiley & Sons Inc, USa 1995;1~21
8 韩锐主编.抗癌药物研究与实验技术.北京:北京医科大学,中国协和医科大学联合出版社,1997;第1版,282、393~394
9 Yan GM IRwin PR, Lin sz et al. J.Pharmacology and Experimental Therapeutics, 1995;274(2):983~990
, 百拇医药
10 邱晓彦综述,杨觉贞审阅.国外医学.免疫学分册.1996;3:117~120
11 邱双健综述,叶胜龙校.中国肿瘤生物治疗杂志.1998;5(1):57~59
12 Beaudry AG, Bertelsen HA, Sherman IM et al. Current opinion in biotechnology. 1996;7:592~600
13 黄淑慧译.Biotechnology News. 1998;8(4):1(中国微生物学会通讯、1998;3:9)
14 Oren M, Cell, 1997;90:829~832
15 Des-Jardins ML, MACMANUS PJ
(收稿日期:1999-03-16), http://www.100md.com