胰腺腺泡细胞钙超负荷在诱发大鼠由水肿性向坏死性胰腺炎转变中的作用
作者:蒲青凡 严律南 沈骥 刘占培 谭建三 左凤琼 吴兆锋
单位:610041 成都,华西医科大学附属第一医院普外科[蒲青凡(现四川省攀枝花市攀钢密地医院外科617063)、严律南、刘占培],公共卫生学院(谭建三),基础医学院(左凤琼,吴兆锋),四川省卫生干部管理学院(沈骥)
关键词:胰腺炎;动物,实验;钙;Ca2+转运ATP酶
中华医学杂志990220 【摘要】 目的 研究急性水肿性胰腺炎(AEP)向坏死性胰腺炎(ANP)转变中胰腺腺泡细胞钙超负荷情况。方法 将96只SD大鼠随机分3组:Ⅰ组33只(假手术组)。Ⅱ组33只(AEP组):采用胰管结扎及静脉注射蛙皮素(100 μg/kg)、促胰液素(10 μg/kg)诱发AEP。Ⅲ组30只(ANP组):在AEP模型同时静注质量浓度为10%高分子右旋糖酐(500 mg/kg)诱发ANP。应用荧光探针Fura2研究钙超负荷情况。结果 AEP模型后1,3,6小时腺泡细胞胞浆游离钙离子浓度持续增高,1小时为(180±17)nmol/L,6小时为(219±15)nmol/L;ANP组由1小时 (213±19)nmol/L,上升为6小时(464± 29)nmol/L,与假手术组比差异有显著意义(P<0.05)。而胰腺细胞质膜Ca2+-ATP酶活性持续降低,AEP组1小时为(52.0±1.9)nmol.min-1..mg蛋白-1,9小时降为(34.5 ±2.6)nmol.min-1..mg蛋白-1;ANP组1小时为(29.8±0.4)nmol.min-1..mg蛋白-1,9小时降为(18.6 ±0.5) nmol.min-1..mg蛋白-1,与假手术组比P<0.05。结论 在局部缺血促发AEP向ANP转变过程中存在胰腺泡细胞钙超负荷,胰腺细胞质膜Ca2+-ATP酶活性降低可能是引起AEP向ANP转变过程中细胞钙超负荷的重要原因。
, http://www.100md.com
Effects of calcium overload in the conversion of acute edematous pancreatitis to necrotizing pancreatitis in rats PU Qingfan,YAN Lünan, SHEN Ji, et al. Department of General Surgery, First University Hospital, West China University of Medical Sciences, Chengdu 610041
【Abstract】 Objective To investigate the potential of pancreatic acinar cell calcium overload in the conversion of acute edematous pancreatitis (AEP) to necrotizing pancreatitis (ANP). Methods Ninety-six Sprague-Dawley rats were randomized in three experimental groups. Sham-operated control (Group Ⅰ) AEP (Group Ⅱ) was induced by pancreatic duct ligation and intravenous injection of bombesin (100 μg/kg) and secretin (10 μg/kg). ANP (Group Ⅲ) was induced same as group Ⅱ but with a large dose of dextran 110, 000(500 mg/kg) intravenously. Pancreatic acinar cell Ca2+ overload was studied using fluorescent probe Fura2. Cytosolic free Ca2+ concentration ([Ca2+]i) in isolated pancreatic acinar cells and Ca2+-ATPase activity in pancreatic cell plasma membranes were determined 1, 3, 6, 9h respectively after treatment. Results The results showed that pancreatic acinar cell [Ca2+]i was elevated at 1h[(213±19) nmol/L, P<0.05] and increased to (464±29) nmol/L at 6h(P<0.05) in rats with ANP, pancreatic cell plasma membrane Ca2+-ATPase activity decreased significantly from (29.8±0.4)nmol*min-1*mgp-1 at 1h to (18.6±0.5) nmol*min-1*mgp-1 at 9h in rats with ANP (P<0.05). Conclusions In ischemia-induced conversion of AEP to ANP, there exists Ca2+ overload in the pancreatic acinar cells. The decreased pancreatic cell plasma membrane Ca2+-ATPase activity may be an important reason for acinar cell Ca2+ overload in the development of acute pancreatitis.
, 百拇医药
【Key words】 Pancreatitis Animals, Laboratory Calcium Ca2+-Transporting
(Natl Med J China, 1999, 79:143-145)
急性胰腺炎(AP)其发病机理尚未完全阐明。目前,有关AP早期的病理机制主要包括胰腺缺血、氧自由基作用、前列腺素类平衡失调、钙离子内流及腺泡细胞损害。近来的研究表明,细胞钙超负荷是细胞损害的一条共同途径[1]。本实验应用新一代荧光探针Fura2直接测定AP发展过程中腺泡细胞胞浆游离钙离子浓度([Ca2+]i)变化,初步探讨其在水肿性向坏死性胰腺炎转变中作用机理。
材料和方法
一、材料
, 百拇医药
1.实验动物分组:SD大鼠96只,体重180~250 g雌雄各半,随机分为3组:(1)假手术组33只;(2)水肿性胰腺炎(AEP)组33只;(3)坏死性胰腺炎(ANP)组30只。
2.动物模型的制作:所有大鼠术前禁食12小时,自由饮水。戊巴比妥钠(30 mg / kg)腹腔麻醉,上腹正中切口,分别结扎距肝门和近十二指肠0.5 cm处胰胆管。假手术组剖腹后仅轻轻翻动胰腺。术后假手术组经尾静脉注射等量生理盐水。AEP组经尾静脉注射蛙皮素(Bombesin ,美国Sigma公司生产)100μg/kg+促胰液素(Secretin,美国Sigma公司生产)10 μg/kg 。ANP组在AEP模型上同时经尾静脉注射10%高分子右旋糖酐(Dextran-110,瑞士Fluka公司生产)500 mg/kg。
二、方法
1.胰腺腺泡细胞[Ca2+]i测定:模型制作后0、1、3、6,小时分别处死切取胰组织,参考Zhou等[2] 法并改良。胰腺间质内多点注射消化液(含0.2 g/L Ⅺ型胶原酶和0.4 g/L透明质酸酶的Hanks平衡盐溶液)。37℃振荡水浴温孵10分钟,通以95% O2+5% CO2混合气体。更换消化液再温孵10分钟,剪碎组织并轻轻吹打10分钟。200目铜网过滤,50 r/min离心3分钟,去除上清液,Hanks平衡盐溶液(HBSS液)(含0.25%牛血清白蛋白和0.01%大豆胰蛋白酶抑制因子)洗涤2次。将腺泡细胞混悬于无钙HBSS液中。经台盼蓝排斥试验证实细胞存活在90%以上,计数在106~1010个细胞/ml间。在4 ml无钙HBSS腺泡细胞混悬液中加入1 mmol/L Fura2/AM 10 μl(中国医科院药物所提供),温孵20分钟。用无钙HBSS液洗涤2次,重新混悬于4 ml不含牛血清白蛋白和Ca2+的HBSS液中立即行荧光测定。采用岛津RF-5000型双波长荧光分光光度计,在发射波长510 nm、激发波长340 nm/380 nm时,测定腺泡细胞的荧光比值。同步计算出[Ca2+]i[3]。
, 百拇医药
2.胰腺细胞质膜Ca2+-ATP酶活性测定:称取胰组织并剪碎,加入3倍体积预冷匀浆缓冲液(含10 mmol/L Tris - HCl、PH 7.4,0.1 mmol/L EGTA,0.1 mmol/L PMSF,1 mmol/L巯基乙醇,10%蔗糖),匀浆后稀释至10 ml,四层纱布过滤,500r/min离心10分钟,上清液15 000r/min、4℃离心3 0 分钟,同等条件洗涤一次,提取胰腺细胞质膜,采用孔雀绿比色法测定Ca2+-ATP酶活性。
3.病理学检查:模型后3、9小时留取胰组织,质量浓度为20%甲醛固定,常规石蜡制片,HE染色,光镜观察。
4.统计学处理:采用SPSS/PC+软件行方差分析,数值用均数±标准误(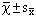 )表示。
)表示。
, http://www.100md.com
结 果
1.胰腺腺泡细胞[Ca2+]i变化:结果见表1。
表1 三组动物模型后胰腺泡细胞[Ca2+]i浓度变化(nmol/L,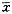 ±s) 组别
±s) 组别
鼠数
时间
0h
1h
3h
6h
, http://www.100md.com 假手术组
9
160±9
163±13
168±10
173±14
AEP组
9
160±9
180±17
176±19
219±15*
ANP组
, 百拇医药
8
160±9
213±19*△
311±12*△
464±29*△
* 与假手术组比较,P<0.05;△ 与AEP比较和组内不同时段比较,P<0.05
2.胰腺细胞质膜Ca2+-ATP酶活性变化:结果见表2。
表2 胰腺细胞质膜Ca2+-ATP酶活性变化(Pi nmol.min-1.mg蛋白-1,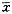 ±s) 组别
±s) 组别
, http://www.100md.com
鼠数
时间
1h
3h
6h
9h
假手术
6
31.4±0.2
30.6±0.1
29.1±0.4
31.2±0.3
AEP
, http://www.100md.com
6
50.0±1.9*
42.8±1.0*
44.0±2.6*
34.5±2.6
ANP
6
29.8±0.4**
26.8±1.0**△
24.7±0.8**△
, 百拇医药
18.6±0.5**△
* 与假手术组比较P<0.05,** 与AEP比较P<0.05,△ 组内不同时段比较P<0.05
3.胰组织病理变化:AEP组第3、9小时胰腺间质水肿,炎细胞浸润。ANP组第3、9小时胰实质出血和坏死常见,小静脉扩张、瘀血、粒细胞聚集、粘附。
讨 论
血液粘度上升,红细胞变形性下降并趋向聚集等一系列血液流变学异常是ANP 时胰腺缺血的重要原因;在大鼠AEP模型基础上,静脉推注10% Dextran-110人为造成血液流变学异常,可促发AEP向ANP转变[4]。
, 百拇医药 胰腺微血管系统缺乏交通是构成AP早期即可出现微循环异常的解剖学基础[5]。有学者认为,AP作为一种炎症过程,其局部与全身效应的机制是缺血-再灌流损害,因此,胰腺缺血可能是AP发展过程中的持续损害因素。Ca2+被认为在介导缺血性细胞损害中发挥重要作用[1]。实验证明,高钙血症及Ca2+内流致细胞钙超负荷与AP形态学损害有关[6]。应用钙通道阻滞剂异搏定则能阻止实验性AP的进一步发展[7]。
胰腺泡细胞在静息状态下,[Ca2+]i稳定在150 nmol/L水平,刺激状态时,[Ca2+]i 呈波动性变化, 分泌发生时,[Ca2+]i增加在280 nmol/L水平以上, 随后很快恢复到刺激前的水平[8]。本实验发现,ANP模型后胰腺泡细胞[Ca2+]i持续增高,6小时高达463.7 6 nmol/L水平。结果表明,在局部缺血促发AEP向 ANP 转变过程中,胰腺泡细胞钙超负荷随病程变化逐渐加重。
, 百拇医药
腺泡细胞依赖其[Ca2+]i稳态的各种调节机制维持细胞膜内外Ca2+巨大的电化学梯度(104倍)。研究表明,Ca2+-ATP酶在维持胰腺泡细胞钙稳态的调节机制中发挥主要作用[9]。本研究发现,AEP时胰腺细胞质膜Ca2+-ATP酶活性呈代偿性增加而后回复到基础水平,ANP时与腺泡细胞[Ca2+]i 进行性增高相对应,Ca2+-ATP酶活性呈低于基础水平的下降趋势。结果表明,胰腺细胞质膜Ca2+-ATP酶活性降低可能是引起AEP向ANP转变过程中细胞钙超负荷的重要原因。
[Ca2+]i的持续增高是许多病理生理过程的启动因素。如激活依赖Ca2+的磷脂酶A2,加速膜磷脂的降解及血管活性物质的释放;Ca2+可与胰蛋白酶原活性肽(TAP)结合,引起胰蛋白酶原自身活化增强,启动胰酶链反应促使腺泡细胞的自身消化。本实验结果说明,细胞钙超负荷介导胰腺缺血性损害可能在AEP向ANP转变过程中发挥重要作用。为此,我们认为在改善微循环防止胰腺炎缺血性损害的过程中,同时应用钙通道阻滞剂可能有助于中止AEP向ANP转变。
, http://www.100md.com
本课题为国家自然科学基金资助项目
参考文献
1 Cheung JY, Bonventre JV, Malis CD, et al. Mechanism of disease: calcium and ischemic injury. Engl J Med, 1986, 314:1670-1676.
2 Zhou W, Levine BA, Olson MS. Patelet-activating factor: a mediator of pancreatic inflammation during cerulein hyperstimulation. Am J Pathol, 1993, 142:1504-1512.
3 Grynleiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indications with greatly inproved fluorescence properties. J Biol Chem, 1985, 260:3440-3450.
, 百拇医药
4 Yan L, Liu X, Tan J, et al. Effect of haemorrheological changes in the transition of oedematous pancreatitis to necrosis. Asian J Surgery, 1995, 18:106-113.
5 Bockman DE, Microvasculature of the pancreas relation to pancreatitis. Int J Pancreatol, 1992, 12:11-21.
6 Mithofer K, Fernandez-del Castillo C, Frick TW, et al. Acute hypercalcemia cause acute pancreatitis and ectopic trypsinogen activation in the rat. Gastroenterology, 1995, 109:239-246.
, 百拇医药
7 Shen J, Zhao S, Teng C, et al. Calcium channel blockade protects against the development of experimental acute pancreatitis in rats: effects of verapamil on pancreatic blood flow and plasma arachidonic acid metabolites. Med Sci Res, 1991, 19:667-669.
8 Ochs DL, Korenbrot JI, Williams JA. Relation between free cytosolic calcium and amylase release by pancreatic acini. Am J Physiol, 1985, 249:G389-398.
9 Muallem S. Calcium transport pathways of pancreatic acinar cells. Annu Rev Physiol, 1989, 51:83-105.
(收稿:1998-02-14 修回:1998-10-12), 百拇医药
单位:610041 成都,华西医科大学附属第一医院普外科[蒲青凡(现四川省攀枝花市攀钢密地医院外科617063)、严律南、刘占培],公共卫生学院(谭建三),基础医学院(左凤琼,吴兆锋),四川省卫生干部管理学院(沈骥)
关键词:胰腺炎;动物,实验;钙;Ca2+转运ATP酶
中华医学杂志990220 【摘要】 目的 研究急性水肿性胰腺炎(AEP)向坏死性胰腺炎(ANP)转变中胰腺腺泡细胞钙超负荷情况。方法 将96只SD大鼠随机分3组:Ⅰ组33只(假手术组)。Ⅱ组33只(AEP组):采用胰管结扎及静脉注射蛙皮素(100 μg/kg)、促胰液素(10 μg/kg)诱发AEP。Ⅲ组30只(ANP组):在AEP模型同时静注质量浓度为10%高分子右旋糖酐(500 mg/kg)诱发ANP。应用荧光探针Fura2研究钙超负荷情况。结果 AEP模型后1,3,6小时腺泡细胞胞浆游离钙离子浓度持续增高,1小时为(180±17)nmol/L,6小时为(219±15)nmol/L;ANP组由1小时 (213±19)nmol/L,上升为6小时(464± 29)nmol/L,与假手术组比差异有显著意义(P<0.05)。而胰腺细胞质膜Ca2+-ATP酶活性持续降低,AEP组1小时为(52.0±1.9)nmol.min-1..mg蛋白-1,9小时降为(34.5 ±2.6)nmol.min-1..mg蛋白-1;ANP组1小时为(29.8±0.4)nmol.min-1..mg蛋白-1,9小时降为(18.6 ±0.5) nmol.min-1..mg蛋白-1,与假手术组比P<0.05。结论 在局部缺血促发AEP向ANP转变过程中存在胰腺泡细胞钙超负荷,胰腺细胞质膜Ca2+-ATP酶活性降低可能是引起AEP向ANP转变过程中细胞钙超负荷的重要原因。
, http://www.100md.com
Effects of calcium overload in the conversion of acute edematous pancreatitis to necrotizing pancreatitis in rats PU Qingfan,YAN Lünan, SHEN Ji, et al. Department of General Surgery, First University Hospital, West China University of Medical Sciences, Chengdu 610041
【Abstract】 Objective To investigate the potential of pancreatic acinar cell calcium overload in the conversion of acute edematous pancreatitis (AEP) to necrotizing pancreatitis (ANP). Methods Ninety-six Sprague-Dawley rats were randomized in three experimental groups. Sham-operated control (Group Ⅰ) AEP (Group Ⅱ) was induced by pancreatic duct ligation and intravenous injection of bombesin (100 μg/kg) and secretin (10 μg/kg). ANP (Group Ⅲ) was induced same as group Ⅱ but with a large dose of dextran 110, 000(500 mg/kg) intravenously. Pancreatic acinar cell Ca2+ overload was studied using fluorescent probe Fura2. Cytosolic free Ca2+ concentration ([Ca2+]i) in isolated pancreatic acinar cells and Ca2+-ATPase activity in pancreatic cell plasma membranes were determined 1, 3, 6, 9h respectively after treatment. Results The results showed that pancreatic acinar cell [Ca2+]i was elevated at 1h[(213±19) nmol/L, P<0.05] and increased to (464±29) nmol/L at 6h(P<0.05) in rats with ANP, pancreatic cell plasma membrane Ca2+-ATPase activity decreased significantly from (29.8±0.4)nmol*min-1*mgp-1 at 1h to (18.6±0.5) nmol*min-1*mgp-1 at 9h in rats with ANP (P<0.05). Conclusions In ischemia-induced conversion of AEP to ANP, there exists Ca2+ overload in the pancreatic acinar cells. The decreased pancreatic cell plasma membrane Ca2+-ATPase activity may be an important reason for acinar cell Ca2+ overload in the development of acute pancreatitis.
, 百拇医药
【Key words】 Pancreatitis Animals, Laboratory Calcium Ca2+-Transporting
(Natl Med J China, 1999, 79:143-145)
急性胰腺炎(AP)其发病机理尚未完全阐明。目前,有关AP早期的病理机制主要包括胰腺缺血、氧自由基作用、前列腺素类平衡失调、钙离子内流及腺泡细胞损害。近来的研究表明,细胞钙超负荷是细胞损害的一条共同途径[1]。本实验应用新一代荧光探针Fura2直接测定AP发展过程中腺泡细胞胞浆游离钙离子浓度([Ca2+]i)变化,初步探讨其在水肿性向坏死性胰腺炎转变中作用机理。
材料和方法
一、材料
, 百拇医药
1.实验动物分组:SD大鼠96只,体重180~250 g雌雄各半,随机分为3组:(1)假手术组33只;(2)水肿性胰腺炎(AEP)组33只;(3)坏死性胰腺炎(ANP)组30只。
2.动物模型的制作:所有大鼠术前禁食12小时,自由饮水。戊巴比妥钠(30 mg / kg)腹腔麻醉,上腹正中切口,分别结扎距肝门和近十二指肠0.5 cm处胰胆管。假手术组剖腹后仅轻轻翻动胰腺。术后假手术组经尾静脉注射等量生理盐水。AEP组经尾静脉注射蛙皮素(Bombesin ,美国Sigma公司生产)100μg/kg+促胰液素(Secretin,美国Sigma公司生产)10 μg/kg 。ANP组在AEP模型上同时经尾静脉注射10%高分子右旋糖酐(Dextran-110,瑞士Fluka公司生产)500 mg/kg。
二、方法
1.胰腺腺泡细胞[Ca2+]i测定:模型制作后0、1、3、6,小时分别处死切取胰组织,参考Zhou等[2] 法并改良。胰腺间质内多点注射消化液(含0.2 g/L Ⅺ型胶原酶和0.4 g/L透明质酸酶的Hanks平衡盐溶液)。37℃振荡水浴温孵10分钟,通以95% O2+5% CO2混合气体。更换消化液再温孵10分钟,剪碎组织并轻轻吹打10分钟。200目铜网过滤,50 r/min离心3分钟,去除上清液,Hanks平衡盐溶液(HBSS液)(含0.25%牛血清白蛋白和0.01%大豆胰蛋白酶抑制因子)洗涤2次。将腺泡细胞混悬于无钙HBSS液中。经台盼蓝排斥试验证实细胞存活在90%以上,计数在106~1010个细胞/ml间。在4 ml无钙HBSS腺泡细胞混悬液中加入1 mmol/L Fura2/AM 10 μl(中国医科院药物所提供),温孵20分钟。用无钙HBSS液洗涤2次,重新混悬于4 ml不含牛血清白蛋白和Ca2+的HBSS液中立即行荧光测定。采用岛津RF-5000型双波长荧光分光光度计,在发射波长510 nm、激发波长340 nm/380 nm时,测定腺泡细胞的荧光比值。同步计算出[Ca2+]i[3]。
, 百拇医药
2.胰腺细胞质膜Ca2+-ATP酶活性测定:称取胰组织并剪碎,加入3倍体积预冷匀浆缓冲液(含10 mmol/L Tris - HCl、PH 7.4,0.1 mmol/L EGTA,0.1 mmol/L PMSF,1 mmol/L巯基乙醇,10%蔗糖),匀浆后稀释至10 ml,四层纱布过滤,500r/min离心10分钟,上清液15 000r/min、4℃离心3 0 分钟,同等条件洗涤一次,提取胰腺细胞质膜,采用孔雀绿比色法测定Ca2+-ATP酶活性。
3.病理学检查:模型后3、9小时留取胰组织,质量浓度为20%甲醛固定,常规石蜡制片,HE染色,光镜观察。
4.统计学处理:采用SPSS/PC+软件行方差分析,数值用均数±标准误(
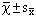 )表示。
)表示。, http://www.100md.com
结 果
1.胰腺腺泡细胞[Ca2+]i变化:结果见表1。
表1 三组动物模型后胰腺泡细胞[Ca2+]i浓度变化(nmol/L,
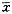 ±s) 组别
±s) 组别鼠数
时间
0h
1h
3h
6h
, http://www.100md.com 假手术组
9
160±9
163±13
168±10
173±14
AEP组
9
160±9
180±17
176±19
219±15*
ANP组
, 百拇医药
8
160±9
213±19*△
311±12*△
464±29*△
* 与假手术组比较,P<0.05;△ 与AEP比较和组内不同时段比较,P<0.05
2.胰腺细胞质膜Ca2+-ATP酶活性变化:结果见表2。
表2 胰腺细胞质膜Ca2+-ATP酶活性变化(Pi nmol.min-1.mg蛋白-1,
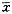 ±s) 组别
±s) 组别, http://www.100md.com
鼠数
时间
1h
3h
6h
9h
假手术
6
31.4±0.2
30.6±0.1
29.1±0.4
31.2±0.3
AEP
, http://www.100md.com
6
50.0±1.9*
42.8±1.0*
44.0±2.6*
34.5±2.6
ANP
6
29.8±0.4**
26.8±1.0**△
24.7±0.8**△
, 百拇医药
18.6±0.5**△
* 与假手术组比较P<0.05,** 与AEP比较P<0.05,△ 组内不同时段比较P<0.05
3.胰组织病理变化:AEP组第3、9小时胰腺间质水肿,炎细胞浸润。ANP组第3、9小时胰实质出血和坏死常见,小静脉扩张、瘀血、粒细胞聚集、粘附。
讨 论
血液粘度上升,红细胞变形性下降并趋向聚集等一系列血液流变学异常是ANP 时胰腺缺血的重要原因;在大鼠AEP模型基础上,静脉推注10% Dextran-110人为造成血液流变学异常,可促发AEP向ANP转变[4]。
, 百拇医药 胰腺微血管系统缺乏交通是构成AP早期即可出现微循环异常的解剖学基础[5]。有学者认为,AP作为一种炎症过程,其局部与全身效应的机制是缺血-再灌流损害,因此,胰腺缺血可能是AP发展过程中的持续损害因素。Ca2+被认为在介导缺血性细胞损害中发挥重要作用[1]。实验证明,高钙血症及Ca2+内流致细胞钙超负荷与AP形态学损害有关[6]。应用钙通道阻滞剂异搏定则能阻止实验性AP的进一步发展[7]。
胰腺泡细胞在静息状态下,[Ca2+]i稳定在150 nmol/L水平,刺激状态时,[Ca2+]i 呈波动性变化, 分泌发生时,[Ca2+]i增加在280 nmol/L水平以上, 随后很快恢复到刺激前的水平[8]。本实验发现,ANP模型后胰腺泡细胞[Ca2+]i持续增高,6小时高达463.7 6 nmol/L水平。结果表明,在局部缺血促发AEP向 ANP 转变过程中,胰腺泡细胞钙超负荷随病程变化逐渐加重。
, 百拇医药
腺泡细胞依赖其[Ca2+]i稳态的各种调节机制维持细胞膜内外Ca2+巨大的电化学梯度(104倍)。研究表明,Ca2+-ATP酶在维持胰腺泡细胞钙稳态的调节机制中发挥主要作用[9]。本研究发现,AEP时胰腺细胞质膜Ca2+-ATP酶活性呈代偿性增加而后回复到基础水平,ANP时与腺泡细胞[Ca2+]i 进行性增高相对应,Ca2+-ATP酶活性呈低于基础水平的下降趋势。结果表明,胰腺细胞质膜Ca2+-ATP酶活性降低可能是引起AEP向ANP转变过程中细胞钙超负荷的重要原因。
[Ca2+]i的持续增高是许多病理生理过程的启动因素。如激活依赖Ca2+的磷脂酶A2,加速膜磷脂的降解及血管活性物质的释放;Ca2+可与胰蛋白酶原活性肽(TAP)结合,引起胰蛋白酶原自身活化增强,启动胰酶链反应促使腺泡细胞的自身消化。本实验结果说明,细胞钙超负荷介导胰腺缺血性损害可能在AEP向ANP转变过程中发挥重要作用。为此,我们认为在改善微循环防止胰腺炎缺血性损害的过程中,同时应用钙通道阻滞剂可能有助于中止AEP向ANP转变。
, http://www.100md.com
本课题为国家自然科学基金资助项目
参考文献
1 Cheung JY, Bonventre JV, Malis CD, et al. Mechanism of disease: calcium and ischemic injury. Engl J Med, 1986, 314:1670-1676.
2 Zhou W, Levine BA, Olson MS. Patelet-activating factor: a mediator of pancreatic inflammation during cerulein hyperstimulation. Am J Pathol, 1993, 142:1504-1512.
3 Grynleiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indications with greatly inproved fluorescence properties. J Biol Chem, 1985, 260:3440-3450.
, 百拇医药
4 Yan L, Liu X, Tan J, et al. Effect of haemorrheological changes in the transition of oedematous pancreatitis to necrosis. Asian J Surgery, 1995, 18:106-113.
5 Bockman DE, Microvasculature of the pancreas relation to pancreatitis. Int J Pancreatol, 1992, 12:11-21.
6 Mithofer K, Fernandez-del Castillo C, Frick TW, et al. Acute hypercalcemia cause acute pancreatitis and ectopic trypsinogen activation in the rat. Gastroenterology, 1995, 109:239-246.
, 百拇医药
7 Shen J, Zhao S, Teng C, et al. Calcium channel blockade protects against the development of experimental acute pancreatitis in rats: effects of verapamil on pancreatic blood flow and plasma arachidonic acid metabolites. Med Sci Res, 1991, 19:667-669.
8 Ochs DL, Korenbrot JI, Williams JA. Relation between free cytosolic calcium and amylase release by pancreatic acini. Am J Physiol, 1985, 249:G389-398.
9 Muallem S. Calcium transport pathways of pancreatic acinar cells. Annu Rev Physiol, 1989, 51:83-105.
(收稿:1998-02-14 修回:1998-10-12), 百拇医药