胆红素诱导大鼠小脑颗粒神经元凋亡的研究
作者:林穗珍 李晓瑜 颜光美
单位:510080 广州,中山医科大学附属第一医院儿科(林穗珍、李晓瑜);中山医科大学药理教研室(颜光美)
关键词:胆红素;大鼠;神经元;脱噬作用
中华医学杂志990215 【摘要】 目的 从细胞与分子水平探讨胆红素神经毒性的机制。方法 采用原代培养的大鼠小脑颗粒和大脑皮质神经元,观察胆红素对其毒性的影响。并用 DNA染色及琼脂糖凝胶电泳法确定胆红素诱导神经元死亡时的形态学及生物化学改变的特征。结果 胆红素在0~17 μmol/L的浓度下,选择性地、剂量与时间依赖性地诱导小脑颗粒神经元死亡,呈现凋亡的特征为:核染色质浓缩与 DNA双链断裂成小片段;在凝胶电泳图上呈“梯形”样改变;用RNA和蛋白质合成抑制剂预处理神经元,可阻断其死亡。说明胆红素诱导小脑神经元死亡的过程需要蛋白质的合成。而此浓度的胆红素对大脑皮质神经元的毒性明显低于小脑神经元。结论 胆红素可以选择性地诱导小脑颗粒神经元凋亡。
, 百拇医药
Bilirubin induced apoptosis of cerebellar granule neurons LIN Suizhen, LI Xiaoyu,YAN Guangmei. Department of Pediatrics, Fist Affiliated Hospital, Department of Pharmacology, Sun Yat-Sen University of Medical Sciences, Guangzhou 510080
【Abstract】 Objective To investigate the mechanism of bilirubin-induced neurotoxicity from cellular and molecular level. Methods Bilirubin was exposed to primary cultured rat cerebellar granule and cortical neurons and its neurotoxicity was observed DNA staining and agars gel electrophores were used to identify the biochemical and morphological features of bilirubin-induced neurotoxicity in cultured cerebellar granule and cortical neurons.Results Bilirubin selectively induced death of cerebellar granule neurons in a concentration-and time-dependent manner. Neuronal death displayed biochemical and morphological features of apoptotic nuclei: condensation of nuclear chromatin and DNA fragmentation. RNA and protein synthesis inhibitors blocked the neurotoxicity induced by bilirubin. However, the cortical neurons displayed a relative insensitivity to bilirubin.Conclusions Bilirubin induced neuron death is an active process, requiring de novo synthesis of RNA and protein. Bilirubinmay selectively induce apoptosis of cerebellar granule neurons.
, 百拇医药
【Key words】 Bilirubin Rats Neurons Apoptosis
(Natl Med J China, 1999,79:125-128)
大量的临床报道表明胆红素脑病严重损害新生儿的中枢神经系统,如脑性瘫痪、智力低下及听力障碍等[1]。Takagishi[2] 还发现患先天性葡萄糖醛酸转移酶缺陷症的Gunn鼠,小脑发育不全,高度萎缩。胆红素脑病为什么会遗留永久性残疾的机制尚未清楚。本研究采用培养的新生大鼠小脑颗粒神经元和大脑皮质神经元,研究了胆红素神经毒性的作用机制,现报道如下。
材料与方法
一、材料
1.动物:生后8天的SD大鼠, 体重 15~20 g,雌雄不分。由中山医科大学实验动物中心提供。
, http://www.100md.com
2.试剂:基础Eagles培养基(BME)、神经细胞基础培养基和B27无血清添加剂购于美国GIBGO公司,Hoechst 33258购于美国Molecular Probes公司,间接胆红素及其它药物均购于美国 Sigma公司。
二、方法
1.小脑颗粒神经元的培养:参照文献[3]。取生后第 8天SD大鼠小脑,在胰酶和DNase 作用下分散细胞, 种植于多聚赖氨酸包被的培养皿中,培养液为BME。接种后24小时加入10 μmol/L的阿糖胞苷抑制胶质细胞生长,使神经元的纯化率为95%以上。
2.大脑皮质神经元的培养:取孕16~18天SD大鼠胚胎的大脑皮质,经质量浓度为0.5 g/L胰酶消化后,加入质量浓度为0.5 g/L胰酶抑制剂和50 mg/L DNA酶以终止消化,离心去上清,细胞在Pauk′s Saline A 液中上下吹打,再离心去上清,将细胞加入含体积分数为0.1胎牛血清的Neuronbasal培养基内,以6×105个/ml的密度种植在上述包被好的培养皿中。为使神经元纯化,在种植72小时后,更换含有B27(50×,体积分数为0.02)的无血清培养基。培养基内不加抗生素。
, 百拇医药
3.神经元存活率的测定:取培养后第 8天或给药24小时后的神经元, 去培养液, 加入只有活细胞才能摄取的二乙酸荧光素10 mg/L 5分钟,用冷磷酸盐缓冲液清洗细胞2次后,用荧光多孔板读机(美国Perseptive Biosystems公司产品),选激发波长485 nm,发射波长535 nm,取荧光强度值代表细胞生存率(%)。其荧光强度值与细胞生存率呈正相关 ( r2=0.991 )。
4.细胞内胆红素荧光的测定:用第 8天的各类型细胞,加入17 μmol/L的胆红素3小时后,清除胞外胆红素,在显微荧光成像系统的倒置荧光显微镜下(40倍),以激发波长440 nm,发射波长535 nm,测定每个细胞内胆红素所发出的荧光强度,代表细胞内含胆红素的量。体外不同浓度的胆红素与荧光强度呈正相关(r2=0.981)。
5.形态学方法: Hoechst 33258染色法是最常用、最可靠的细胞凋亡的定性法之一。参照文献[3],移去神经元的培养基,用质量浓度为0.4 g/L的多聚甲醛液固定后,加入Hoechst 33258 (5 mg/L)染色 5分钟,清洗、干燥。在显微镜下观察,并拍照。
, 百拇医药
6.琼脂糖凝胶电泳法:细胞染色体DNA在琼脂糖凝胶电泳中出现“梯形”分布被公认是细胞凋亡的重要标志之一,方法参照文献[3]。
三、统计学分析处理
测量数据为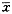 ±s,显著性分析采用ANOVA及SNK-q检验 (用SPSS统计软件包)。
±s,显著性分析采用ANOVA及SNK-q检验 (用SPSS统计软件包)。
结 果
一、胆红素选择性地诱导小脑颗粒神经元死亡
用培养了8天的小脑颗粒神经元,分别给予低于生理浓度(0~17 μmol/L)的胆红素,24小时后测神经元的存活率。发现,胆红素剂量依赖性地诱导小脑颗粒神经元死亡在5 μmol/L和 17 μmol/L浓度时,神经元的存活率分别为50%和2%。选用5 μmol/L的浓度,分别在给药后8、16、24、48和72小时,测定神经元的存活率,其存活率分别为77%、65%、51%、19%和5%。说明胆红素对小脑颗粒神经元的毒性又呈时间依赖性。用同样的剂量和方法处理大脑皮质神经元,发现大脑皮质神经元对胆红素的毒性明显低于小脑神经元(图1~4)。为明确小脑神经元对胆红素的毒性为什么高于大脑神经元,在加入胆红素3小时后,分别测定小脑颗粒神经元和大脑皮质神经元内胆红素的浓度,发现小脑颗粒神经元(165个细胞)内的胆红素浓度明显高于大脑皮质神经元(121个细胞,P<0.01)。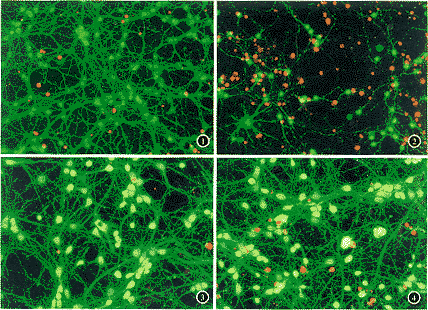
, http://www.100md.com
图1~4 显示出神经元的生存状况及形态学变化,二乙酸荧光素染活细胞,显出绿色;碘化丙啶染死细胞,显出红色.图1,3分别为小脑颗粒和大脑皮质神经元对照组 ×20(图2,4同);图2,4分别为小脑颗粒和大脑皮质神经元的胆红素(5μmol/L)处理组
二、将胆红素诱导小脑颗粒神经元的死亡定性为凋亡
用琼脂糖凝胶电泳法,对给予胆红素5 μmol/L后6小时的细胞,离心取 DNA,进行电泳,结果在胆红素组,见明显的DNA“梯形”,而分别给予 RNA 合成抑制剂放线菌素D 0.1 mg/L 和蛋白质合成抑制剂放线菌酮1.0 mg/L预处理细胞2小时后给予胆红素,结果DNA“梯形”样改变消失(图5)。预先给予上述两种抑制剂预处理组的神经元存活率明显高于单独胆红素组(P<0.01)。经Hoechst 33258 染色的细胞,正常对照组核形态较大,染色质密度低而均匀,而经过胆红素处理的细胞,染色质浓缩,甚至核碎裂(图6)。经过放线菌素D和放线菌酮预处理组,核形态类似正常对照组。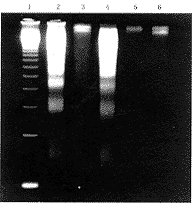
, http://www.100md.com
1.DNA标准;2.阳性对照组(地塞米松处理的胸腺细胞);3.正常对照;4.胆红素处理组;5.放线菌素D+胆红素组;6.放线菌酮+胆红素组
图5 胆红素诱导小脑颗粒神经元DNA变化的电泳分析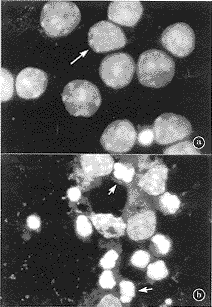
a. 正常对照组;b. 胆红素组(长箭头示正常细胞核,短箭头示凋亡细胞核);标尺=10 μm
图6 Hoechst 33258 DNA染色分析核形态学变化
讨 论
细胞死亡存在两种机制,一是由基因编码的细胞程序性死亡又称凋亡,如生理性或某些病理性刺激,启动了凋亡基因,诱导细胞的凋亡。另一种是由于意外损伤或病理刺激,产生细胞的急性肿胀,膜破裂而死亡,称之为坏死[4]。细胞凋亡是一种细胞自发性选择死亡的现象,它与细胞坏死的区别在于:凋亡是生理性的、主动的、非炎症性的。其表现主要有3个特征:(1)形态学特征:表现为细胞皱缩,染色质浓缩, DNA裂解,有凋亡小体等(图6)。(2)生物化学特征:表现为染色质的有控降解,DNA双链在核小体之间断裂成不连续的、以 180~200 bp为最小单位的片段, 凝胶电泳呈梯状图象(图5)。(3)有新蛋白质合成,一旦预先阻断 RNA和蛋白质的合成,便可阻断凋亡的发生,这一特征被看作为细胞凋亡是一个主动过程的证据。有研究表明,在人类免疫系统发育过程中,有90%~99%的胸腺细胞发生凋亡。在神经系统的发育过程中有 50 %以上的神经元发生凋亡。也有迹象表明, 如果诱导凋亡的基因突变或缺失,细胞凋亡被抑制,便会产生肿瘤等恶性疾病[5]。相反,如细胞凋亡过盛可能导致某些退行性疾病,如老年性痴呆、帕金森氏病等[6]。本研究发现, 体内自身产生的胆红素可直接诱导小脑颗粒神经元死亡,结果示核染色质浓缩、DNA断裂、凝胶电泳图上见“梯形”样变。用RNA和蛋白质合成抑制剂预处理神经元后,可对抗胆红素的作用。说明胆红素诱导的神经元死亡需要合成蛋白质[7],提示这种死亡是一种主动的需要基因启动的凋亡过程。推测胆红素进入小脑颗粒细胞后,诱导凋亡基因的表达,然后合成了一种“杀死”蛋白, 导致神经元的“自杀”死亡。但不同的神经元可能对胆红素摄取的量或敏感性不同,本结果证明大脑皮质神经元对胆红素的毒性作用低于小脑神经元。本研究解释了为什么新生儿胆红素脑病会遗留下永久性的神经系统障碍,并且主要是锥体外系的损害,而小脑是锥体外系的主要部分。同时也解释了先天性葡萄糖醛酸转移酶缺乏的Gunn鼠,为什么会小脑高度萎缩。但胆红素诱导了什么基因的表达及其基因的调控是如何进行的?怎样拮抗胆红素诱导神经元凋亡的过程,尚有待于进一步研究。
, http://www.100md.com
本课题为国家自然科学基金(39770782)和广东省自然科学基金资助项目(970052)
参考文献 1 黄德珉.如何降低早期新生儿高胆红素血症的发病率、病死率和致残率.中华儿科杂志,1996,34:219-220.
2 Takagishi Y. Development of cerebellar hypoplasia in jaundiced gunn rats: a morphological study. Cong Anom,1989,29:275-294.
3 Yan GM, Irwin R P, Lin SZ, et al. Diphenylhydantoin induces apoptotic cell death of cultured rat cerebellar granule neurons. J Pharmaco Exp Ther,1995,274:983-990.
, http://www.100md.com
4 Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science, 1995, 267:1456-1462.
5 Hollstein M, Sidransky D, Vogelstein B, et al. P53 mutation in human cancers. Science,1991,258:49-53.
6 Loo DT, Copani A, Pike CJ, et al. Apoptosis is induced by beta-amyloid in cultured central nervous system neurons. Proc Natl Acad Sci USA, 1993, 90:7951-7955.
7 Greenberg ME, Hermanowski AL, Ziff EB. Effect of protein synthesis inhibitors on growth factor activation of c-fos, c-myc and actin gene transcription. Mol Cell Biol, 1986, 6:1050-1057.
(收稿:1998-03-24 修回:1998-09-01), 百拇医药
单位:510080 广州,中山医科大学附属第一医院儿科(林穗珍、李晓瑜);中山医科大学药理教研室(颜光美)
关键词:胆红素;大鼠;神经元;脱噬作用
中华医学杂志990215 【摘要】 目的 从细胞与分子水平探讨胆红素神经毒性的机制。方法 采用原代培养的大鼠小脑颗粒和大脑皮质神经元,观察胆红素对其毒性的影响。并用 DNA染色及琼脂糖凝胶电泳法确定胆红素诱导神经元死亡时的形态学及生物化学改变的特征。结果 胆红素在0~17 μmol/L的浓度下,选择性地、剂量与时间依赖性地诱导小脑颗粒神经元死亡,呈现凋亡的特征为:核染色质浓缩与 DNA双链断裂成小片段;在凝胶电泳图上呈“梯形”样改变;用RNA和蛋白质合成抑制剂预处理神经元,可阻断其死亡。说明胆红素诱导小脑神经元死亡的过程需要蛋白质的合成。而此浓度的胆红素对大脑皮质神经元的毒性明显低于小脑神经元。结论 胆红素可以选择性地诱导小脑颗粒神经元凋亡。
, 百拇医药
Bilirubin induced apoptosis of cerebellar granule neurons LIN Suizhen, LI Xiaoyu,YAN Guangmei. Department of Pediatrics, Fist Affiliated Hospital, Department of Pharmacology, Sun Yat-Sen University of Medical Sciences, Guangzhou 510080
【Abstract】 Objective To investigate the mechanism of bilirubin-induced neurotoxicity from cellular and molecular level. Methods Bilirubin was exposed to primary cultured rat cerebellar granule and cortical neurons and its neurotoxicity was observed DNA staining and agars gel electrophores were used to identify the biochemical and morphological features of bilirubin-induced neurotoxicity in cultured cerebellar granule and cortical neurons.Results Bilirubin selectively induced death of cerebellar granule neurons in a concentration-and time-dependent manner. Neuronal death displayed biochemical and morphological features of apoptotic nuclei: condensation of nuclear chromatin and DNA fragmentation. RNA and protein synthesis inhibitors blocked the neurotoxicity induced by bilirubin. However, the cortical neurons displayed a relative insensitivity to bilirubin.Conclusions Bilirubin induced neuron death is an active process, requiring de novo synthesis of RNA and protein. Bilirubinmay selectively induce apoptosis of cerebellar granule neurons.
, 百拇医药
【Key words】 Bilirubin Rats Neurons Apoptosis
(Natl Med J China, 1999,79:125-128)
大量的临床报道表明胆红素脑病严重损害新生儿的中枢神经系统,如脑性瘫痪、智力低下及听力障碍等[1]。Takagishi[2] 还发现患先天性葡萄糖醛酸转移酶缺陷症的Gunn鼠,小脑发育不全,高度萎缩。胆红素脑病为什么会遗留永久性残疾的机制尚未清楚。本研究采用培养的新生大鼠小脑颗粒神经元和大脑皮质神经元,研究了胆红素神经毒性的作用机制,现报道如下。
材料与方法
一、材料
1.动物:生后8天的SD大鼠, 体重 15~20 g,雌雄不分。由中山医科大学实验动物中心提供。
, http://www.100md.com
2.试剂:基础Eagles培养基(BME)、神经细胞基础培养基和B27无血清添加剂购于美国GIBGO公司,Hoechst 33258购于美国Molecular Probes公司,间接胆红素及其它药物均购于美国 Sigma公司。
二、方法
1.小脑颗粒神经元的培养:参照文献[3]。取生后第 8天SD大鼠小脑,在胰酶和DNase 作用下分散细胞, 种植于多聚赖氨酸包被的培养皿中,培养液为BME。接种后24小时加入10 μmol/L的阿糖胞苷抑制胶质细胞生长,使神经元的纯化率为95%以上。
2.大脑皮质神经元的培养:取孕16~18天SD大鼠胚胎的大脑皮质,经质量浓度为0.5 g/L胰酶消化后,加入质量浓度为0.5 g/L胰酶抑制剂和50 mg/L DNA酶以终止消化,离心去上清,细胞在Pauk′s Saline A 液中上下吹打,再离心去上清,将细胞加入含体积分数为0.1胎牛血清的Neuronbasal培养基内,以6×105个/ml的密度种植在上述包被好的培养皿中。为使神经元纯化,在种植72小时后,更换含有B27(50×,体积分数为0.02)的无血清培养基。培养基内不加抗生素。
, 百拇医药
3.神经元存活率的测定:取培养后第 8天或给药24小时后的神经元, 去培养液, 加入只有活细胞才能摄取的二乙酸荧光素10 mg/L 5分钟,用冷磷酸盐缓冲液清洗细胞2次后,用荧光多孔板读机(美国Perseptive Biosystems公司产品),选激发波长485 nm,发射波长535 nm,取荧光强度值代表细胞生存率(%)。其荧光强度值与细胞生存率呈正相关 ( r2=0.991 )。
4.细胞内胆红素荧光的测定:用第 8天的各类型细胞,加入17 μmol/L的胆红素3小时后,清除胞外胆红素,在显微荧光成像系统的倒置荧光显微镜下(40倍),以激发波长440 nm,发射波长535 nm,测定每个细胞内胆红素所发出的荧光强度,代表细胞内含胆红素的量。体外不同浓度的胆红素与荧光强度呈正相关(r2=0.981)。
5.形态学方法: Hoechst 33258染色法是最常用、最可靠的细胞凋亡的定性法之一。参照文献[3],移去神经元的培养基,用质量浓度为0.4 g/L的多聚甲醛液固定后,加入Hoechst 33258 (5 mg/L)染色 5分钟,清洗、干燥。在显微镜下观察,并拍照。
, 百拇医药
6.琼脂糖凝胶电泳法:细胞染色体DNA在琼脂糖凝胶电泳中出现“梯形”分布被公认是细胞凋亡的重要标志之一,方法参照文献[3]。
三、统计学分析处理
测量数据为
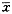 ±s,显著性分析采用ANOVA及SNK-q检验 (用SPSS统计软件包)。
±s,显著性分析采用ANOVA及SNK-q检验 (用SPSS统计软件包)。结 果
一、胆红素选择性地诱导小脑颗粒神经元死亡
用培养了8天的小脑颗粒神经元,分别给予低于生理浓度(0~17 μmol/L)的胆红素,24小时后测神经元的存活率。发现,胆红素剂量依赖性地诱导小脑颗粒神经元死亡在5 μmol/L和 17 μmol/L浓度时,神经元的存活率分别为50%和2%。选用5 μmol/L的浓度,分别在给药后8、16、24、48和72小时,测定神经元的存活率,其存活率分别为77%、65%、51%、19%和5%。说明胆红素对小脑颗粒神经元的毒性又呈时间依赖性。用同样的剂量和方法处理大脑皮质神经元,发现大脑皮质神经元对胆红素的毒性明显低于小脑神经元(图1~4)。为明确小脑神经元对胆红素的毒性为什么高于大脑神经元,在加入胆红素3小时后,分别测定小脑颗粒神经元和大脑皮质神经元内胆红素的浓度,发现小脑颗粒神经元(165个细胞)内的胆红素浓度明显高于大脑皮质神经元(121个细胞,P<0.01)。

, http://www.100md.com
图1~4 显示出神经元的生存状况及形态学变化,二乙酸荧光素染活细胞,显出绿色;碘化丙啶染死细胞,显出红色.图1,3分别为小脑颗粒和大脑皮质神经元对照组 ×20(图2,4同);图2,4分别为小脑颗粒和大脑皮质神经元的胆红素(5μmol/L)处理组
二、将胆红素诱导小脑颗粒神经元的死亡定性为凋亡
用琼脂糖凝胶电泳法,对给予胆红素5 μmol/L后6小时的细胞,离心取 DNA,进行电泳,结果在胆红素组,见明显的DNA“梯形”,而分别给予 RNA 合成抑制剂放线菌素D 0.1 mg/L 和蛋白质合成抑制剂放线菌酮1.0 mg/L预处理细胞2小时后给予胆红素,结果DNA“梯形”样改变消失(图5)。预先给予上述两种抑制剂预处理组的神经元存活率明显高于单独胆红素组(P<0.01)。经Hoechst 33258 染色的细胞,正常对照组核形态较大,染色质密度低而均匀,而经过胆红素处理的细胞,染色质浓缩,甚至核碎裂(图6)。经过放线菌素D和放线菌酮预处理组,核形态类似正常对照组。

, http://www.100md.com
1.DNA标准;2.阳性对照组(地塞米松处理的胸腺细胞);3.正常对照;4.胆红素处理组;5.放线菌素D+胆红素组;6.放线菌酮+胆红素组
图5 胆红素诱导小脑颗粒神经元DNA变化的电泳分析

a. 正常对照组;b. 胆红素组(长箭头示正常细胞核,短箭头示凋亡细胞核);标尺=10 μm
图6 Hoechst 33258 DNA染色分析核形态学变化
讨 论
细胞死亡存在两种机制,一是由基因编码的细胞程序性死亡又称凋亡,如生理性或某些病理性刺激,启动了凋亡基因,诱导细胞的凋亡。另一种是由于意外损伤或病理刺激,产生细胞的急性肿胀,膜破裂而死亡,称之为坏死[4]。细胞凋亡是一种细胞自发性选择死亡的现象,它与细胞坏死的区别在于:凋亡是生理性的、主动的、非炎症性的。其表现主要有3个特征:(1)形态学特征:表现为细胞皱缩,染色质浓缩, DNA裂解,有凋亡小体等(图6)。(2)生物化学特征:表现为染色质的有控降解,DNA双链在核小体之间断裂成不连续的、以 180~200 bp为最小单位的片段, 凝胶电泳呈梯状图象(图5)。(3)有新蛋白质合成,一旦预先阻断 RNA和蛋白质的合成,便可阻断凋亡的发生,这一特征被看作为细胞凋亡是一个主动过程的证据。有研究表明,在人类免疫系统发育过程中,有90%~99%的胸腺细胞发生凋亡。在神经系统的发育过程中有 50 %以上的神经元发生凋亡。也有迹象表明, 如果诱导凋亡的基因突变或缺失,细胞凋亡被抑制,便会产生肿瘤等恶性疾病[5]。相反,如细胞凋亡过盛可能导致某些退行性疾病,如老年性痴呆、帕金森氏病等[6]。本研究发现, 体内自身产生的胆红素可直接诱导小脑颗粒神经元死亡,结果示核染色质浓缩、DNA断裂、凝胶电泳图上见“梯形”样变。用RNA和蛋白质合成抑制剂预处理神经元后,可对抗胆红素的作用。说明胆红素诱导的神经元死亡需要合成蛋白质[7],提示这种死亡是一种主动的需要基因启动的凋亡过程。推测胆红素进入小脑颗粒细胞后,诱导凋亡基因的表达,然后合成了一种“杀死”蛋白, 导致神经元的“自杀”死亡。但不同的神经元可能对胆红素摄取的量或敏感性不同,本结果证明大脑皮质神经元对胆红素的毒性作用低于小脑神经元。本研究解释了为什么新生儿胆红素脑病会遗留下永久性的神经系统障碍,并且主要是锥体外系的损害,而小脑是锥体外系的主要部分。同时也解释了先天性葡萄糖醛酸转移酶缺乏的Gunn鼠,为什么会小脑高度萎缩。但胆红素诱导了什么基因的表达及其基因的调控是如何进行的?怎样拮抗胆红素诱导神经元凋亡的过程,尚有待于进一步研究。
, http://www.100md.com
本课题为国家自然科学基金(39770782)和广东省自然科学基金资助项目(970052)
参考文献 1 黄德珉.如何降低早期新生儿高胆红素血症的发病率、病死率和致残率.中华儿科杂志,1996,34:219-220.
2 Takagishi Y. Development of cerebellar hypoplasia in jaundiced gunn rats: a morphological study. Cong Anom,1989,29:275-294.
3 Yan GM, Irwin R P, Lin SZ, et al. Diphenylhydantoin induces apoptotic cell death of cultured rat cerebellar granule neurons. J Pharmaco Exp Ther,1995,274:983-990.
, http://www.100md.com
4 Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science, 1995, 267:1456-1462.
5 Hollstein M, Sidransky D, Vogelstein B, et al. P53 mutation in human cancers. Science,1991,258:49-53.
6 Loo DT, Copani A, Pike CJ, et al. Apoptosis is induced by beta-amyloid in cultured central nervous system neurons. Proc Natl Acad Sci USA, 1993, 90:7951-7955.
7 Greenberg ME, Hermanowski AL, Ziff EB. Effect of protein synthesis inhibitors on growth factor activation of c-fos, c-myc and actin gene transcription. Mol Cell Biol, 1986, 6:1050-1057.
(收稿:1998-03-24 修回:1998-09-01), 百拇医药