ELISA法定量检测长春新碱诱导的K562及K562/VCR凋亡
作者:朱玉胜 吕元 林果为 张荣兴 吕沅冈 杨正洪 顾静文
单位:200040 上海医科大学华山医院(朱玉胜、吕元、林果为、顾静文)
关键词:
上海医学990217 中国科学院上海细胞库(张荣兴、吕沅冈、杨正洪) 细胞凋亡是一种不同于细胞坏死的细胞死亡方式,具有特殊的形态学及生物化学特征。其生物化学变化主要表现为内源性核酸内切酶的激活。它依赖于Ca2+、Mg2+的核酸内切酶从核小体间连接处将双链DNA切断,形成以180bp为最小单位的DNA片断,经琼脂糖电泳分离后形成“DNA梯子”,故可用琼脂糖电泳法检测细胞凋亡,但此方法只能进行定性分析,而无法对细胞凋亡进行定量检测。本试验采用ELISA法检测凋亡细胞组蛋白-DNA片断,并将测定结果与流式细胞仪PI染色法进行了比较。
材料与方法
, http://www.100md.com
一、材料
(一) 试剂与仪器 1. 试剂:ELISAPLUS细胞凋亡检测试剂盒(德国宝灵曼公司,Cat.No.1774425);2. 药物:长春新碱硫酸盐(VCR广州明兴制药厂);3. 仪器:BIO-TEK EL312E自动酶标分析仪。
(二) 细胞株 人类白血病细胞株K562,由中科院细胞库提供。耐药细胞K562/VCR由中国医学科学院血液学研究所提供。K562/VCR可在含1μg/ml VCR的培养基中稳定增殖,对足叶乙甙、柔红霉素、阿霉素等亦有耐药性[1]。K562培养用RPMI1640(Gibco)培养基(含10%小牛血清、青霉素、链霉素各100U/ml),5%CO2,37℃培养箱中培养。K562/VCR培养条件同K562,仅培养基中另加1μg/ml VCR。K562/VCR于试验前脱药培养四代。取指数增长期细胞试验。
, 百拇医药
(三) 基本原理 本法为双抗体夹心ELISA法,生物素标记的鼠抗组蛋白单克隆抗体与包被在酶标板上的链霉亲和素结合而固定于酶标板上,待测组蛋白-DNA片断中的组蛋白与抗组蛋白抗体结合。同时组蛋白-DNA片断中的DNA与过氧化物酶标记的抗DNA抗体结合,过氧化物酶催化底物ABTS而显色。
二、方法
将指数生长期细胞K562及K562/VCR用培养基稀释成1×105/ml,各取100μl细胞悬液分别加入到100μl VCR浓度分别为0、0.002、0.02μg/ml的培养基中,混合均匀,各管中VCR最终浓度分别为0、0.001、0.01μg/ml。于5%CO2,37℃培养箱中培养24小时。离心10分钟,每分钟200转,弃上清液。细胞沉淀加200μl细胞裂解液,室温下孵育30分钟,离心10分钟,每分钟200转。取上清液各20μl于酶标板各孔中,另一孔加20μl组蛋白-DNA复合物作为阳性对照。各孔中加80μl免疫反应混合物(生物素标记抗组蛋白抗体:过氧化物酶标记抗DNA抗体:孵育缓冲液=1∶1∶18,临用前配制),混匀,盖上封片,室温下振荡反应2小时。倾去各孔内液体,加250μl孵育缓冲液洗涤各孔,共洗3次。加100μl底物液,另加一孔底物液作为比色空白对照。于室温下振荡反应10分钟。采用双波长比色法测定(主波长405nm,参考波长490nm)。组蛋白-DNA片断含量以吸光度表示。用流式细胞仪PI染色法检测VCR诱导的K562及K562/VCR凋亡(另文发表)。
, 百拇医药
三、统计学分析采用t检验及相关性分析,试验重复3次,结果以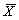 ±s表示。
±s表示。
结 果
一、K562经不同浓度VCR诱导24小时后,细胞内组蛋白-DNA片断含量的变化
当VCR浓度为0、0.001、0.01μg/ml时,ELISA法测得K562吸光度值分别为0.132±0.025、0.214±0.020及0.600±0.066,表明K562内组蛋白-DNA片断含量随VCR浓度升高而增加。
二、K562/VCR经不同浓度VCR诱导24小时后,细胞内组蛋白-DNA片段含量的变化
当VCR浓度为0、0.001、0.01μg/ml时,测得K562/VCR吸光度值分别为0.138±0.056、0.148±0.036、0.184±0.046,表明K562/VCR内组蛋白-DNA片段含量随VCR浓度变化不明显。
, 百拇医药
三、K562及K562/VCR经不同浓度VCR诱导24小时后,细胞内组蛋白-DNA片段含量的比较
统计学分析显示,当VCR浓度为0、0.001μg/ml时,K562及K562/VCR内组蛋白-DNA片段含量无显著性差异(n=3,P>0.05),但当VCR浓度达0.01μg/ml时,K562及K562/VCR间组蛋白-DNA片段含量有极显著性差异(n=3,P<0.01),表明在此VCR浓度下,K562凋亡程度高于K562/VCR。
四、ELISA法与流式细胞仪PI染色法(FCM)测定VCR诱导的K562及K562/VCR凋亡的结果比较
见表1。
表1 ELISA法与FCM法测定结果的比较 (n=6) VCR浓度
(μg/ml)
, http://www.100md.com
K562
K562/VCR
ELISA
FCM(%)
ELISA
FCM(%)
0
0.132±0.025
4.10±0.17
0.138±0.056
3.61±0.69
0.001
, http://www.100md.com
0.214±0.020
13.30±3.74
0.148±0.036
9.06±4.24
0.01
0.600±0.066
36.48±6.70
0.184±0.046
10.45±3.71
相关性分析表明,ELISA法与FCM法测得结果呈高度相关,相关系数r=0.99(n=6,P<0.0005)。讨 论
, 百拇医药 本课题组曾用流式细胞仪PI染色法及TUNEL法对VCR诱导K562及耐药细胞K562/VCR凋亡进行研究,发现在相同条件下,K562比K562/VCR更容易诱导凋亡,表明抗凋亡作用增强可能在肿瘤细胞多药耐药过程中起重要作用。本试验采用ELISA法检测凋亡细胞内因内源性核酸内切酶激活而产生的组蛋白-DNA片段,定量分析VCR诱导的K562及K562/VCR凋亡,结果与以上结论完全符合。统计学分析表明,ELISA法与流式细胞仪PI染色法测定结果有很好的相关性,且ELISA法不需要流式细胞仪之类的大型仪器,因此在对细胞凋亡进行定量分析方面非常简便、实用[2,3]。
过去对凋亡细胞内产生的DNA片段分析常采用的方法是琼脂糖DNA电泳法。该方法需要繁琐的DNA分离步骤及电泳分离,且只能进行定性分析,而ELISA法操作较为简便(一步法),整个分析过程仅需3小时,并且可以进行定量分析,故ELISA法可替代琼脂糖DNA电泳法。ELISA法定量分析细胞凋亡的其它优点还包括:不使用放射性核素,可用于体内新鲜分离的肿瘤细胞的检测,所采用的单克隆抗体无种属特异性,可分析不同种属来源的细胞,方法的检测敏感性较好,可分析1000个细胞内的组蛋白-DNA片段的含量,试剂的稳定性也较好。
, http://www.100md.com
本试验对原方法进行了一些改进,原方法用微孔培养板进行细胞培养,分离细胞时需用特殊的微孔板离心机。本试验采用微量小试管进行细胞培养,用普通离心机分离细胞,方法简便,分离细胞效果好。
参考文献
[1] 张淑清,冯敏,殷建林,等.多药耐药细胞系K562及K562/VCR的建立及其生物学特性的研究.中华血液学杂志,1992,13:622.
[2] Ealovega M W, McGinnis P K, Summantran V N, et al. Bcl-Xs gene therapy induces apoptosis of human mammry tumors in nude mice. Cancer Res,1996,56:1965.
[3] Sumantran V N, Ealovega M W, Gabriel N, et al. Overexpression of bcl-Xs sensitizes MCF-7 cells to chemotherapy-induced apoptosis. Cancer Res, 1995,55:2507.
(收稿:1998-09-07), http://www.100md.com
单位:200040 上海医科大学华山医院(朱玉胜、吕元、林果为、顾静文)
关键词:
上海医学990217 中国科学院上海细胞库(张荣兴、吕沅冈、杨正洪) 细胞凋亡是一种不同于细胞坏死的细胞死亡方式,具有特殊的形态学及生物化学特征。其生物化学变化主要表现为内源性核酸内切酶的激活。它依赖于Ca2+、Mg2+的核酸内切酶从核小体间连接处将双链DNA切断,形成以180bp为最小单位的DNA片断,经琼脂糖电泳分离后形成“DNA梯子”,故可用琼脂糖电泳法检测细胞凋亡,但此方法只能进行定性分析,而无法对细胞凋亡进行定量检测。本试验采用ELISA法检测凋亡细胞组蛋白-DNA片断,并将测定结果与流式细胞仪PI染色法进行了比较。
材料与方法
, http://www.100md.com
一、材料
(一) 试剂与仪器 1. 试剂:ELISAPLUS细胞凋亡检测试剂盒(德国宝灵曼公司,Cat.No.1774425);2. 药物:长春新碱硫酸盐(VCR广州明兴制药厂);3. 仪器:BIO-TEK EL312E自动酶标分析仪。
(二) 细胞株 人类白血病细胞株K562,由中科院细胞库提供。耐药细胞K562/VCR由中国医学科学院血液学研究所提供。K562/VCR可在含1μg/ml VCR的培养基中稳定增殖,对足叶乙甙、柔红霉素、阿霉素等亦有耐药性[1]。K562培养用RPMI1640(Gibco)培养基(含10%小牛血清、青霉素、链霉素各100U/ml),5%CO2,37℃培养箱中培养。K562/VCR培养条件同K562,仅培养基中另加1μg/ml VCR。K562/VCR于试验前脱药培养四代。取指数增长期细胞试验。
, 百拇医药
(三) 基本原理 本法为双抗体夹心ELISA法,生物素标记的鼠抗组蛋白单克隆抗体与包被在酶标板上的链霉亲和素结合而固定于酶标板上,待测组蛋白-DNA片断中的组蛋白与抗组蛋白抗体结合。同时组蛋白-DNA片断中的DNA与过氧化物酶标记的抗DNA抗体结合,过氧化物酶催化底物ABTS而显色。
二、方法
将指数生长期细胞K562及K562/VCR用培养基稀释成1×105/ml,各取100μl细胞悬液分别加入到100μl VCR浓度分别为0、0.002、0.02μg/ml的培养基中,混合均匀,各管中VCR最终浓度分别为0、0.001、0.01μg/ml。于5%CO2,37℃培养箱中培养24小时。离心10分钟,每分钟200转,弃上清液。细胞沉淀加200μl细胞裂解液,室温下孵育30分钟,离心10分钟,每分钟200转。取上清液各20μl于酶标板各孔中,另一孔加20μl组蛋白-DNA复合物作为阳性对照。各孔中加80μl免疫反应混合物(生物素标记抗组蛋白抗体:过氧化物酶标记抗DNA抗体:孵育缓冲液=1∶1∶18,临用前配制),混匀,盖上封片,室温下振荡反应2小时。倾去各孔内液体,加250μl孵育缓冲液洗涤各孔,共洗3次。加100μl底物液,另加一孔底物液作为比色空白对照。于室温下振荡反应10分钟。采用双波长比色法测定(主波长405nm,参考波长490nm)。组蛋白-DNA片断含量以吸光度表示。用流式细胞仪PI染色法检测VCR诱导的K562及K562/VCR凋亡(另文发表)。
, 百拇医药
三、统计学分析采用t检验及相关性分析,试验重复3次,结果以
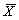 ±s表示。
±s表示。结 果
一、K562经不同浓度VCR诱导24小时后,细胞内组蛋白-DNA片断含量的变化
当VCR浓度为0、0.001、0.01μg/ml时,ELISA法测得K562吸光度值分别为0.132±0.025、0.214±0.020及0.600±0.066,表明K562内组蛋白-DNA片断含量随VCR浓度升高而增加。
二、K562/VCR经不同浓度VCR诱导24小时后,细胞内组蛋白-DNA片段含量的变化
当VCR浓度为0、0.001、0.01μg/ml时,测得K562/VCR吸光度值分别为0.138±0.056、0.148±0.036、0.184±0.046,表明K562/VCR内组蛋白-DNA片段含量随VCR浓度变化不明显。
, 百拇医药
三、K562及K562/VCR经不同浓度VCR诱导24小时后,细胞内组蛋白-DNA片段含量的比较
统计学分析显示,当VCR浓度为0、0.001μg/ml时,K562及K562/VCR内组蛋白-DNA片段含量无显著性差异(n=3,P>0.05),但当VCR浓度达0.01μg/ml时,K562及K562/VCR间组蛋白-DNA片段含量有极显著性差异(n=3,P<0.01),表明在此VCR浓度下,K562凋亡程度高于K562/VCR。
四、ELISA法与流式细胞仪PI染色法(FCM)测定VCR诱导的K562及K562/VCR凋亡的结果比较
见表1。
表1 ELISA法与FCM法测定结果的比较 (n=6) VCR浓度
(μg/ml)
, http://www.100md.com
K562
K562/VCR
ELISA
FCM(%)
ELISA
FCM(%)
0
0.132±0.025
4.10±0.17
0.138±0.056
3.61±0.69
0.001
, http://www.100md.com
0.214±0.020
13.30±3.74
0.148±0.036
9.06±4.24
0.01
0.600±0.066
36.48±6.70
0.184±0.046
10.45±3.71
相关性分析表明,ELISA法与FCM法测得结果呈高度相关,相关系数r=0.99(n=6,P<0.0005)。讨 论
, 百拇医药 本课题组曾用流式细胞仪PI染色法及TUNEL法对VCR诱导K562及耐药细胞K562/VCR凋亡进行研究,发现在相同条件下,K562比K562/VCR更容易诱导凋亡,表明抗凋亡作用增强可能在肿瘤细胞多药耐药过程中起重要作用。本试验采用ELISA法检测凋亡细胞内因内源性核酸内切酶激活而产生的组蛋白-DNA片段,定量分析VCR诱导的K562及K562/VCR凋亡,结果与以上结论完全符合。统计学分析表明,ELISA法与流式细胞仪PI染色法测定结果有很好的相关性,且ELISA法不需要流式细胞仪之类的大型仪器,因此在对细胞凋亡进行定量分析方面非常简便、实用[2,3]。
过去对凋亡细胞内产生的DNA片段分析常采用的方法是琼脂糖DNA电泳法。该方法需要繁琐的DNA分离步骤及电泳分离,且只能进行定性分析,而ELISA法操作较为简便(一步法),整个分析过程仅需3小时,并且可以进行定量分析,故ELISA法可替代琼脂糖DNA电泳法。ELISA法定量分析细胞凋亡的其它优点还包括:不使用放射性核素,可用于体内新鲜分离的肿瘤细胞的检测,所采用的单克隆抗体无种属特异性,可分析不同种属来源的细胞,方法的检测敏感性较好,可分析1000个细胞内的组蛋白-DNA片段的含量,试剂的稳定性也较好。
, http://www.100md.com
本试验对原方法进行了一些改进,原方法用微孔培养板进行细胞培养,分离细胞时需用特殊的微孔板离心机。本试验采用微量小试管进行细胞培养,用普通离心机分离细胞,方法简便,分离细胞效果好。
参考文献
[1] 张淑清,冯敏,殷建林,等.多药耐药细胞系K562及K562/VCR的建立及其生物学特性的研究.中华血液学杂志,1992,13:622.
[2] Ealovega M W, McGinnis P K, Summantran V N, et al. Bcl-Xs gene therapy induces apoptosis of human mammry tumors in nude mice. Cancer Res,1996,56:1965.
[3] Sumantran V N, Ealovega M W, Gabriel N, et al. Overexpression of bcl-Xs sensitizes MCF-7 cells to chemotherapy-induced apoptosis. Cancer Res, 1995,55:2507.
(收稿:1998-09-07), http://www.100md.com