胃癌组织组织蛋白酶活性测定的临床意义
作者:沈 洁 陈向荣
单位:沈 洁 温州市第二人民医院消化科 浙江省温州市 325000; 陈向荣 温州医学院附属第一医院 浙江省温州市 325000
关键词:胃肿瘤;肿瘤转移;组织蛋白酶B/分析
世界华人消化杂志990219
中国图书资料分类号 R735.2
摘 要
目的 探讨胃癌组织的组织蛋白酶B活性及其临床意义.
方法 通过荧光底物活性分析法测定8例胃癌患者术后肿瘤组织及8例正常胃组织匀浆及亚细胞组分的组织蛋白酶B(CB)活性.
结果 胃癌组织匀浆的CB活性(156.53pmol/s±29.84pmol/s)高于相应正常胃组织每克(CB)活性(43.84pmol/s±6.83pmol/s, P<0.01,t=10.42),而且胃癌组织低密度质膜组分CB活性与高密度质膜组分CB活性之比值(L/H) (4.12±2.84)比相应正常胃组织低密度质膜组分中CB活性与高密度质膜中的CB活性比值(1.34±0.17)为高(P<0.05,t=2.76). 在低分化腺癌L/H值(5.90±2.22)高于高分化腺癌L/H值(1.20±0.10,P<0.01,t=6.03).
, 百拇医药
结论 胃癌组织CB活性增高是其独有恶性表现,可能与肿瘤的侵袭转移有关.
Significance of cathepsin B activity in gastric cancer tissue
SHEN Jie1 and CHEN Xiang-Rong2
1Department of Gastroenterology, Wenzhou Second Municipal Hospital, Wenzhou 325000, Zhejiang Province, China
2First Affiliated Hospital of Wenzhou Medical College, Wenzhou 325000, Zhejiang Province, China
, 百拇医药
Subject headings stomach neoplasms; cathepsin B/analysis; neoplasm metastasis
Abstract
AIM To investigate cathepsin B activity in gastric cancer tissue and its clinical significance.
METHODS Cathepsin B (CB) activity was measured in homogenates and subcellular fractions of gastric cancer tissues from 8 patients with gastric cancer after surgjical resection and of normal tissues (8 patients) by fluroscence substracts activity assay.
, 百拇医药
RESULTS The CB activity was significantly higher in the homogenates of cancer tissue (for each gram of tissue, pmol/s, 156.53pmol/s±29.84pmol/s) than in that of normal tissue (43.84pmol/s±6.83pmol/s,P<0.01,t=10.42). Furthermore, the ratio of CB activity in the light mitochondrial fraction to that in the heavy mitochondrial fraction (L/H) was higher in the cancer tissue (4.12±2.84) than in the normal tissue (1.34±0.17,P<0.05,t=2.76). L/H ratio of CB activity was higher in poorly-differentiated adenocarcinoma (5.90±2.22) than in well-differentiated adenocarcinoma (1.20±0.10,P<0.01,t=6.03).
, http://www.100md.com
CONCLUSION High CB activity in gastric cancer tissue is unique of the malignancy, it is much more than a pure response to the spread of gastric cancer.
0 引言
近年的许多研究表明:蛋白水解酶可能在肿瘤细胞的侵袭和转移过程中发挥作用[1,2]. 尽管目前有关于正常胃粘膜中胶原酶和组织蛋白酶D的活性测定和提纯的报告,但有关胃癌的蛋白酶活性观察则少见报道[3]. 组织蛋白酶B(cathepsin B, CB)是一溶酶体巯基蛋白酶,大量的研究表明CB与肿瘤的侵袭和转移相关. 我们发现,胃癌组织匀浆的CB活性明显高于远离癌肿组织的正常胃组织,而且我们还观察到在癌组织和正常胃组织之间的CB活性亚细胞分布亦有明显不同.
, 百拇医药
1 材料和方法
1.1 材料 胃癌组织标本取自8例因患胃癌而行外科手术切除的胃组织,其中5例为低分化腺癌,3例为高分化腺癌. Z-phe-Arg-NMec,7-Amino-Mec,E-64,Brij35,leupeptin, pepstatin, DTT及大豆胰酶抑制剂均为Sigma公司产品,其他试剂均为分析纯试剂.
1.2 方法 组织匀浆和亚细胞组织的制备:新鲜手术标本用剪刀取肿瘤组织和远端正常胃组织(离肿瘤组织大于5cm以上). 在冰浴中分离粘膜层和肌层,取粘膜层做酶分析. 所有组织标本在冰生理盐水中(4℃)冲洗后即存于-70℃备用,匀浆制备时,标本于室温中快速解冻,加预冷的匀浆缓冲液(250mmol蔗糖/25mmol磷酸缓冲液,1mmol EDTA,pH 6.0)剪成小块并用玻璃匀浆器(GS12-2型,上海玻璃仪器厂制造)在冰浴条件下以800r/min快速制成匀浆,匀浆经500g,15min(Beckman JA20转头)离心得核沉淀,沉淀物经10mL匀浆缓冲液再悬浮后再离心. 两份核上清液混合经7000g,10min离心得高密度质膜沉淀,该沉淀被再悬浮和重离心,同样,混合两份上清液并以15000g,20min离心得低密度质膜沉淀,该沉淀亦被再悬浮并再离心. ①CB活性分析:按文献[4]以Z-Phe-Arg-NMec为底物在pH 6.0条件下分析CB活性. CB活性以每毫克蛋白在40℃时每分钟分解产生1nmol Amino-Mec为一个活性单位表示(IU=16.67pmol/s). ②将新鲜标本在pH 7.2条件下预处理5min~10min后,在pH 6.0条件下测残余CB活性. 分析胃癌及正常胃组织高密度质膜和低密度质膜的CB相关活性灭活情况. ③按Podhajcer et al的方法测酸性磷酶活性[5]. 按Lowry法测蛋白浓度[6](以牛血清清蛋白为标准).
, http://www.100md.com
统计学处理 对均数做t检验.
2 结果
2.1 胃癌组织的CB活性 胃癌组织匀浆的CB活性明显高于相应的正常胃组织(P<0.01,表1). 通过梯度离心,组织匀浆可被分为核,高密度质膜,低密度质膜和上清液这四个组分. 我们发现在肿瘤组织,CB活性主要分布在低密度质膜部分. 比较低密度质膜和高密度质膜的CB活性比值(L/H),发现肿瘤组织L/H值(4.12±2.84)高于正常组织的L/H值(1.34±0.17,P<0.05,t=2.76),我们亦分析了另一溶酶体酶-酸性磷酸酶在各亚细胞组分的活性分布,在胃癌组织和正常胃组织其酶活性无明显差异(P>0.05,表2).
2.2 胃癌分化与CB活性 我们观察到不同病理情况的肿瘤其CB活性亚细胞分布有不同,如图1所示,在低分化腺癌,其低密度质膜组分的CB活性明显较高分化腺癌为高.
, http://www.100md.com
2.3 中性pH时,低密度和高密度质膜相关CB活性的稳定性 CB活性pH稳定性分析结果显示在正常和肿瘤组织其高密度质膜相关CB活性经中性pH处理15min后活性衰减约50%(图2),但正常组织的低密度质膜相关CB活性以中性pH处理后仅留存22%,而肿瘤组织的低密度质膜相关CB活性则留存64%(图3).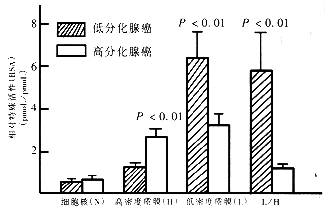
图1 胃癌分化与CB活性关系
注:RSA:该组分特殊活性与匀浆特殊活性之比值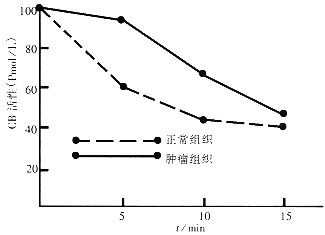
图2 高密度质膜组分.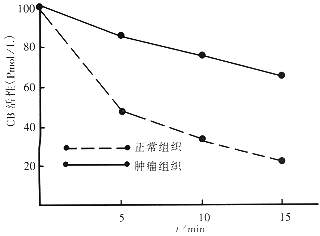
图3 低密度质膜组分.
, http://www.100md.com
表1 胃癌组织每克蛋白中CB活性
( ±s,pmol/s) 分组
±s,pmol/s) 分组
n
匀浆
核
高密度质膜
低密度质膜
上清液
L/H
癌组织
8
156.53±29.84b
, 百拇医药
83.02±33.34b
296.89±178.54a
801.83±241.21b
251.72±67.51b
4.12±2.84a
正常组织
8
43.84±6.83
39.34±10.17
94.52±18.00
, http://www.100md.com
124.36±16.34
93.52±31.51
1.34±0.17
aP<0.05,bP<0.01,vs 正常组织.
注:L/H即为低密度组分与高密度组分之CB比值.表2 胃癌组织每克蛋白中酸性磷酸酶活性
( ±s,pmol/s)
±s,pmol/s)
分组
n
匀浆
, http://www.100md.com
核
高密度质膜
低密度质膜
上清液
L/H
癌组织
8
33.17±10.34
33.17±10.84
94.19±54.51
199.04±77.52
53.68±16.84
, 百拇医药
2.57±1.07
正常组织
8
37.34±20.34
28.67±5.17
76.52±28.51
157.53±52.51
49.01±27.67
2.12±0.50
3 讨论
在我国由于胃癌早期诊断的开展,使预后有明显改善,但是,相当部分进展期胃癌患者由于转移而使治疗变得困难. 因此,弄清胃癌组织是如何向周围组织侵袭及向远处转移就显得极为重要[1,2]. 已有许多研究表明;肿瘤细胞产生和分泌的一些蛋白水解酶在肿瘤的侵袭和转移过程中起重要作用[7],研究和观察胃癌组织的蛋白水解酶活性是揭示胃癌侵袭转移关系的很有效方法. 我们观察到胃癌组织匀浆的CB活性明显高于相应的正常胃组织CB活性;此与Vasishta et al[8]的报告相符. 我们还观察到胃癌组织与正常组织比较,胃癌组织的CB活性亚细胞分布异常,即在胃癌组织中;低密度组分的CB活性增高,其临床意义尚不清. 据我们所知,低密度质膜组分主要有二种:分别是次级溶酶体和细胞膜. 有报告认为这一组分经蔗糖梯度超速离心分离后细胞膜片段中发现CB活性主要存在于细胞膜成分中[9]. 而且低密度质膜的CB活性耐中性pH(pH 7.2)的灭活,表明这种CB在生理pH状态下其活性稳定. 这种情况可能提示低密度质膜相关CB活性在胃癌的侵袭和播散中起一定的作用. 有报告表明从人组织包括肿瘤中提取的CB对合成底物在pH 6.2条件下活性最高,而在pH 7.0时则活性低[10]. 这可能表明在肿瘤侵袭过程中,中性至轻度酸性的pH更适宜肿瘤CB活力的表达,使之在对细胞外基质的局部降解中发挥一定的作用. 最近,Sloane et al[9]发现恶性黑素瘤细胞之CB活性表达与细胞的转移能力相关. 他们亦报告肿瘤细胞膜嵌合型CB活性在对基底膜成分的降解中起作用,但CB活性与在胃癌中对基底膜的降解关系值得进一步探讨. 值得指出的是,良性胃溃疡组织的匀浆和亚细胞组分CB活性与溃疡周围正常胃组织之CB活性比较无差别(数据未显示). 因此,我们认为胃癌组织的CB活性增高是其独有现象,而非是炎症反应所致. 胃癌CB活性增高的机制尚不清,其中部分原因可能与其内源性巯基蛋白酶抑制剂的不足有关[11]. 有关胃癌转移与内源性巯基蛋白酶抑制剂的关系目前还在研究中.
, 百拇医药
作者简介:沈洁,男,1964-12-23生,浙江省温州市人,汉族. 1987年温州医学院医疗系毕业,主治医师,主要从事消化病的诊治研究,发表论文3篇.
通讯作者 沈洁,325000,温州市第二人民医院消化科,浙江省温州市大简巷24号.
Correspondence to:SHEN Jie, Department of Gastroenterology, Wenzhou Second Municipal Hospital, 24 Dajianxiang, Wenzhou 325000, Zhejiang Province, China
Tel. +86.577.8181901 Ext. 3037
4 参考文献
, http://www.100md.com
[1] Schmitt M, Wilhelm V, Janickle F. Urokinase-type plasminogen activator and
its receptor: a new target in tumor invasion and metastasis. J Obstet Gynaecol, 1995;21:151-165
[2] DeClerck YA, Imern S. Protease inhibitor: role and potential therapeatic
use in human cancer. Eru J Cancer, 1994;30:1270-1280
[3] Cho JY, Chung HC, Noh SH. High level of urokinase-type plasminogen
, http://www.100md.com
activators is a new prognostic marker in patients with gastric carcinoma.
Cancer, 1997;79:878-883
[4] Barrett. Fluorimetric assays for cathepsin B and cathepsin H with methylcoumarylamide substeates. Biochem J, 1980;187:909-912
[5]` Podhajcer OL. Characterization of lysosomal acid phosphatase from
normal and malignant mamary tissue. Clin Chem, 1986;32:279-282
, 百拇医药
[6] 张龙翔,张庭芳,李令媛,主编. 生化实验方法和技术. 第1版. 北京:人民教育出版社,1981:161-193
[7] Campo E, Munoz J, Nadal A. Cathepsion B mRNA overpression correlates with tumor progression in colorectal carcinomas. Lab Invert, 1995;72:A58
[8] Vasishta A, Baker PR, Hopwood D. Proteinase-like peptidase activities in malignant and non-malignant gastric tissue. Br J Surg, 1985;72:386-388
[9] Sloane BF, Moin K, Lah TT. Regulation of lysosomal endopeptidases in malignant neoplasia. In: Pretlow TG (ed). Aspects of biochemistry and molecular biology of tumor, New York: Academic Press, 1994:441-446
[10] Barrett AJ, Kirschke H. Cathepsin B cathepin H and cathepin L. Methods Enzymol, 1981;80:535-561
[11] Calkins CC, Sloane BF. Mammalian cysteine protease inhibitors, Biochemical properties and possible role in tumor properites. Biochemistry, 1995;376:71-80
收稿日期 1998-03-08 修回日期 1998-11-17, http://www.100md.com
单位:沈 洁 温州市第二人民医院消化科 浙江省温州市 325000; 陈向荣 温州医学院附属第一医院 浙江省温州市 325000
关键词:胃肿瘤;肿瘤转移;组织蛋白酶B/分析
世界华人消化杂志990219
中国图书资料分类号 R735.2
摘 要
目的 探讨胃癌组织的组织蛋白酶B活性及其临床意义.
方法 通过荧光底物活性分析法测定8例胃癌患者术后肿瘤组织及8例正常胃组织匀浆及亚细胞组分的组织蛋白酶B(CB)活性.
结果 胃癌组织匀浆的CB活性(156.53pmol/s±29.84pmol/s)高于相应正常胃组织每克(CB)活性(43.84pmol/s±6.83pmol/s, P<0.01,t=10.42),而且胃癌组织低密度质膜组分CB活性与高密度质膜组分CB活性之比值(L/H) (4.12±2.84)比相应正常胃组织低密度质膜组分中CB活性与高密度质膜中的CB活性比值(1.34±0.17)为高(P<0.05,t=2.76). 在低分化腺癌L/H值(5.90±2.22)高于高分化腺癌L/H值(1.20±0.10,P<0.01,t=6.03).
, 百拇医药
结论 胃癌组织CB活性增高是其独有恶性表现,可能与肿瘤的侵袭转移有关.
Significance of cathepsin B activity in gastric cancer tissue
SHEN Jie1 and CHEN Xiang-Rong2
1Department of Gastroenterology, Wenzhou Second Municipal Hospital, Wenzhou 325000, Zhejiang Province, China
2First Affiliated Hospital of Wenzhou Medical College, Wenzhou 325000, Zhejiang Province, China
, 百拇医药
Subject headings stomach neoplasms; cathepsin B/analysis; neoplasm metastasis
Abstract
AIM To investigate cathepsin B activity in gastric cancer tissue and its clinical significance.
METHODS Cathepsin B (CB) activity was measured in homogenates and subcellular fractions of gastric cancer tissues from 8 patients with gastric cancer after surgjical resection and of normal tissues (8 patients) by fluroscence substracts activity assay.
, 百拇医药
RESULTS The CB activity was significantly higher in the homogenates of cancer tissue (for each gram of tissue, pmol/s, 156.53pmol/s±29.84pmol/s) than in that of normal tissue (43.84pmol/s±6.83pmol/s,P<0.01,t=10.42). Furthermore, the ratio of CB activity in the light mitochondrial fraction to that in the heavy mitochondrial fraction (L/H) was higher in the cancer tissue (4.12±2.84) than in the normal tissue (1.34±0.17,P<0.05,t=2.76). L/H ratio of CB activity was higher in poorly-differentiated adenocarcinoma (5.90±2.22) than in well-differentiated adenocarcinoma (1.20±0.10,P<0.01,t=6.03).
, http://www.100md.com
CONCLUSION High CB activity in gastric cancer tissue is unique of the malignancy, it is much more than a pure response to the spread of gastric cancer.
0 引言
近年的许多研究表明:蛋白水解酶可能在肿瘤细胞的侵袭和转移过程中发挥作用[1,2]. 尽管目前有关于正常胃粘膜中胶原酶和组织蛋白酶D的活性测定和提纯的报告,但有关胃癌的蛋白酶活性观察则少见报道[3]. 组织蛋白酶B(cathepsin B, CB)是一溶酶体巯基蛋白酶,大量的研究表明CB与肿瘤的侵袭和转移相关. 我们发现,胃癌组织匀浆的CB活性明显高于远离癌肿组织的正常胃组织,而且我们还观察到在癌组织和正常胃组织之间的CB活性亚细胞分布亦有明显不同.
, 百拇医药
1 材料和方法
1.1 材料 胃癌组织标本取自8例因患胃癌而行外科手术切除的胃组织,其中5例为低分化腺癌,3例为高分化腺癌. Z-phe-Arg-NMec,7-Amino-Mec,E-64,Brij35,leupeptin, pepstatin, DTT及大豆胰酶抑制剂均为Sigma公司产品,其他试剂均为分析纯试剂.
1.2 方法 组织匀浆和亚细胞组织的制备:新鲜手术标本用剪刀取肿瘤组织和远端正常胃组织(离肿瘤组织大于5cm以上). 在冰浴中分离粘膜层和肌层,取粘膜层做酶分析. 所有组织标本在冰生理盐水中(4℃)冲洗后即存于-70℃备用,匀浆制备时,标本于室温中快速解冻,加预冷的匀浆缓冲液(250mmol蔗糖/25mmol磷酸缓冲液,1mmol EDTA,pH 6.0)剪成小块并用玻璃匀浆器(GS12-2型,上海玻璃仪器厂制造)在冰浴条件下以800r/min快速制成匀浆,匀浆经500g,15min(Beckman JA20转头)离心得核沉淀,沉淀物经10mL匀浆缓冲液再悬浮后再离心. 两份核上清液混合经7000g,10min离心得高密度质膜沉淀,该沉淀被再悬浮和重离心,同样,混合两份上清液并以15000g,20min离心得低密度质膜沉淀,该沉淀亦被再悬浮并再离心. ①CB活性分析:按文献[4]以Z-Phe-Arg-NMec为底物在pH 6.0条件下分析CB活性. CB活性以每毫克蛋白在40℃时每分钟分解产生1nmol Amino-Mec为一个活性单位表示(IU=16.67pmol/s). ②将新鲜标本在pH 7.2条件下预处理5min~10min后,在pH 6.0条件下测残余CB活性. 分析胃癌及正常胃组织高密度质膜和低密度质膜的CB相关活性灭活情况. ③按Podhajcer et al的方法测酸性磷酶活性[5]. 按Lowry法测蛋白浓度[6](以牛血清清蛋白为标准).
, http://www.100md.com
统计学处理 对均数做t检验.
2 结果
2.1 胃癌组织的CB活性 胃癌组织匀浆的CB活性明显高于相应的正常胃组织(P<0.01,表1). 通过梯度离心,组织匀浆可被分为核,高密度质膜,低密度质膜和上清液这四个组分. 我们发现在肿瘤组织,CB活性主要分布在低密度质膜部分. 比较低密度质膜和高密度质膜的CB活性比值(L/H),发现肿瘤组织L/H值(4.12±2.84)高于正常组织的L/H值(1.34±0.17,P<0.05,t=2.76),我们亦分析了另一溶酶体酶-酸性磷酸酶在各亚细胞组分的活性分布,在胃癌组织和正常胃组织其酶活性无明显差异(P>0.05,表2).
2.2 胃癌分化与CB活性 我们观察到不同病理情况的肿瘤其CB活性亚细胞分布有不同,如图1所示,在低分化腺癌,其低密度质膜组分的CB活性明显较高分化腺癌为高.
, http://www.100md.com
2.3 中性pH时,低密度和高密度质膜相关CB活性的稳定性 CB活性pH稳定性分析结果显示在正常和肿瘤组织其高密度质膜相关CB活性经中性pH处理15min后活性衰减约50%(图2),但正常组织的低密度质膜相关CB活性以中性pH处理后仅留存22%,而肿瘤组织的低密度质膜相关CB活性则留存64%(图3).

图1 胃癌分化与CB活性关系
注:RSA:该组分特殊活性与匀浆特殊活性之比值

图2 高密度质膜组分.

图3 低密度质膜组分.
, http://www.100md.com
表1 胃癌组织每克蛋白中CB活性
(
 ±s,pmol/s) 分组
±s,pmol/s) 分组n
匀浆
核
高密度质膜
低密度质膜
上清液
L/H
癌组织
8
156.53±29.84b
, 百拇医药
83.02±33.34b
296.89±178.54a
801.83±241.21b
251.72±67.51b
4.12±2.84a
正常组织
8
43.84±6.83
39.34±10.17
94.52±18.00
, http://www.100md.com
124.36±16.34
93.52±31.51
1.34±0.17
aP<0.05,bP<0.01,vs 正常组织.
注:L/H即为低密度组分与高密度组分之CB比值.表2 胃癌组织每克蛋白中酸性磷酸酶活性
(
 ±s,pmol/s)
±s,pmol/s)分组
n
匀浆
, http://www.100md.com
核
高密度质膜
低密度质膜
上清液
L/H
癌组织
8
33.17±10.34
33.17±10.84
94.19±54.51
199.04±77.52
53.68±16.84
, 百拇医药
2.57±1.07
正常组织
8
37.34±20.34
28.67±5.17
76.52±28.51
157.53±52.51
49.01±27.67
2.12±0.50
3 讨论
在我国由于胃癌早期诊断的开展,使预后有明显改善,但是,相当部分进展期胃癌患者由于转移而使治疗变得困难. 因此,弄清胃癌组织是如何向周围组织侵袭及向远处转移就显得极为重要[1,2]. 已有许多研究表明;肿瘤细胞产生和分泌的一些蛋白水解酶在肿瘤的侵袭和转移过程中起重要作用[7],研究和观察胃癌组织的蛋白水解酶活性是揭示胃癌侵袭转移关系的很有效方法. 我们观察到胃癌组织匀浆的CB活性明显高于相应的正常胃组织CB活性;此与Vasishta et al[8]的报告相符. 我们还观察到胃癌组织与正常组织比较,胃癌组织的CB活性亚细胞分布异常,即在胃癌组织中;低密度组分的CB活性增高,其临床意义尚不清. 据我们所知,低密度质膜组分主要有二种:分别是次级溶酶体和细胞膜. 有报告认为这一组分经蔗糖梯度超速离心分离后细胞膜片段中发现CB活性主要存在于细胞膜成分中[9]. 而且低密度质膜的CB活性耐中性pH(pH 7.2)的灭活,表明这种CB在生理pH状态下其活性稳定. 这种情况可能提示低密度质膜相关CB活性在胃癌的侵袭和播散中起一定的作用. 有报告表明从人组织包括肿瘤中提取的CB对合成底物在pH 6.2条件下活性最高,而在pH 7.0时则活性低[10]. 这可能表明在肿瘤侵袭过程中,中性至轻度酸性的pH更适宜肿瘤CB活力的表达,使之在对细胞外基质的局部降解中发挥一定的作用. 最近,Sloane et al[9]发现恶性黑素瘤细胞之CB活性表达与细胞的转移能力相关. 他们亦报告肿瘤细胞膜嵌合型CB活性在对基底膜成分的降解中起作用,但CB活性与在胃癌中对基底膜的降解关系值得进一步探讨. 值得指出的是,良性胃溃疡组织的匀浆和亚细胞组分CB活性与溃疡周围正常胃组织之CB活性比较无差别(数据未显示). 因此,我们认为胃癌组织的CB活性增高是其独有现象,而非是炎症反应所致. 胃癌CB活性增高的机制尚不清,其中部分原因可能与其内源性巯基蛋白酶抑制剂的不足有关[11]. 有关胃癌转移与内源性巯基蛋白酶抑制剂的关系目前还在研究中.
, 百拇医药
作者简介:沈洁,男,1964-12-23生,浙江省温州市人,汉族. 1987年温州医学院医疗系毕业,主治医师,主要从事消化病的诊治研究,发表论文3篇.
通讯作者 沈洁,325000,温州市第二人民医院消化科,浙江省温州市大简巷24号.
Correspondence to:SHEN Jie, Department of Gastroenterology, Wenzhou Second Municipal Hospital, 24 Dajianxiang, Wenzhou 325000, Zhejiang Province, China
Tel. +86.577.8181901 Ext. 3037
4 参考文献
, http://www.100md.com
[1] Schmitt M, Wilhelm V, Janickle F. Urokinase-type plasminogen activator and
its receptor: a new target in tumor invasion and metastasis. J Obstet Gynaecol, 1995;21:151-165
[2] DeClerck YA, Imern S. Protease inhibitor: role and potential therapeatic
use in human cancer. Eru J Cancer, 1994;30:1270-1280
[3] Cho JY, Chung HC, Noh SH. High level of urokinase-type plasminogen
, http://www.100md.com
activators is a new prognostic marker in patients with gastric carcinoma.
Cancer, 1997;79:878-883
[4] Barrett. Fluorimetric assays for cathepsin B and cathepsin H with methylcoumarylamide substeates. Biochem J, 1980;187:909-912
[5]` Podhajcer OL. Characterization of lysosomal acid phosphatase from
normal and malignant mamary tissue. Clin Chem, 1986;32:279-282
, 百拇医药
[6] 张龙翔,张庭芳,李令媛,主编. 生化实验方法和技术. 第1版. 北京:人民教育出版社,1981:161-193
[7] Campo E, Munoz J, Nadal A. Cathepsion B mRNA overpression correlates with tumor progression in colorectal carcinomas. Lab Invert, 1995;72:A58
[8] Vasishta A, Baker PR, Hopwood D. Proteinase-like peptidase activities in malignant and non-malignant gastric tissue. Br J Surg, 1985;72:386-388
[9] Sloane BF, Moin K, Lah TT. Regulation of lysosomal endopeptidases in malignant neoplasia. In: Pretlow TG (ed). Aspects of biochemistry and molecular biology of tumor, New York: Academic Press, 1994:441-446
[10] Barrett AJ, Kirschke H. Cathepsin B cathepin H and cathepin L. Methods Enzymol, 1981;80:535-561
[11] Calkins CC, Sloane BF. Mammalian cysteine protease inhibitors, Biochemical properties and possible role in tumor properites. Biochemistry, 1995;376:71-80
收稿日期 1998-03-08 修回日期 1998-11-17, http://www.100md.com