苦参碱抗免疫性肝损伤机制的研究
作者:梁 萍 薄爱华 薛贵平 韩 瑞 李海峰 许永利
单位:张家口医学院超微病理教研室 河北省张家口 075029
关键词:肝疾病/病理学;肝疾病/治疗;肝疾病/免疫学;苦参碱/治疗应用
世界华人消化杂志990205 摘 要
目的 通过对苦参碱抗免疫性肝损伤作用的研究,为中药治疗免疫性肝损伤开辟新的途径.
方法 将大鼠随机分为正常对照组、实验对照组、丹参对照组、苦参碱治疗1组和苦参碱治疗2组,后4组大鼠给猪血清ip,7wk以复制肝损伤动物模型,然后分别利用丹参注射液和苦参碱注射液对大鼠进行治疗,共4wk. 实验起11wk后处死动物,经心脏取血,离心制备血清,检测血清中ALT,BUN含量,A/G值,LN,HA含量,SOD的活性和MDA的含量,剖腹取肝组织制作光、电镜标本检查.
, 百拇医药
结果 实验对照组大鼠血清ALT,BUN,A/G,LN,HA,SOD,MDA较正常对照组有显著性差异(P<0.05);而丹参组和苦参碱组大鼠血清生化指标较正常组无显著性差异(P>0.05);与实验对照组相比具有显著性差异(P<0.05). 光镜下观察:实验对照组大鼠与正常对照组相比,肝细胞受损,胶原纤维面密度远远大于其他组;而丹参组和苦参碱治疗2组与实验对照组相比,肝细胞损伤不明显;丹参和苦参碱组间质细胞数目明显低于实验对照组(P<0.05). 电镜下观察:丹参和苦参碱组与实验对照组相比较,肝细胞变形很少,线粒体膜未见损伤,细胞质内粗面内质网形态与正常对照组近似,基质内胶原纤维较实验对照组明显减少(P<0.05).
结论 苦参碱具有抗大鼠免疫性肝损伤的作用.
中国图书资料分类号 R575
Study on the mechanism of matrine on immune liver injury in rats
, 百拇医药
LIANG Ping, BO Ai-Hua, XUE Gui-Ping, HAN Rui, LI Hai-Feng and XU Yong-Li
Department of Ultramicropathology of Zhangjiakou Medical College, Zhangjiakou 075029, Hebei Province, China
Subject headings liver disease/pathology; liver disease/therapy; liver disease/immunology; matrine/therapeutic use
Abstract
AIM To further explore possible ways for the treatment of immune liver injury by traditional Chinese medicine matrine (M).
, 百拇医药
METHODS Rats were administrated intra-abdominally swine serum to induce immune liver injury model and then were treated with tanshinol (T) and matrine (M) respectively. Serum ALT, BUN, A/G, LN, HA, SOD and MDA were measured and liver specimens were taken and prepared for light and electron microscopic examination.
RESULTS The above serum parameters in T or M group had no marked differences from those of normal control group, yet, significant differences did exist between tanshinol (T) or matrine (M) group and experimental control group (P<0.05). Light and electron microscopic examination showed that, compared with experimental control (EC), no obvious pathological changes were found in the livers of T and M groups and proliferation of collagen fibers greatly decreased too. It was also found that the numbers of interstitial cells were significantly lowered in T and M groups than in EC group.
, 百拇医药
CONCLUSION Matrine had the effect of anti immune liver injury in rats.
0 引言
多种有害因素可以导致肝脏损伤和继发性肝纤维化,进一步发展可导致肝硬变. 目前研究表明,肝纤维化在进入肝硬变之前尚有逆转至正常的可能[1],因此,抗肝损伤-肝纤维化的研究是目前世界生物医学领域研究的热点问题之一. 有研究表明,苦参碱可防治四氯化碳诱发的大鼠实验性肝纤维化[2,3],但其对大鼠免疫性肝损伤的影响还未见报道. 为了开发中药在抗肝损伤中的作用并探讨其机制,我们复制免疫性肝损伤动物模型,采用丹参注射液作为阳性对照,用苦参碱注射液对动物进行治疗,旨在为中药治疗免疫性肝损伤开辟新的途径.
1 材料和方法
, http://www.100md.com
1.1 材料 健康Wistar大鼠65只,5月~6月龄,雌雄兼用,体重190g~230g. 购自首都医科大学动物养殖中心. 雌雄分笼混养,自由饮食,观察1wk后用于实验.
1.2 方法 将大白鼠随机分成正常对照组、实验对照组、丹参对照组、苦参碱治疗1组、苦参碱治疗2组,每组各13只动物. 后4组参照猪血清注射法[4]复制肝纤维化动物模型:猪血清0.5mL,ip, 1次/wk;8wk,正常对照组和实验对照组动物改生理盐水0.3mL/kg,im,1次/wk;后三组动物分别im丹参注射液和苦参碱注射液进行治疗,丹参对照组0.3mL/kg(相当于丹参0.5g/kg);苦参碱治疗1组7.5mg/kg;苦参碱治疗2组15mg/kg,共4wk. 11wk后,各组动物同时取材. 戊巴比妥钠(40mg/kg)麻醉,剖开胸部,经心脏取血5mL,剖腹,取肝脏. ①肝功能检测:采用常规分析法测定ALT,BUN,A/G值. ②血清LN,HA含量测定:采用免疫分析法. ③MDA和SOD的测定:按照试剂盒规定操作. ④石蜡及电镜切片的制作:常规方法制作. ⑤肝组织间质细胞计数. ⑥肝组织胶原纤维定量分析:采用面数密度测量法[5].
, http://www.100md.com
统计学处理 经方差齐性检验后,采用方差分析进行统计学处理.
2 结果
猪血清诱导的肝损伤大鼠与正常对照组大鼠相比,在实验期间毛发光泽、一般状态良好,饮食,饮水无异常波动,4wk后体重增长速度较正常对照组缓慢,而且少数动物尿色偏黄.
2.1 血清生化 ①肝功能变化:实验对照组ALT值显著高于正常对照组,A/G值显著低于正常组,BUN含量高于正常对照组. 丹参对照组和苦参碱治疗1,2组组间各项指标及各组与正常组无明显差异,与实验对照组具有显著性差异(表1). ②血清LN,HA含量变化:实验对照组LN,HA含量明显高于其他组,治疗组与正常对照组之间无显著性差异(表1). ③血清中SOD活性和MDA含量的变化:实验对照组与正常对照组相比SOD活性和MDA含量均有显著性差异;治疗组大鼠血清中SOD活性明显高于实验对照组,MDA含量低于实验对照组;而与正常对照组相比则无明显差异;丹参对照组和苦参碱治疗1,2组组间无显著性差异(表1).
, 百拇医药
表1 各组大鼠血清生化检测结果 ( ±s,n=13) 分组
±s,n=13) 分组
ALT
(nmol/S)
A/G比值
BUN
(mmol/L)
LN
(μg/L)
HA
(μg/L)
SOD
, http://www.100md.com
(KNU/L)
MDA
(μmol/L)
正常对照
415±125b
0.91±0.1b
6.3±2b
43±9d
181±65d
86±7e
90±29f
, 百拇医药
实验对照
555±120
0.72±0.1
8.9±2
70±12
303±65
79±9
145±39
丹参对照
436±127a
1.0±0.1b
6.3±1a
, http://www.100md.com
44±13d
193±43b
90±6f
95±26f
苦参碱治疗1
460±93a
0.8±0.2a
6.3±1b
52±14d
242±63b
, http://www.100md.com
87±9e
114±31a
苦参碱治疗2
441±65a
0.9±0.1a
6.1±1a
45±11d
200±41d
91±8f
98±25f
, 百拇医药
aP<0.05,eP<0.05;bP<0.01,dP<0.01,fP<0.01,vs 实验对照组.
2.2 肝脏病理学
2.2.1 光镜观察 ①肝细胞和肝小叶的形态变化:正常大鼠肝因间质成分较少,肝小叶分界不清. HE染色肝细胞排列呈索状,围绕中央静脉呈放射状排列,肝细胞呈多边形,边界不十分清晰,核1~2个呈圆形,嗜碱性,位于细胞中央,细胞质微嗜酸性. Mallory染色肝细胞核呈蓝色,细胞质微黄色. 间质胶原纤维呈蓝色,正常肝组织胶原纤维很少(图1). 实验对照组HE染色可见肝细胞变性,细胞质中有大量空泡,有的肝细胞质膜破裂,肝细胞变性坏死. Mallory染色局部增生的胶原纤维组成粗大的兰色纤维束,纵横交错,使肝内有类假小叶样结构形成(图2),胶原纤维面数密度远远多于其他各组(表2). 丹参组肝细胞损伤不明显,胞质中空泡减少或不明显,胶原纤维增生不明显或似正常对照组. 苦参碱治疗1,2组肝细胞结构清晰,小叶分界不清,中央静脉和汇管区内胶原纤维较实验对照组少(图3),治疗2组胶原纤维面数密度与丹参组及正常组接近,治疗1组胶原纤维面数密度与正常组比较则较高并有显著性差异(表2). ②间质细胞及基质:正常对照组肝内间质细胞(库氏细胞、贮脂细胞、窦内皮细胞等)细胞核较小,分散在血窦处及汇管区,数目较少;实验对照组间质细胞数目明显增多;而丹参及苦参碱组间质细胞数明显低于实验对照组. 结果(表2).
, http://www.100md.com
表2 肝组织间质细胞数和胶原纤维面数密度 ( ±s,n=13) 分组
±s,n=13) 分组
汇管区
(个/mm2)
小叶间
(个/mm2)
胶原纤维面数
密度(面/mm2)
正常对照
8.13±0.4b
5.79±0.4b
, 百拇医药
6.0±1.1d
实验对照
10.42±0.7
7.26±0.5
16.0±4.3
丹参对照
7.73±1.1b
5.80±0.4b
6.3±1.8d
苦参碱治疗1
8.61±0.9b
, 百拇医药
6.06±0.6b
7.3±1.8d
苦参碱治疗2
7.75±0.7b
5.90±0.6b
6.6±1.7d
bP<0.01,dP<0.01,vs 实验对照组.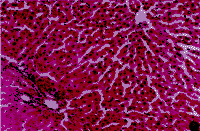
图1 正常对照组肝脏结构 HE,×100
, 百拇医药
图2 实验对照组肝脏结构Mallory,×100 ↑汇管区 ▲胶原纤维束
图3 苦参碱治疗2组肝脏结构 HE,×100 ↑汇管区 ▲中央静脉
2.2.2 电镜观察 ①肝细胞:正常对照组肝细胞周边圆滑,核膜清晰,核周间隙均匀,常染色质呈絮状,异染色质相对较少,呈斑块状,核仁可见,胞质分布均匀;线粒体呈圆形或椭圆形,较均匀分布于胞质内,数量较多,基质电子密度中等,由双层单位膜包绕,嵴突入线粒体内与表面垂直;粗面内质网(RER)亦较丰富,网腔较狭窄,电子密度低,存在于核周和血窦面,一般多弯曲平行排列;滑面内质网(SER)呈泡状,数量较少,多分布在胆小管周围胞质内;核糖体及糖原颗粒也明显可见;肝细胞血窦面有丰富的指状微绒毛;伸入Disse间隙;肝细胞胆小管面有相邻肝细胞膜特化形成的胆小管及管周连结复合体,小管腔面有丰富的微绒毛(图4).
, http://www.100md.com
图4 正常对照组肝细胞及胆小管 ×12000 ↑线粒体 ▲胆小管
实验对照组肝细胞质膜或胞质均有不同程度的损伤性超微结构变化. 轻者细胞器减少,胞质内脂滴增多,线粒体局部膜断裂或变为单层膜,嵴减少,基质电子密度降低,胞核周边呈锯齿状,异染色质增多,核周隙加宽;重者细胞核染色质溶解,胞质内细胞器消失,粗面内质网扩张呈不规则泡状、脱颗粒(图5). 丹参对照组肝细胞核变形很少,未见核质溶解,细胞质内溶酶体相对增多,线粒体膜未见损伤,细胞质内粗面内质网和滑面内质网及核糖体基本与正常对照组类同. 苦参碱治疗1组大部分肝细胞超微结构变化不显著,小部分肝细胞质内脂滴比丹参组多(图6). 苦参碱治疗2组肝细胞超微结构与丹参组无明显差异. ②间质:正常对照组鼠肝血窦内皮细胞核内异染色质较多,胞质少,电子密度低,细胞器不发达;库氏细胞的胞质内有丰富的初、次级溶酶体;贮脂细胞核不规则,异染色质多,电子密度高,胞质亦较少,胞质内有1~2个脂滴,细胞器不发达. 实验对照组血窦内皮细胞超微结构变化不明显,枯否细胞增多,胞质中次级溶酶体及线粒体增多;贮脂细胞增多,胞体变大,并且细胞器增多,可见内质网、线粒体等;浆细胞样细胞增多,其胞核结构典型,胞质有丰富的粗面内质网,基质内有较多的带有周期性横纹的胶原原纤维,它们聚集组成粗大的胶原纤维束(图7),即在光学显微镜下经Mallory氏染色后为蓝色条索(图2). 丹参及苦参碱治疗组间质内细胞成分主要是血窦内皮细胞和枯否细胞,枯否细胞溶酶体等细胞器与正常对照组无明显差异;浆细胞样间质细胞较少或消失;贮脂细胞形态多样,有的胞体较小,和正常对照组相比无明显差异,有的胞体较大,胞质电子密度低,细胞器散在于胞质中. 治疗组基质内仍可见少量胶原纤维束,但与实验对照组相比减少或仅为细束.
, 百拇医药
图5 实验对照组肝细胞 ×9000 ↑核周隙加宽
图6 丹参对照组肝细胞 ×9000 ↑线粒体 ▲内质网
图7 苦参碱治疗1组肝细胞 ×8000 ↑脂滴
图8 实验对照组肝细胞间质 ×9000 ↑贮脂细胞 ▲胶原纤维
3 讨论
丹参对照组和苦参碱治疗组的肝细胞损伤程度和纤维化程度较实验对照组明显减轻,有些接近正常. 如ALT,BUN,LN,HA含量与实验对照组相比显著降低,SOD活性显著提高,间质细胞数及间质中胶原纤维密度也大大少于实验对照组(P<0.05),提示苦参碱具有抗免疫性肝损伤作用. 其作用机制主要表现在以下几个方面.
, 百拇医药
3.1 保护膜结构 当各种致病因素引起肝细胞病变时,肝细胞膜出现不同程度的损伤,影响膜的形态与正常生理功能,严重时导致细胞部分或全部膜溶解,出现屏障紊乱,内容物向外释放,如肝炎病变中,血清中ALT酶活性升高是细胞膜损伤的结果. 本研究实验对照组光镜下,肝细胞可见变性、坏死、细胞膜破裂,血清学检测ALT酶活性增高(P<0.05),BUN升高(P<0.05),清蛋白合成减少,球蛋白合成增高,即A/G比值降低. 电镜下线粒体内膜出现部分溶解或成为单层膜,且数量减少,内质网扩张呈不规则泡状,粗面内质网有脱颗粒现象. 而苦参碱治疗组光镜下肝细胞基本正常,血清学检测ALT,BUN,A/G与正常组比无明显差别. 电镜下肝细胞膜、线粒体膜结构完整,基本与正常组相一致,粗面内质网大都平行排列,线粒体数量增加,说明苦参碱有保护膜结构的功能. 膜脂质过氧化反应是破坏膜脂层结构完整性的机制之一,Rice-Evans[6]报道膜脂质过氧化后,膜中脂类的致密度增大,柔性减小,刚性变大,易于破裂. 实验结果表明,SOD活性的增加,可以加速清除自由基,阻止自由基对组织细胞膜中不饱和脂肪酸的链锁反应,延缓组织细胞膜老化和损伤. 因此提示苦参碱对细胞膜结构保护作用可能与其抗自由基作用有关.
, http://www.100md.com
3.2 抑制间质细胞增生 间质细胞包括窦内皮细胞、库氏细胞、各类淋巴细胞和贮脂细胞,活化的贮脂细胞在肝纤维化的发生和发展过程中起着关键性作用[7,8]. 本实验Mallory染色实验对照组汇管区周围、小叶间,可见增生的胶原纤维,苦参碱组肝脏结构基本正常,未见胶原纤维的增生. HE染色实验对照组汇管区周围出现较多的淋巴细胞及浆细胞等炎性细胞浸润,小叶内也可看到明显的间质增多;治疗组间质细胞增生不明显. 间质细胞计数分析,实验对照组和治疗组之间有显著性差异(P<0.05),治疗组与正常对照组差异不明显. 电镜下实验对照组可以看到胶原原纤维和胶原纤维束,治疗组和正常组纤维束不明显,提示苦参碱具有抑制间质细胞增生和防治肝纤维化的作用.
3.3 调节代谢 肝脏是生物转化和能量代谢的重要场所,而线粒体和内质网是这一过程中最重要的细胞器;线粒体内膜完整及其两侧的电化学势是完成氧化磷酸化的基本前提,内膜的特性是对物质交换选择性很强. 因此正常内膜是整个线粒体结构和功能的保证[9]. 本实验实验对照组亚细胞结构上发生多方面的病理改变,如线粒体膜出现部分溶解、破裂、内膜消失、体积增大,嵴消失或减少、电子密度降低等等,随之表现为肝功能障碍、自由基增多等(表1),说明实验对照组肝细胞内生物代谢发生障碍,而治疗组在亚细胞结构上除脂滴和溶酶体较正常对照组相对较多外,其他基本一致,说明苦参碱在保护细胞膜结构的同时也起到了调节代谢的作用.
, 百拇医药
本研究结果表明:①苦参碱能够保护肝细胞,尤其是保护膜性结构效果明显. ②能够提高大鼠的血清中SOD活性,降低MDA含量,降低ALT和提高A/G比值,降低LN,HA水平. ③能够减少肝组织中汇管区和小叶内间质细胞的数量,抑制胶原纤维的增生. ④苦参碱大剂量组(苦参碱治疗2组)与丹参对照组相比,各生化指标及肝组织结构无显著性差异;苦参碱小剂量组(苦参碱治疗1组)对肝损伤的治疗效果略逊于丹参对照组. 因此我们认为,苦参碱具有抗免疫性肝损伤和纤维化的作用.
作者简介:梁萍,女,1971-01-19生,河北省张家口市人,汉族. 1992西北大学生物系毕业,现河北医科大学硕士研究生.
通讯作者 薄爱华,075029,张家口医学院超微病理教研室,河北省张家口市长青路14号.
Correspondence to:Prof. BO Ai-Hua, Department of Ultramicropathology of Zhangjiakou Medical College, Zhangjiakou 075029, Hebei Province, China
, 百拇医药
Tel. +86.313.8028572 Ext. 299
4 参考文献
[1] 石淑仙. 肝纤维化诊断与治疗的研究进展. 实用医学进修杂志,1996;24:125-128
[2] 陈伟忠,张俊平,许表,胡振林,谢渭芬,张兴荣. 苦参碱对大鼠实验性肝纤维化的影响. 第二军医大学学报,1996;17:424-426
[3] Hu ZL, Zhang JP, Qian DH. Effects of matrine on mouse splenocyte proliferation and release of interleulcin-1 and -6 from peritoneal maerophayes in vitro. Acta Pharmacol Sin, 1996;17:259
, 百拇医药
[4] 于世瀛,贲长恩,杨美娟,白锦雯,赵丽云. 免疫性和化学性损伤肝纤维化动物模型的比较. 实验动物科学与管理. 1995;12:5-11
[5] 孙树勋主编. 医用电子显微学基础. 北京:北京出版社,1992:202-208
[6] Rice-Evans C. Alternation in erythrocyte membrane fluidity by phenylhdrazine-induced peroxidation of lipids. Biophys Res Commun, 1981;100:1537
[7] 高春芳,孔宪涛. 肝贮脂细胞与肝纤维化. 临床肝胆病杂志,1994;10:125-127
[8] Moshage H, Casini A, Lieber CS. Acetaldehyde selectively stimulates collagen production in cultured rat liver fat-storing cells but not in hepatocytes. Hepatology, 1990;12:511-518
[9] Williamson JR. Role of liver metabolism. Biochim Biophys Acta, 1981;639:243-248
收稿日期 1998-08-04 修回日期 1998-11-19, http://www.100md.com
单位:张家口医学院超微病理教研室 河北省张家口 075029
关键词:肝疾病/病理学;肝疾病/治疗;肝疾病/免疫学;苦参碱/治疗应用
世界华人消化杂志990205 摘 要
目的 通过对苦参碱抗免疫性肝损伤作用的研究,为中药治疗免疫性肝损伤开辟新的途径.
方法 将大鼠随机分为正常对照组、实验对照组、丹参对照组、苦参碱治疗1组和苦参碱治疗2组,后4组大鼠给猪血清ip,7wk以复制肝损伤动物模型,然后分别利用丹参注射液和苦参碱注射液对大鼠进行治疗,共4wk. 实验起11wk后处死动物,经心脏取血,离心制备血清,检测血清中ALT,BUN含量,A/G值,LN,HA含量,SOD的活性和MDA的含量,剖腹取肝组织制作光、电镜标本检查.
, 百拇医药
结果 实验对照组大鼠血清ALT,BUN,A/G,LN,HA,SOD,MDA较正常对照组有显著性差异(P<0.05);而丹参组和苦参碱组大鼠血清生化指标较正常组无显著性差异(P>0.05);与实验对照组相比具有显著性差异(P<0.05). 光镜下观察:实验对照组大鼠与正常对照组相比,肝细胞受损,胶原纤维面密度远远大于其他组;而丹参组和苦参碱治疗2组与实验对照组相比,肝细胞损伤不明显;丹参和苦参碱组间质细胞数目明显低于实验对照组(P<0.05). 电镜下观察:丹参和苦参碱组与实验对照组相比较,肝细胞变形很少,线粒体膜未见损伤,细胞质内粗面内质网形态与正常对照组近似,基质内胶原纤维较实验对照组明显减少(P<0.05).
结论 苦参碱具有抗大鼠免疫性肝损伤的作用.
中国图书资料分类号 R575
Study on the mechanism of matrine on immune liver injury in rats
, 百拇医药
LIANG Ping, BO Ai-Hua, XUE Gui-Ping, HAN Rui, LI Hai-Feng and XU Yong-Li
Department of Ultramicropathology of Zhangjiakou Medical College, Zhangjiakou 075029, Hebei Province, China
Subject headings liver disease/pathology; liver disease/therapy; liver disease/immunology; matrine/therapeutic use
Abstract
AIM To further explore possible ways for the treatment of immune liver injury by traditional Chinese medicine matrine (M).
, 百拇医药
METHODS Rats were administrated intra-abdominally swine serum to induce immune liver injury model and then were treated with tanshinol (T) and matrine (M) respectively. Serum ALT, BUN, A/G, LN, HA, SOD and MDA were measured and liver specimens were taken and prepared for light and electron microscopic examination.
RESULTS The above serum parameters in T or M group had no marked differences from those of normal control group, yet, significant differences did exist between tanshinol (T) or matrine (M) group and experimental control group (P<0.05). Light and electron microscopic examination showed that, compared with experimental control (EC), no obvious pathological changes were found in the livers of T and M groups and proliferation of collagen fibers greatly decreased too. It was also found that the numbers of interstitial cells were significantly lowered in T and M groups than in EC group.
, 百拇医药
CONCLUSION Matrine had the effect of anti immune liver injury in rats.
0 引言
多种有害因素可以导致肝脏损伤和继发性肝纤维化,进一步发展可导致肝硬变. 目前研究表明,肝纤维化在进入肝硬变之前尚有逆转至正常的可能[1],因此,抗肝损伤-肝纤维化的研究是目前世界生物医学领域研究的热点问题之一. 有研究表明,苦参碱可防治四氯化碳诱发的大鼠实验性肝纤维化[2,3],但其对大鼠免疫性肝损伤的影响还未见报道. 为了开发中药在抗肝损伤中的作用并探讨其机制,我们复制免疫性肝损伤动物模型,采用丹参注射液作为阳性对照,用苦参碱注射液对动物进行治疗,旨在为中药治疗免疫性肝损伤开辟新的途径.
1 材料和方法
, http://www.100md.com
1.1 材料 健康Wistar大鼠65只,5月~6月龄,雌雄兼用,体重190g~230g. 购自首都医科大学动物养殖中心. 雌雄分笼混养,自由饮食,观察1wk后用于实验.
1.2 方法 将大白鼠随机分成正常对照组、实验对照组、丹参对照组、苦参碱治疗1组、苦参碱治疗2组,每组各13只动物. 后4组参照猪血清注射法[4]复制肝纤维化动物模型:猪血清0.5mL,ip, 1次/wk;8wk,正常对照组和实验对照组动物改生理盐水0.3mL/kg,im,1次/wk;后三组动物分别im丹参注射液和苦参碱注射液进行治疗,丹参对照组0.3mL/kg(相当于丹参0.5g/kg);苦参碱治疗1组7.5mg/kg;苦参碱治疗2组15mg/kg,共4wk. 11wk后,各组动物同时取材. 戊巴比妥钠(40mg/kg)麻醉,剖开胸部,经心脏取血5mL,剖腹,取肝脏. ①肝功能检测:采用常规分析法测定ALT,BUN,A/G值. ②血清LN,HA含量测定:采用免疫分析法. ③MDA和SOD的测定:按照试剂盒规定操作. ④石蜡及电镜切片的制作:常规方法制作. ⑤肝组织间质细胞计数. ⑥肝组织胶原纤维定量分析:采用面数密度测量法[5].
, http://www.100md.com
统计学处理 经方差齐性检验后,采用方差分析进行统计学处理.
2 结果
猪血清诱导的肝损伤大鼠与正常对照组大鼠相比,在实验期间毛发光泽、一般状态良好,饮食,饮水无异常波动,4wk后体重增长速度较正常对照组缓慢,而且少数动物尿色偏黄.
2.1 血清生化 ①肝功能变化:实验对照组ALT值显著高于正常对照组,A/G值显著低于正常组,BUN含量高于正常对照组. 丹参对照组和苦参碱治疗1,2组组间各项指标及各组与正常组无明显差异,与实验对照组具有显著性差异(表1). ②血清LN,HA含量变化:实验对照组LN,HA含量明显高于其他组,治疗组与正常对照组之间无显著性差异(表1). ③血清中SOD活性和MDA含量的变化:实验对照组与正常对照组相比SOD活性和MDA含量均有显著性差异;治疗组大鼠血清中SOD活性明显高于实验对照组,MDA含量低于实验对照组;而与正常对照组相比则无明显差异;丹参对照组和苦参碱治疗1,2组组间无显著性差异(表1).
, 百拇医药
表1 各组大鼠血清生化检测结果 (
 ±s,n=13) 分组
±s,n=13) 分组ALT
(nmol/S)
A/G比值
BUN
(mmol/L)
LN
(μg/L)
HA
(μg/L)
SOD
, http://www.100md.com
(KNU/L)
MDA
(μmol/L)
正常对照
415±125b
0.91±0.1b
6.3±2b
43±9d
181±65d
86±7e
90±29f
, 百拇医药
实验对照
555±120
0.72±0.1
8.9±2
70±12
303±65
79±9
145±39
丹参对照
436±127a
1.0±0.1b
6.3±1a
, http://www.100md.com
44±13d
193±43b
90±6f
95±26f
苦参碱治疗1
460±93a
0.8±0.2a
6.3±1b
52±14d
242±63b
, http://www.100md.com
87±9e
114±31a
苦参碱治疗2
441±65a
0.9±0.1a
6.1±1a
45±11d
200±41d
91±8f
98±25f
, 百拇医药
aP<0.05,eP<0.05;bP<0.01,dP<0.01,fP<0.01,vs 实验对照组.
2.2 肝脏病理学
2.2.1 光镜观察 ①肝细胞和肝小叶的形态变化:正常大鼠肝因间质成分较少,肝小叶分界不清. HE染色肝细胞排列呈索状,围绕中央静脉呈放射状排列,肝细胞呈多边形,边界不十分清晰,核1~2个呈圆形,嗜碱性,位于细胞中央,细胞质微嗜酸性. Mallory染色肝细胞核呈蓝色,细胞质微黄色. 间质胶原纤维呈蓝色,正常肝组织胶原纤维很少(图1). 实验对照组HE染色可见肝细胞变性,细胞质中有大量空泡,有的肝细胞质膜破裂,肝细胞变性坏死. Mallory染色局部增生的胶原纤维组成粗大的兰色纤维束,纵横交错,使肝内有类假小叶样结构形成(图2),胶原纤维面数密度远远多于其他各组(表2). 丹参组肝细胞损伤不明显,胞质中空泡减少或不明显,胶原纤维增生不明显或似正常对照组. 苦参碱治疗1,2组肝细胞结构清晰,小叶分界不清,中央静脉和汇管区内胶原纤维较实验对照组少(图3),治疗2组胶原纤维面数密度与丹参组及正常组接近,治疗1组胶原纤维面数密度与正常组比较则较高并有显著性差异(表2). ②间质细胞及基质:正常对照组肝内间质细胞(库氏细胞、贮脂细胞、窦内皮细胞等)细胞核较小,分散在血窦处及汇管区,数目较少;实验对照组间质细胞数目明显增多;而丹参及苦参碱组间质细胞数明显低于实验对照组. 结果(表2).
, http://www.100md.com
表2 肝组织间质细胞数和胶原纤维面数密度 (
 ±s,n=13) 分组
±s,n=13) 分组汇管区
(个/mm2)
小叶间
(个/mm2)
胶原纤维面数
密度(面/mm2)
正常对照
8.13±0.4b
5.79±0.4b
, 百拇医药
6.0±1.1d
实验对照
10.42±0.7
7.26±0.5
16.0±4.3
丹参对照
7.73±1.1b
5.80±0.4b
6.3±1.8d
苦参碱治疗1
8.61±0.9b
, 百拇医药
6.06±0.6b
7.3±1.8d
苦参碱治疗2
7.75±0.7b
5.90±0.6b
6.6±1.7d
bP<0.01,dP<0.01,vs 实验对照组.

图1 正常对照组肝脏结构 HE,×100

, 百拇医药
图2 实验对照组肝脏结构Mallory,×100 ↑汇管区 ▲胶原纤维束

图3 苦参碱治疗2组肝脏结构 HE,×100 ↑汇管区 ▲中央静脉
2.2.2 电镜观察 ①肝细胞:正常对照组肝细胞周边圆滑,核膜清晰,核周间隙均匀,常染色质呈絮状,异染色质相对较少,呈斑块状,核仁可见,胞质分布均匀;线粒体呈圆形或椭圆形,较均匀分布于胞质内,数量较多,基质电子密度中等,由双层单位膜包绕,嵴突入线粒体内与表面垂直;粗面内质网(RER)亦较丰富,网腔较狭窄,电子密度低,存在于核周和血窦面,一般多弯曲平行排列;滑面内质网(SER)呈泡状,数量较少,多分布在胆小管周围胞质内;核糖体及糖原颗粒也明显可见;肝细胞血窦面有丰富的指状微绒毛;伸入Disse间隙;肝细胞胆小管面有相邻肝细胞膜特化形成的胆小管及管周连结复合体,小管腔面有丰富的微绒毛(图4).

, http://www.100md.com
图4 正常对照组肝细胞及胆小管 ×12000 ↑线粒体 ▲胆小管
实验对照组肝细胞质膜或胞质均有不同程度的损伤性超微结构变化. 轻者细胞器减少,胞质内脂滴增多,线粒体局部膜断裂或变为单层膜,嵴减少,基质电子密度降低,胞核周边呈锯齿状,异染色质增多,核周隙加宽;重者细胞核染色质溶解,胞质内细胞器消失,粗面内质网扩张呈不规则泡状、脱颗粒(图5). 丹参对照组肝细胞核变形很少,未见核质溶解,细胞质内溶酶体相对增多,线粒体膜未见损伤,细胞质内粗面内质网和滑面内质网及核糖体基本与正常对照组类同. 苦参碱治疗1组大部分肝细胞超微结构变化不显著,小部分肝细胞质内脂滴比丹参组多(图6). 苦参碱治疗2组肝细胞超微结构与丹参组无明显差异. ②间质:正常对照组鼠肝血窦内皮细胞核内异染色质较多,胞质少,电子密度低,细胞器不发达;库氏细胞的胞质内有丰富的初、次级溶酶体;贮脂细胞核不规则,异染色质多,电子密度高,胞质亦较少,胞质内有1~2个脂滴,细胞器不发达. 实验对照组血窦内皮细胞超微结构变化不明显,枯否细胞增多,胞质中次级溶酶体及线粒体增多;贮脂细胞增多,胞体变大,并且细胞器增多,可见内质网、线粒体等;浆细胞样细胞增多,其胞核结构典型,胞质有丰富的粗面内质网,基质内有较多的带有周期性横纹的胶原原纤维,它们聚集组成粗大的胶原纤维束(图7),即在光学显微镜下经Mallory氏染色后为蓝色条索(图2). 丹参及苦参碱治疗组间质内细胞成分主要是血窦内皮细胞和枯否细胞,枯否细胞溶酶体等细胞器与正常对照组无明显差异;浆细胞样间质细胞较少或消失;贮脂细胞形态多样,有的胞体较小,和正常对照组相比无明显差异,有的胞体较大,胞质电子密度低,细胞器散在于胞质中. 治疗组基质内仍可见少量胶原纤维束,但与实验对照组相比减少或仅为细束.

, 百拇医药
图5 实验对照组肝细胞 ×9000 ↑核周隙加宽

图6 丹参对照组肝细胞 ×9000 ↑线粒体 ▲内质网

图7 苦参碱治疗1组肝细胞 ×8000 ↑脂滴

图8 实验对照组肝细胞间质 ×9000 ↑贮脂细胞 ▲胶原纤维
3 讨论
丹参对照组和苦参碱治疗组的肝细胞损伤程度和纤维化程度较实验对照组明显减轻,有些接近正常. 如ALT,BUN,LN,HA含量与实验对照组相比显著降低,SOD活性显著提高,间质细胞数及间质中胶原纤维密度也大大少于实验对照组(P<0.05),提示苦参碱具有抗免疫性肝损伤作用. 其作用机制主要表现在以下几个方面.
, 百拇医药
3.1 保护膜结构 当各种致病因素引起肝细胞病变时,肝细胞膜出现不同程度的损伤,影响膜的形态与正常生理功能,严重时导致细胞部分或全部膜溶解,出现屏障紊乱,内容物向外释放,如肝炎病变中,血清中ALT酶活性升高是细胞膜损伤的结果. 本研究实验对照组光镜下,肝细胞可见变性、坏死、细胞膜破裂,血清学检测ALT酶活性增高(P<0.05),BUN升高(P<0.05),清蛋白合成减少,球蛋白合成增高,即A/G比值降低. 电镜下线粒体内膜出现部分溶解或成为单层膜,且数量减少,内质网扩张呈不规则泡状,粗面内质网有脱颗粒现象. 而苦参碱治疗组光镜下肝细胞基本正常,血清学检测ALT,BUN,A/G与正常组比无明显差别. 电镜下肝细胞膜、线粒体膜结构完整,基本与正常组相一致,粗面内质网大都平行排列,线粒体数量增加,说明苦参碱有保护膜结构的功能. 膜脂质过氧化反应是破坏膜脂层结构完整性的机制之一,Rice-Evans[6]报道膜脂质过氧化后,膜中脂类的致密度增大,柔性减小,刚性变大,易于破裂. 实验结果表明,SOD活性的增加,可以加速清除自由基,阻止自由基对组织细胞膜中不饱和脂肪酸的链锁反应,延缓组织细胞膜老化和损伤. 因此提示苦参碱对细胞膜结构保护作用可能与其抗自由基作用有关.
, http://www.100md.com
3.2 抑制间质细胞增生 间质细胞包括窦内皮细胞、库氏细胞、各类淋巴细胞和贮脂细胞,活化的贮脂细胞在肝纤维化的发生和发展过程中起着关键性作用[7,8]. 本实验Mallory染色实验对照组汇管区周围、小叶间,可见增生的胶原纤维,苦参碱组肝脏结构基本正常,未见胶原纤维的增生. HE染色实验对照组汇管区周围出现较多的淋巴细胞及浆细胞等炎性细胞浸润,小叶内也可看到明显的间质增多;治疗组间质细胞增生不明显. 间质细胞计数分析,实验对照组和治疗组之间有显著性差异(P<0.05),治疗组与正常对照组差异不明显. 电镜下实验对照组可以看到胶原原纤维和胶原纤维束,治疗组和正常组纤维束不明显,提示苦参碱具有抑制间质细胞增生和防治肝纤维化的作用.
3.3 调节代谢 肝脏是生物转化和能量代谢的重要场所,而线粒体和内质网是这一过程中最重要的细胞器;线粒体内膜完整及其两侧的电化学势是完成氧化磷酸化的基本前提,内膜的特性是对物质交换选择性很强. 因此正常内膜是整个线粒体结构和功能的保证[9]. 本实验实验对照组亚细胞结构上发生多方面的病理改变,如线粒体膜出现部分溶解、破裂、内膜消失、体积增大,嵴消失或减少、电子密度降低等等,随之表现为肝功能障碍、自由基增多等(表1),说明实验对照组肝细胞内生物代谢发生障碍,而治疗组在亚细胞结构上除脂滴和溶酶体较正常对照组相对较多外,其他基本一致,说明苦参碱在保护细胞膜结构的同时也起到了调节代谢的作用.
, 百拇医药
本研究结果表明:①苦参碱能够保护肝细胞,尤其是保护膜性结构效果明显. ②能够提高大鼠的血清中SOD活性,降低MDA含量,降低ALT和提高A/G比值,降低LN,HA水平. ③能够减少肝组织中汇管区和小叶内间质细胞的数量,抑制胶原纤维的增生. ④苦参碱大剂量组(苦参碱治疗2组)与丹参对照组相比,各生化指标及肝组织结构无显著性差异;苦参碱小剂量组(苦参碱治疗1组)对肝损伤的治疗效果略逊于丹参对照组. 因此我们认为,苦参碱具有抗免疫性肝损伤和纤维化的作用.
作者简介:梁萍,女,1971-01-19生,河北省张家口市人,汉族. 1992西北大学生物系毕业,现河北医科大学硕士研究生.
通讯作者 薄爱华,075029,张家口医学院超微病理教研室,河北省张家口市长青路14号.
Correspondence to:Prof. BO Ai-Hua, Department of Ultramicropathology of Zhangjiakou Medical College, Zhangjiakou 075029, Hebei Province, China
, 百拇医药
Tel. +86.313.8028572 Ext. 299
4 参考文献
[1] 石淑仙. 肝纤维化诊断与治疗的研究进展. 实用医学进修杂志,1996;24:125-128
[2] 陈伟忠,张俊平,许表,胡振林,谢渭芬,张兴荣. 苦参碱对大鼠实验性肝纤维化的影响. 第二军医大学学报,1996;17:424-426
[3] Hu ZL, Zhang JP, Qian DH. Effects of matrine on mouse splenocyte proliferation and release of interleulcin-1 and -6 from peritoneal maerophayes in vitro. Acta Pharmacol Sin, 1996;17:259
, 百拇医药
[4] 于世瀛,贲长恩,杨美娟,白锦雯,赵丽云. 免疫性和化学性损伤肝纤维化动物模型的比较. 实验动物科学与管理. 1995;12:5-11
[5] 孙树勋主编. 医用电子显微学基础. 北京:北京出版社,1992:202-208
[6] Rice-Evans C. Alternation in erythrocyte membrane fluidity by phenylhdrazine-induced peroxidation of lipids. Biophys Res Commun, 1981;100:1537
[7] 高春芳,孔宪涛. 肝贮脂细胞与肝纤维化. 临床肝胆病杂志,1994;10:125-127
[8] Moshage H, Casini A, Lieber CS. Acetaldehyde selectively stimulates collagen production in cultured rat liver fat-storing cells but not in hepatocytes. Hepatology, 1990;12:511-518
[9] Williamson JR. Role of liver metabolism. Biochim Biophys Acta, 1981;639:243-248
收稿日期 1998-08-04 修回日期 1998-11-19, http://www.100md.com