47例鼻咽癌遗传变异的研究
作者:郭颖 方嬿 梁启万 李辉梅 关新元* 曾益新
单位:郭颖 方嬿 梁启万 李辉梅 关新元 曾益新(中山医科大学肿瘤研究所(广州,510060))
关键词:鼻咽肿瘤;比较基因组杂交(CGH);杂合性缺失
癌症/990202
【摘要】目的:进一步明确不同周期时相肿瘤细胞p16基因的表达水平及在细胞周期调控中的作用。方法:改进并建立了一个高同步率、高收获率的细胞周期同步化的方法[7],通过此方法把细胞同步在不同的时期,对RNA及蛋白的表达进行研究,确定在不同周期时相中p16的表达有何变化,同时分析其它几个重要的抑癌基因如p53、p21,研究它们在细胞周期中的表达以及与p16基因相互关系。结果:确定在不同周期时相的胃癌细胞系MGc80-3和BGC823细胞中,p16mRNA的表达随细胞种类的不同而有一定的差异,其蛋白在各周期时相中均有表达,在两种细胞中无明显差异。p53在各个周期时相的表达无明显差异,Waf1/p21的蛋白和mRNA的表达具有一致性,M期其mRMA不表达,而蛋白有微弱的表达。结论:以上结果表明在肿瘤细胞G1期CDK4活性的调节,可能主要不是发生在mRNA和蛋白表达水平上。
, 百拇医药
中图号:R735.2;R730.231 文献标识码:A 文章编号:1000-467X(1999)02-0116-05
Differential transcription of p16, Wafi/p21 and p53 genes through
the cell cycle in human gastric carcinoma cell lines
WANG Jun LI Wen mei LIANG Yun yan, et al
Beijing Institute for Cancer Research, Beijing 100034,China
【Abstract】 Objective: To determine the expression of p16, Waf1/p21 and p53 genes in G1,S,G2/M phase of human gastric tumor cell lines,MGC803 and BGC82-3.Methods: The cells were synchronized in G1,S,G2/M phase by using high pressure N2O technique. Northern,Western blotting and immunofluorescence techniques was used to detect gene expression .Results: High efficient synchronizated cells were obtained and expreession of p16,Wafi/p21 and p53 genes were detected in the cells. Neither p16 mRNA nor its protein expression is changed during cell cycle progression of the MGC80-3.In BGC823 cell there is no detectable expression of p16 mRNA in M and G1 phase while p16 protein is constitutively expressed through the cell cycle. Similar with the expression of p16 mRNA, p53 mRNA expression is not Changed by cell cycle progression in the two cell lines ,although its exprexxion level in MGC80-3 is much higher in M phase than G1, S and G2 phases.Expression of p21 mRNA was detected in G1,S and G2 phases,but not in M phase,and the expression of p21 protein is lower in M phase than G1,S and G2 phases. Our data also show that p16 and p21 protein in G1 and S phase was located in cytoplasm and gathered to nucleus in G2 phase. Conclusion These results suggested that the regulation of CDK4 activity in G1 phase of human gastric tumor cells may not rely on the expression of mRNA and protein.
, 百拇医药
Key words:Gastric neoplasms;Cell cycle;p16;Wafi/p21
由于抑癌基因MTS1/p16的发现及对其功能的了解,人们逐渐把肿瘤发生与细胞周期联系起来,肿瘤细胞实际上是一些细胞周期异常的细胞,肿瘤的发生不仅是原癌基因活化和抑癌基因失活或丢失的结果,还包括细胞周期调控中Rb、p53和CKI(cyclin dependent kinase Inhibitor,周期蛋白激酶抑制因子)等一系列因子丧失活性,导致肿瘤抑制信号无法再对细胞周期中的调节蛋白家族(cyclins)/周期蛋白依赖性激酶家族(cyclin-dependent kinase, CDKs)进行调控,从而形成周期运转失控[1,2]。
p16基因位于染色体9p21区,最初是在SV40转化的成纤维细胞中作为与CDK4相联系的蛋白而被发现[3],体外研究发现它能抑制CDK4和CDK6的活性[4]。在许多类型的肿瘤中这一染色体区域都有异常,在黑色素瘤细胞系中p16的点突变与纯和缺失率达75%,其他肿瘤细胞系中这一比例也很高[5]。另外,CpG岛的甲基化也被认为可能是使p16基因失活的重要机制[6]
, 百拇医药
对p16在调节细胞增殖和诱导肿瘤发生中所起作用的研究很多,但对其表达的调节仍然知之甚少。由于p16是直接参与细胞周期的抑癌基因,因而对其表达的研究应以细胞周期为基础。但是由于以前的细胞周期同步化技术的局限,人们多是以混合的肿瘤细胞来研究p16基因的表达及功能,而不同的肿瘤细胞其周期时相有明显的差异,因而用混合细胞来研究p16其结果不具广泛性。我们改进并建立了一个高同步率、高收获率的细胞周期同步化的方法[7],通过此方法把细胞同步在不同的时期,对RNA及蛋白的表达进行研究,确定在不同周期时相中p16的表达有何变化,同时分析其它几个重要的抑癌基因如p53、p21,研究它们在细胞周期中的表达以及与p16基因相互关系,对了解肿瘤的发生与细胞周期的关系具有一定意义。
1 材料与方法
1.1 细胞培养及同步化
MGc80-3是山东师院建立的人胃低分化粘液腺癌细胞系,人胃癌BGC823细胞系为北京医科大学附属人民医院建立,为人胃粘膜腺癌细胞系,用含15%胎牛血清(天津血研所)DMEM培养基(GIBCO公司),于37℃5%CO2恒温培养箱中培养。
, http://www.100md.com
MGc80-3细胞接种24~48小时后,先用过量TdR(2.5mM,Sigma公司)预处理,再于高压N2O条件下(37℃)培养一定时间,阻断细胞于有丝分裂期,经轻轻振荡,可获得大量有丝分裂期细胞。把所获的M期细胞继续培养5小时左右,细胞贴壁即为G1期。G1期细胞再以过量TdR(2.5mM,Sigma公司)进行阻断,释放后5小时及12小时分别获得S期和G2期细胞。各个处理间隔时间的选择是根据放射自显影的标记指数及有丝分裂指数动态测定的结果[7]。
1.2 免疫荧光分析
生长在盖片上的细胞,同步到不同时相,以冷丙酮(-20℃)固定后分别与p16多抗及p21单抗37℃孵育1hr,PBS漂洗后再与FITC标记的羊抗兔IgG或FITC标记的羊抗鼠IgG孵育45min,60%甘油/PBS封片,Olympus荧光显微镜观察并照相。
1.3 Northern杂交分析
, 百拇医药
同步到不同周期的细胞,采用酚-异硫氰酸胍一步法提取RNA。15μgRNA样品经1.2%琼脂糖电泳分离,毛细管法转移至NC膜(S&S公司)探针用[α-32P]dCTP随机引物试剂盒标记,在含2.5mMK3PO4,5×SSC,5×Danhardt's,50μg/ml鱼精DNA,50%甲酰胺的杂交液中42℃杂交16~18小时,2×SSC,0.1%SDS室温洗2遍,0.1×SSC,0.1%SDS37℃洗两遍,-70℃压片曝光。
1.4 Western杂交分析
同步到不同周期的细胞,用不含溴酚蓝的Laemmli sample buffer裂解。100μg蛋白样品经15%SDS-PAGE电泳分离,电转移至NC膜(S&S公司),分别与p16、p21抗体(Santa Cruz公司)反应,ECL化学发光系统(Amersham公司)检测信号。
2 结果
, 百拇医药
2.1 不同周期时相细胞形态及免疫荧光分析
M期细胞处于分裂状态,呈圆形,细胞与基质脱离,悬浮于培养液中。处于分裂中期的细胞中可见染色体明显的排列于赤道板上,免疫荧光发现p21和p16弥散于细胞中,染色体上为阴性。G1期细胞已完全贴壁,虽未完全伸展仍呈圆形,免疫荧光结果则发现p21与p16位于胞质。S期细胞DNA开始复制,此时的细胞已完全铺展,p16与p21虽仍位于胞质但逐渐向核膜靠拢。而G2早期的细胞仍较伸展,晚G2期的细胞则为圆形,p21和p16完全进入细胞核内(见图1,2,3,4)。



, 百拇医药
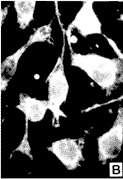
图1:MGc80-3细胞不同周期时相p16蛋白免疫荧光结果
a.M期(132×),核膜消失,蛋白弥散于细胞内,蛋白位
于细胞内,而染色体上则为阴性;b.G1期(132×),蛋白
位于胞胞质中;c.S期(330×),则逐渐向核膜聚集;d.G2
期(132×),蛋白完全位于核内。


, 百拇医药
图2:MGc80-3细胞不同周期时相p21蛋白免疫荧光结果
a.M期(132×),核膜消失,明显可见染色体排于赤道板
上,p21蛋白弥散于细胞内而染色体上为阴性;b.G1期
(132×),蛋白位于胞质中;c.S期(132×),则逐渐向核
膜聚集;d.G2期(132×),蛋白完全位于核内。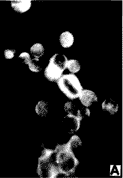


, 百拇医药
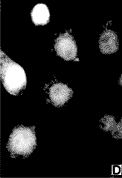
图3.BGC823细胞不同周期时相p16蛋白疫荧光结果
a.M期(132×),核膜消失,明显可见染色体排于赤
道板上,p16蛋白弥散于细胞内而染色体上为阴性;
b.G1期(330×),蛋白位于胞质中;c.S期(330×),则逐渐向核膜聚集;d.G2期(132×),蛋白完全位于核内。



图4.BGC823细胞不同周期时相p21蛋白疫荧光结果
, 百拇医药
a.M期(132×),M核膜消失,蛋白弥散于细胞内,而染色体上则为阴性;b.G1期(330×),蛋白位于
胞质中;c.S期(132×),则逐渐向核膜聚集;
d.G2期(132×),p21蛋白完全位于核内。
2.2 p16在不同周期时相表达的差异
Northern杂交结果显示,MGc80-3细胞的p16表达在四个周期时相没有明显差异,在BGc823细胞中M期与C1期p16的表达显著弱于S期与G2期的表达(见图5,6)。蛋白表达检测发现两个细胞系中四个时期p16蛋白的表达无明显差异(见图7,8)。
, http://www.100md.com
图5:MGc80-3细胞不同周期时相
Northern杂交结果 结果显示,M
期p53表达明显比其余三个时相高,p21在M期无表达,而p16在四个时
相中的表达无明显差异。
图6:BGC823细胞不同周期时相
Northern杂交结果。 结果显
示,p53在四个时相中的表达无
明显差异,而p21在M期不表达。
图7:MGc80-3细胞不同周期时相Western杂交结果
, http://www.100md.com
结果显示M期p21的表达明显低于其它三个时相,而
p16在四个周期时相蛋白表达无明显差异。
图8:BGC823细胞不同周期时相Western杂交结果
结果显示,M期p21的表达明显低于其它三个时相,而p16在四个周期时相蛋白表达无明显差异。
2.3 p21在不同周期时相表达的差异
在这两个胃癌细胞系中,M期均无p21mRNA的表达,其余三个时期的表达无明显差异(见图5,6)。蛋白表达检测发现M期p21的表达比其它三个时期要低(见7,8)。
2.4 p53在不同周期时相表达的差异
, 百拇医药
Northern杂交结果显示,在两个细胞系的四个周期时相中,p53的表达没有明显差异(见图5,6)。
总之,虽然,p16RNA及蛋白的表达无明显的周期特异性,但在不同周期时相的定位有明显的差异,这可能也是其功能调节的一个重要方面,可能与其蛋白的磷酸化等相结合共同起着调节细胞增殖、防止细胞恶化等重要功能。
3 讨论
大量工作报道p16在G1期与cyclinD、CDK4或CDK6以及pRb共同形成一反馈环调节细胞周期的运转。CDK4或CDK6与cyclinD结合而被激活继而磷酸化pRb,从而激活转录因子E2F促使S期特殊的基因表达[6]。CDKs的表达在整个细胞中是稳定的,它们的调节发生在其它的水平上。D型cyclins与CDKs结合以及CAK对CDKs的磷酸化都能诱导它们的活化。p16与cyclinD竞争结合CDK4和CDK6,抑制CDK4和CDK6的活化,使细胞停滞于G1期[3]。我们的实验结果表明p16在MGC80-3细胞各个周期时相中无论mRNA或蛋白都呈显著性表达且表达强度相似,在BGC823细胞中四个时期表达稳定的主要是蛋白,而mRNA在G1期与M期表达低,这就进一步说明p16在癌细胞中的表达是随细胞类型不同而不同。我们对BGc823细胞的染色体核型分析表明其17号染色体上p53基因有部分缺失,而9号染色体并没有异常。在M和G1期p16mRNA不表达可能是由于某些调节因子的影响关闭了p16基因的转录,这也许是除p16活性降低以外细胞癌变的另一原因。我们实验中发现,在BGc823细胞中转入p16基因后裸鼠成瘤性有明显下降[8]。此外,国外有人曾报道植物凝集素刺激的淋巴细胞在G1、S、G2+M期稳定的表达p16的mRNA和蛋白[9]。而我们不仅进一步在人胃癌细胞四个时期中观察到p16的稳定表达,而且首次发现其定位随细胞周期而异。
, 百拇医药
与p16的表达一致,p53的表达也不受细胞周期的调节,而p21的表达则不同,它在M期不表达,其余三个时期均表达,这可能与p21的功能有关。p21能抑制所有已知的cyclin/CDK复合物,其中cyclinD/CDK4和cyclinE/CDK2分别在R点和G1/S检查点起作用,cyclinA/CDK2是DNA复制所必须的,cyclinB/cdc2在G2/M检查点起作用[9]。因而在G1,S和G2期都需要有P21存在,而在M期P21的功能消失,其RNA不再表达,可能G2期表达的P21蛋白未完全降解,因而M期仍有部分的P21蛋白存在。
虽然人们对p16、p21蛋白在细胞周期中的表达有了一定的认识,但是它们在细胞周期时相中的定位仍不清楚,蛋白是否在正确的位置表达又能决定其功能能否发挥。我们对不同时相细胞进行免疫荧光检测,结果发现G1期p16和p21位于胞质中,在S期则向核膜聚集,到了G2期p21和p16全都位于细胞核内。这一入核过程可能与信号传递有关,有人报道依赖于cAMP的蛋白激酶位于胞质,而G2期则移位入核。可能在S期到G2期的转换过程中,有一信号传递给核孔复合物,使其对这两个蛋白开放,经主动运输后进入核内。由于以前的细胞同步化方法不能把G2和M期分开,因此我们第一次报道在G2期p16、p21的移位入核现象。当然对这两个蛋白入核的原因有待于进一步的研究。
, 百拇医药
本实验显示p16的表达可能随细胞种类的不同而有一定的差异,但G1期p16的表达水平并不高于其它的时期。尤其是p16蛋白在细胞周期各时相中的表达无明显差异,因而需要对参与p16表达的调节因子进行深入的研究,了解究竟哪些因子参与CDK4、CDK6功能的调节,并促使细胞通过R点,这一结果表明在G1期可能有其它因子参与CDK4活性调节,这一因子的克隆将有助于细胞周期调控的进一步认识。在此基础上,我们已开始利用同步化技术与mRNA差异显示技术结合,进行新的基因克隆。
基金项目:北京市自然科学基金资助项目(项目号952005,7961001)
参考文献
1 Hirama T. and Koeffler H.P.Role of the cyclin-dependent kinase inhibitor in the development of cancer〔J〕.Blood,1995,86(3):841~ 854.
, 百拇医药
2 Grana X. And Reddy E.p.Cell cycle control im mammalian cells:role of cyclins,cyclin dependent kinase (CDKs),growth suppressor and cyclindependent kinase inhibitor(CKls).〔J〕.Oncogene 1995,11:211~ 219.
3 Xiong Y.,Zhang H. and Beach D.Subunit rearrangement of the cyclindependent kinases is associated with cellular transformation〔J〕.Genes Dev,1993,7:1572~ 1583
4 Xiong Y.,Hannon G.J,Zhang H.et al,p21 is a universal inhibitor of cyclin kinase〔J〕.Nature,1993,366:701~ 704
, 百拇医药
5 Kamb A.,Gruis N.A.,Weaver Feldhaus J.,Liu Q.et al. Acell cycle regulator potentially involved in Genesis of many tumor types〔J〕.Science,1994, 264:436~ 440
6 Kamb A. Cell-cycle regulators and cancer〔J〕. Trends Genet 1995,11:136~ 140
7 梁云燕,王代树,方家椿等.一种高效率细胞同步化技术的改良与运用〔J〕.细胞生物学杂志,1991,13(3):137~140
8 李文梅,吕有勇.导入Rb、p53、p16和H-ras反义RNA对人胃癌细胞恶性增殖的影响〔J〕.中国肿瘤生物治疗杂志,1997,4(2):90~94
9 Soucek T.,Pusch O.,Hengstschlager-Ottnad E. et al. Expression of the cyclin dependent kinase inhibitor p16 during the ongoing cell cycle〔J〕.FEBS Letters,1995,373:16~ 169
收稿日期:1999-03-11, http://www.100md.com
单位:郭颖 方嬿 梁启万 李辉梅 关新元 曾益新(中山医科大学肿瘤研究所(广州,510060))
关键词:鼻咽肿瘤;比较基因组杂交(CGH);杂合性缺失
癌症/990202
【摘要】目的:进一步明确不同周期时相肿瘤细胞p16基因的表达水平及在细胞周期调控中的作用。方法:改进并建立了一个高同步率、高收获率的细胞周期同步化的方法[7],通过此方法把细胞同步在不同的时期,对RNA及蛋白的表达进行研究,确定在不同周期时相中p16的表达有何变化,同时分析其它几个重要的抑癌基因如p53、p21,研究它们在细胞周期中的表达以及与p16基因相互关系。结果:确定在不同周期时相的胃癌细胞系MGc80-3和BGC823细胞中,p16mRNA的表达随细胞种类的不同而有一定的差异,其蛋白在各周期时相中均有表达,在两种细胞中无明显差异。p53在各个周期时相的表达无明显差异,Waf1/p21的蛋白和mRNA的表达具有一致性,M期其mRMA不表达,而蛋白有微弱的表达。结论:以上结果表明在肿瘤细胞G1期CDK4活性的调节,可能主要不是发生在mRNA和蛋白表达水平上。
, 百拇医药
中图号:R735.2;R730.231 文献标识码:A 文章编号:1000-467X(1999)02-0116-05
Differential transcription of p16, Wafi/p21 and p53 genes through
the cell cycle in human gastric carcinoma cell lines
WANG Jun LI Wen mei LIANG Yun yan, et al
Beijing Institute for Cancer Research, Beijing 100034,China
【Abstract】 Objective: To determine the expression of p16, Waf1/p21 and p53 genes in G1,S,G2/M phase of human gastric tumor cell lines,MGC803 and BGC82-3.Methods: The cells were synchronized in G1,S,G2/M phase by using high pressure N2O technique. Northern,Western blotting and immunofluorescence techniques was used to detect gene expression .Results: High efficient synchronizated cells were obtained and expreession of p16,Wafi/p21 and p53 genes were detected in the cells. Neither p16 mRNA nor its protein expression is changed during cell cycle progression of the MGC80-3.In BGC823 cell there is no detectable expression of p16 mRNA in M and G1 phase while p16 protein is constitutively expressed through the cell cycle. Similar with the expression of p16 mRNA, p53 mRNA expression is not Changed by cell cycle progression in the two cell lines ,although its exprexxion level in MGC80-3 is much higher in M phase than G1, S and G2 phases.Expression of p21 mRNA was detected in G1,S and G2 phases,but not in M phase,and the expression of p21 protein is lower in M phase than G1,S and G2 phases. Our data also show that p16 and p21 protein in G1 and S phase was located in cytoplasm and gathered to nucleus in G2 phase. Conclusion These results suggested that the regulation of CDK4 activity in G1 phase of human gastric tumor cells may not rely on the expression of mRNA and protein.
, 百拇医药
Key words:Gastric neoplasms;Cell cycle;p16;Wafi/p21
由于抑癌基因MTS1/p16的发现及对其功能的了解,人们逐渐把肿瘤发生与细胞周期联系起来,肿瘤细胞实际上是一些细胞周期异常的细胞,肿瘤的发生不仅是原癌基因活化和抑癌基因失活或丢失的结果,还包括细胞周期调控中Rb、p53和CKI(cyclin dependent kinase Inhibitor,周期蛋白激酶抑制因子)等一系列因子丧失活性,导致肿瘤抑制信号无法再对细胞周期中的调节蛋白家族(cyclins)/周期蛋白依赖性激酶家族(cyclin-dependent kinase, CDKs)进行调控,从而形成周期运转失控[1,2]。
p16基因位于染色体9p21区,最初是在SV40转化的成纤维细胞中作为与CDK4相联系的蛋白而被发现[3],体外研究发现它能抑制CDK4和CDK6的活性[4]。在许多类型的肿瘤中这一染色体区域都有异常,在黑色素瘤细胞系中p16的点突变与纯和缺失率达75%,其他肿瘤细胞系中这一比例也很高[5]。另外,CpG岛的甲基化也被认为可能是使p16基因失活的重要机制[6]
, 百拇医药
对p16在调节细胞增殖和诱导肿瘤发生中所起作用的研究很多,但对其表达的调节仍然知之甚少。由于p16是直接参与细胞周期的抑癌基因,因而对其表达的研究应以细胞周期为基础。但是由于以前的细胞周期同步化技术的局限,人们多是以混合的肿瘤细胞来研究p16基因的表达及功能,而不同的肿瘤细胞其周期时相有明显的差异,因而用混合细胞来研究p16其结果不具广泛性。我们改进并建立了一个高同步率、高收获率的细胞周期同步化的方法[7],通过此方法把细胞同步在不同的时期,对RNA及蛋白的表达进行研究,确定在不同周期时相中p16的表达有何变化,同时分析其它几个重要的抑癌基因如p53、p21,研究它们在细胞周期中的表达以及与p16基因相互关系,对了解肿瘤的发生与细胞周期的关系具有一定意义。
1 材料与方法
1.1 细胞培养及同步化
MGc80-3是山东师院建立的人胃低分化粘液腺癌细胞系,人胃癌BGC823细胞系为北京医科大学附属人民医院建立,为人胃粘膜腺癌细胞系,用含15%胎牛血清(天津血研所)DMEM培养基(GIBCO公司),于37℃5%CO2恒温培养箱中培养。
, http://www.100md.com
MGc80-3细胞接种24~48小时后,先用过量TdR(2.5mM,Sigma公司)预处理,再于高压N2O条件下(37℃)培养一定时间,阻断细胞于有丝分裂期,经轻轻振荡,可获得大量有丝分裂期细胞。把所获的M期细胞继续培养5小时左右,细胞贴壁即为G1期。G1期细胞再以过量TdR(2.5mM,Sigma公司)进行阻断,释放后5小时及12小时分别获得S期和G2期细胞。各个处理间隔时间的选择是根据放射自显影的标记指数及有丝分裂指数动态测定的结果[7]。
1.2 免疫荧光分析
生长在盖片上的细胞,同步到不同时相,以冷丙酮(-20℃)固定后分别与p16多抗及p21单抗37℃孵育1hr,PBS漂洗后再与FITC标记的羊抗兔IgG或FITC标记的羊抗鼠IgG孵育45min,60%甘油/PBS封片,Olympus荧光显微镜观察并照相。
1.3 Northern杂交分析
, 百拇医药
同步到不同周期的细胞,采用酚-异硫氰酸胍一步法提取RNA。15μgRNA样品经1.2%琼脂糖电泳分离,毛细管法转移至NC膜(S&S公司)探针用[α-32P]dCTP随机引物试剂盒标记,在含2.5mMK3PO4,5×SSC,5×Danhardt's,50μg/ml鱼精DNA,50%甲酰胺的杂交液中42℃杂交16~18小时,2×SSC,0.1%SDS室温洗2遍,0.1×SSC,0.1%SDS37℃洗两遍,-70℃压片曝光。
1.4 Western杂交分析
同步到不同周期的细胞,用不含溴酚蓝的Laemmli sample buffer裂解。100μg蛋白样品经15%SDS-PAGE电泳分离,电转移至NC膜(S&S公司),分别与p16、p21抗体(Santa Cruz公司)反应,ECL化学发光系统(Amersham公司)检测信号。
2 结果
, 百拇医药
2.1 不同周期时相细胞形态及免疫荧光分析
M期细胞处于分裂状态,呈圆形,细胞与基质脱离,悬浮于培养液中。处于分裂中期的细胞中可见染色体明显的排列于赤道板上,免疫荧光发现p21和p16弥散于细胞中,染色体上为阴性。G1期细胞已完全贴壁,虽未完全伸展仍呈圆形,免疫荧光结果则发现p21与p16位于胞质。S期细胞DNA开始复制,此时的细胞已完全铺展,p16与p21虽仍位于胞质但逐渐向核膜靠拢。而G2早期的细胞仍较伸展,晚G2期的细胞则为圆形,p21和p16完全进入细胞核内(见图1,2,3,4)。




, 百拇医药
图1:MGc80-3细胞不同周期时相p16蛋白免疫荧光结果
a.M期(132×),核膜消失,蛋白弥散于细胞内,蛋白位
于细胞内,而染色体上则为阴性;b.G1期(132×),蛋白
位于胞胞质中;c.S期(330×),则逐渐向核膜聚集;d.G2
期(132×),蛋白完全位于核内。




, 百拇医药
图2:MGc80-3细胞不同周期时相p21蛋白免疫荧光结果
a.M期(132×),核膜消失,明显可见染色体排于赤道板
上,p21蛋白弥散于细胞内而染色体上为阴性;b.G1期
(132×),蛋白位于胞质中;c.S期(132×),则逐渐向核
膜聚集;d.G2期(132×),蛋白完全位于核内。




, 百拇医药
图3.BGC823细胞不同周期时相p16蛋白疫荧光结果
a.M期(132×),核膜消失,明显可见染色体排于赤
道板上,p16蛋白弥散于细胞内而染色体上为阴性;
b.G1期(330×),蛋白位于胞质中;c.S期(330×),则逐渐向核膜聚集;d.G2期(132×),蛋白完全位于核内。




图4.BGC823细胞不同周期时相p21蛋白疫荧光结果
, 百拇医药
a.M期(132×),M核膜消失,蛋白弥散于细胞内,而染色体上则为阴性;b.G1期(330×),蛋白位于
胞质中;c.S期(132×),则逐渐向核膜聚集;
d.G2期(132×),p21蛋白完全位于核内。
2.2 p16在不同周期时相表达的差异
Northern杂交结果显示,MGc80-3细胞的p16表达在四个周期时相没有明显差异,在BGc823细胞中M期与C1期p16的表达显著弱于S期与G2期的表达(见图5,6)。蛋白表达检测发现两个细胞系中四个时期p16蛋白的表达无明显差异(见图7,8)。


, http://www.100md.com
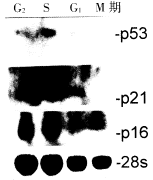
图5:MGc80-3细胞不同周期时相
Northern杂交结果 结果显示,M
期p53表达明显比其余三个时相高,p21在M期无表达,而p16在四个时
相中的表达无明显差异。
图6:BGC823细胞不同周期时相
Northern杂交结果。 结果显
示,p53在四个时相中的表达无
明显差异,而p21在M期不表达。

图7:MGc80-3细胞不同周期时相Western杂交结果
, http://www.100md.com
结果显示M期p21的表达明显低于其它三个时相,而
p16在四个周期时相蛋白表达无明显差异。

图8:BGC823细胞不同周期时相Western杂交结果
结果显示,M期p21的表达明显低于其它三个时相,而p16在四个周期时相蛋白表达无明显差异。
2.3 p21在不同周期时相表达的差异
在这两个胃癌细胞系中,M期均无p21mRNA的表达,其余三个时期的表达无明显差异(见图5,6)。蛋白表达检测发现M期p21的表达比其它三个时期要低(见7,8)。
2.4 p53在不同周期时相表达的差异
, 百拇医药
Northern杂交结果显示,在两个细胞系的四个周期时相中,p53的表达没有明显差异(见图5,6)。
总之,虽然,p16RNA及蛋白的表达无明显的周期特异性,但在不同周期时相的定位有明显的差异,这可能也是其功能调节的一个重要方面,可能与其蛋白的磷酸化等相结合共同起着调节细胞增殖、防止细胞恶化等重要功能。
3 讨论
大量工作报道p16在G1期与cyclinD、CDK4或CDK6以及pRb共同形成一反馈环调节细胞周期的运转。CDK4或CDK6与cyclinD结合而被激活继而磷酸化pRb,从而激活转录因子E2F促使S期特殊的基因表达[6]。CDKs的表达在整个细胞中是稳定的,它们的调节发生在其它的水平上。D型cyclins与CDKs结合以及CAK对CDKs的磷酸化都能诱导它们的活化。p16与cyclinD竞争结合CDK4和CDK6,抑制CDK4和CDK6的活化,使细胞停滞于G1期[3]。我们的实验结果表明p16在MGC80-3细胞各个周期时相中无论mRNA或蛋白都呈显著性表达且表达强度相似,在BGC823细胞中四个时期表达稳定的主要是蛋白,而mRNA在G1期与M期表达低,这就进一步说明p16在癌细胞中的表达是随细胞类型不同而不同。我们对BGc823细胞的染色体核型分析表明其17号染色体上p53基因有部分缺失,而9号染色体并没有异常。在M和G1期p16mRNA不表达可能是由于某些调节因子的影响关闭了p16基因的转录,这也许是除p16活性降低以外细胞癌变的另一原因。我们实验中发现,在BGc823细胞中转入p16基因后裸鼠成瘤性有明显下降[8]。此外,国外有人曾报道植物凝集素刺激的淋巴细胞在G1、S、G2+M期稳定的表达p16的mRNA和蛋白[9]。而我们不仅进一步在人胃癌细胞四个时期中观察到p16的稳定表达,而且首次发现其定位随细胞周期而异。
, 百拇医药
与p16的表达一致,p53的表达也不受细胞周期的调节,而p21的表达则不同,它在M期不表达,其余三个时期均表达,这可能与p21的功能有关。p21能抑制所有已知的cyclin/CDK复合物,其中cyclinD/CDK4和cyclinE/CDK2分别在R点和G1/S检查点起作用,cyclinA/CDK2是DNA复制所必须的,cyclinB/cdc2在G2/M检查点起作用[9]。因而在G1,S和G2期都需要有P21存在,而在M期P21的功能消失,其RNA不再表达,可能G2期表达的P21蛋白未完全降解,因而M期仍有部分的P21蛋白存在。
虽然人们对p16、p21蛋白在细胞周期中的表达有了一定的认识,但是它们在细胞周期时相中的定位仍不清楚,蛋白是否在正确的位置表达又能决定其功能能否发挥。我们对不同时相细胞进行免疫荧光检测,结果发现G1期p16和p21位于胞质中,在S期则向核膜聚集,到了G2期p21和p16全都位于细胞核内。这一入核过程可能与信号传递有关,有人报道依赖于cAMP的蛋白激酶位于胞质,而G2期则移位入核。可能在S期到G2期的转换过程中,有一信号传递给核孔复合物,使其对这两个蛋白开放,经主动运输后进入核内。由于以前的细胞同步化方法不能把G2和M期分开,因此我们第一次报道在G2期p16、p21的移位入核现象。当然对这两个蛋白入核的原因有待于进一步的研究。
, 百拇医药
本实验显示p16的表达可能随细胞种类的不同而有一定的差异,但G1期p16的表达水平并不高于其它的时期。尤其是p16蛋白在细胞周期各时相中的表达无明显差异,因而需要对参与p16表达的调节因子进行深入的研究,了解究竟哪些因子参与CDK4、CDK6功能的调节,并促使细胞通过R点,这一结果表明在G1期可能有其它因子参与CDK4活性调节,这一因子的克隆将有助于细胞周期调控的进一步认识。在此基础上,我们已开始利用同步化技术与mRNA差异显示技术结合,进行新的基因克隆。
基金项目:北京市自然科学基金资助项目(项目号952005,7961001)
参考文献
1 Hirama T. and Koeffler H.P.Role of the cyclin-dependent kinase inhibitor in the development of cancer〔J〕.Blood,1995,86(3):841~ 854.
, 百拇医药
2 Grana X. And Reddy E.p.Cell cycle control im mammalian cells:role of cyclins,cyclin dependent kinase (CDKs),growth suppressor and cyclindependent kinase inhibitor(CKls).〔J〕.Oncogene 1995,11:211~ 219.
3 Xiong Y.,Zhang H. and Beach D.Subunit rearrangement of the cyclindependent kinases is associated with cellular transformation〔J〕.Genes Dev,1993,7:1572~ 1583
4 Xiong Y.,Hannon G.J,Zhang H.et al,p21 is a universal inhibitor of cyclin kinase〔J〕.Nature,1993,366:701~ 704
, 百拇医药
5 Kamb A.,Gruis N.A.,Weaver Feldhaus J.,Liu Q.et al. Acell cycle regulator potentially involved in Genesis of many tumor types〔J〕.Science,1994, 264:436~ 440
6 Kamb A. Cell-cycle regulators and cancer〔J〕. Trends Genet 1995,11:136~ 140
7 梁云燕,王代树,方家椿等.一种高效率细胞同步化技术的改良与运用〔J〕.细胞生物学杂志,1991,13(3):137~140
8 李文梅,吕有勇.导入Rb、p53、p16和H-ras反义RNA对人胃癌细胞恶性增殖的影响〔J〕.中国肿瘤生物治疗杂志,1997,4(2):90~94
9 Soucek T.,Pusch O.,Hengstschlager-Ottnad E. et al. Expression of the cyclin dependent kinase inhibitor p16 during the ongoing cell cycle〔J〕.FEBS Letters,1995,373:16~ 169
收稿日期:1999-03-11, http://www.100md.com