锌缺乏和锌过量对小鼠胚胎长骨发育的影响
作者:马丽英 王瑞淑 李云
单位:华西医科大学公共卫生学院营养与食品卫生教研室 (成都 610044)
关键词:
卫生毒理学杂志990212 锌是维持人和动物正常生命活动不可缺乏的必需微量元素之一,许多实验证明锌缺乏可引起骨骼的生长迟缓,但锌过量对骨的毒性作用报道较少[1~4]。采用小鼠胚胎长骨体外培养,研究锌缺乏和锌过量对骨发育的影响,为阐明锌影响骨发育的机理积累资料,为合理指导使用锌强化食品以及发挥锌的合理营养作用提供依据。
材料与方法
一、材料
1.实验动物:选用昆明种小鼠,雌鼠体重25~35g,雄鼠体重30~40g。由四川抗生素研究所中心提供(合格号为为川实动管0085)。动物喂养在昼夜循环的12/12小时(电子自动控制),温度(24±3)℃,湿度60%~70%的环境条件下,自由饮水进食,选择健康的雌,雄鼠,晚上10:00按雌∶雄为2∶1的比例合笼,次日晨8:00检查阴栓,查见阴栓定为妊娠0天。
, http://www.100md.com
2.主要设备及试剂:隔水式恒温培养箱,旋转装置(微型电动机,铝合金转盘与支架),GBJb培养基、胎牛血清(FBS)、硫酸锌、N-N-N’-N’-4(2-吡啶甲基)乙二胺(TPEN)均为Sigma公司产品。
二、方法
1.试验分组:用原子吸收分光光度法测定培养基中的锌含量,然后加入不同剂量的锌和锌拮抗剂(TPEN),并分为以下各组:(1)对照组(ZC):培养基锌浓度为2.1×10-5mol/L;(2)缺锌组(ZD):TPEN加入培养基的浓度为2.1×10-5mol/L;(3)刺激量组(ZS):培养基锌浓度为1×10-4mol/L;(4)高剂量组(ZH):培养基锌浓度为5×10-4mol/L;(5)极高剂量组(ZVH):培养基锌浓度为1×10-3mol/L;(6)缺锌补锌组(ZDR):培养基TPEN浓度为2.1×10-5mol/L,然后再加入锌使其浓度为2.1×10-5mol/L。
, http://www.100md.com
2.培养方法:取出16天孕龄小鼠的胚胎,在解剖显微镜下剥离肌肉及软组织,游离出尺骨放入旋转装置培养2天、4天,旋转装置的转速为35r/min,每天通混合气体1次,混合气体的比例为氧气45%。二氧化碳5%,氮气50%。
3.指标观察:(1)骨总长度及骨干长度的测量:在带游标标尺的解剖显微镜下测量尺骨总长度、骨干长度。(2)光镜下的病理学观察:将尺骨固定在4%多聚甲醛磷酸缓冲液中,石蜡包埋,切成5μm厚的切片,HE染色后,进行组织学观察。(3)碱性磷酸酶活性的测定:将培养的尺骨打成匀浆,在超声震荡仪震荡30min,用磷酸对硝基苯基质动力学法测定AKP的活性。用考马斯亮蓝法测定蛋白质。
4.数据处理:用SPSS/PC+统计软件进行统计分析。
结果
一、锌对小鼠胚胎尺骨总长度和骨干长度的影响
, http://www.100md.com
由图1,2可见培养2天ZVH组小鼠胚胎尺骨总长度、骨干长度明显低于对照组总长度、骨干长度明显低于对照组(P<0.05)。培养4天后,ZD,ZH,ZVH三组骨总长度、骨干长度明显低于对照组(P<0.05),而ZS组骨总长度、骨干长度明显高于对照组(P<0.05)。
图1 培养2天,锌对小鼠胚胎尺骨总长度、骨干长度的影响 ■骨总长度(mm) □骨干长度(mm)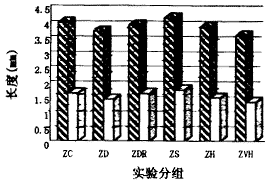
图2 培养4天,锌对小鼠胚胎尺骨总长度、骨干长度的影响 ■骨总长度(mm) □骨干长度(mm)
二、组织学观察结果
ZH、ZVH组培养2天后小鼠胚胎尺骨出现胞浆肿胀,核淡染,细胞融合形成破骨细胞,培养4天后,出现核固缩、核碎片、细胞死亡现象(图3)。
, http://www.100md.com
图3 ZVH组小鼠胚胎尺骨细胞出现核固缩、核碎片(培养4天,HE染色 400×)
三、锌对骨中AKP活性的影响
从附表中可见,培养2天或4天后,ZD、ZH、ZVH3组的骨中AKP活性与ZC比较均有不同程度的降低(P<0.05),ZS组的骨中AKP活性比ZC明显增高(P<0.01)。
附表 培养2天、4天锌对AKP活性的影响(IU/mg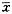 ±s) 培养天数
±s) 培养天数
骨(根)
ZC
ZD
ZDR
, 百拇医药
ZS
ZH
ZVH
2
30
110.6±30.8
36.2±9.2a
112.3±39.5b
181.0±26.0a
53.2±10.3a
26.6±8.7ac
, http://www.100md.com
4
30
631.4±50.3
16.4±6.2a
610.2±42.7b
1019.7±84.1a
172.8±34.5a
80.4±11.4ac
a:与ZC相比 b:与ZD相比 c:与ZH相比
讨论
, http://www.100md.com
我国以谷类食品为主食,而植物性食品含锌较低,又存在干扰吸收利用的因素,因此人群中缺锌普遍,使用锌制剂及锌强化食品也相当广泛,但使用不当可造成锌摄入过量,所以,研究锌缺乏、锌过量对机体的危害具有一定的现实意义。本研究在Schwertz建立的小鼠胚胎骨器官培养方法[5,6]的基础上进行改进,系统分析了该方法的可靠性(另文发表),根据正常人血清锌的浓度(1.5×10-5~2.5×10-5mol/L)和文献报道[7]进行分组,设立ZDR组消除TPEN对本实验的干扰。
锌以锌酶和各种锌蛋白的结构方式参与生物体的基因转录,复制及蛋白质的合成。AKP为含锌金属蛋白酶,参与骨的代谢,锌是酶活性中心的重要组成成分,以二硫键与半胱氨酸残基相连,酶的活化依赖于AKP中的锌,同时AKP的活性也依赖于镁的存在[8,9],所以,本实验结果,锌缺乏组AKP活性明显降低,锌的刺激剂量组(1×10-4mol/L)AKP活性达最高,当锌含量达5×10-4mol/L时,过量的锌取代了AKP中的镁,该酶活性降低。锌浓度越高,酶活性抑制越明显。当锌缺乏组再补充一定剂量的锌时,AKP活性提高,说明锌缺乏、锌过量均可影响骨中AKP的活性。Yamaguchi观察到骨组织培养中AKP活性升高与锌有关,当给成年大鼠及断乳鼠口服含锌制剂,骨干的Zn、Ca、DNA含量和AKP活性增高。用大鼠胚胎的颅骨进行体外培养时,当培养基锌浓度为1×10-3mol/L时,AKP活性明显降低[10~12]。而本实验培养基的锌浓度为5×10-4mol/L时,AKP活性开始降低,1×10-3mol/L时降低更明显,5×10-4mol/L时,AKP活性达最高,这种浓度的差异可能与选择的培养物不同有关。
, 百拇医药
Joan[13]采用鸡胚的长骨进行体外培养,当培养基锌浓度高于40μg/ml(6.5×10-4mol/L)时,其组织学观察结果成骨细胞的数量随着培养时间的延长而减少。培养2天出现胞浆肿胀、细胞核扩大和核淡染,有些细胞融合分化成破骨细胞,培养4天后细胞出现核固缩、核碎裂等细胞死亡现象。本实验极高锌剂量组(1×10-3mol/L),细胞出现不同程度的损伤,表现为肿胀,个别出现核固缩、核裂解等细胞死亡现象。过量的锌可对骨细胞产生毒性作用,是否由于过量的锌改变细胞内外钙离子的浓度导致细胞死亡,还有待于进一步探讨。
锌影响骨的正常生理生化过程,当锌缺乏、锌过量时均可影响骨的生长,我们选择小鼠胚胎长骨进行体外培养,准确控制锌的剂量、作用时间,排除了机体的干扰因素,当培养4天时,ZD、ZH、ZVH3组骨干长度、骨总长度均有不同程度的降低,进一步证明锌对骨生长有直接的影响。
国家自然科学基金资助项目(39600122)
, 百拇医药
参考文献
1.Keen CL.Teratogenic effects of essential trace metals:deficiences and excesses in Chang LW(ed):“Toxicology of Metals” New York:CRC Press.Inc,1996,977~1001.
2.Apgar J.Zinc and reproduction.Annu Rev Nutr,1985,5:43~68.
3.Peters JM,Wiley LM,Keen CL.Perioconceptional zinc deficiency affects uterine 3H-estrodiol binding in mice Teratog.Carcinog.Mutagen,1995,15:23~31.
, 百拇医药
4.Kenn CL,Taubeneck MW,Daston GP.Primary and secondary zinc deficiency as factors contributing to abnormal central nervous system development.Dev brain Dysfunct,1995,79~89.
5.Schwartz S,Ornoy A,Soskolne WA.An in vitro assay of bone development using fetal long bones ofmice:morphological studies.Acta Anat,1985,124:197~205.
6.Schwartz S,Soskolne WA, Neubauer J.Direct and sex-specific enhancement of bone formation and calcification by sex steroids in fetal mice in vitro.Endocrinology,1991,129:1166~1174.
, http://www.100md.com
7.Shimokawa N,Yamaguchi M.Characterization of bone protein components with polyacrylamide gel electrophoresis:effects of zinc and hormones in tissue culture.Molecular and Cellular Biochemistry,1992,117:153~158.
8.徐迪雄.锌的主要生物学作用及生物学意义.国外医学医学地理分册,1995,16(1):8~11.
9.Vallee BL,Falchuk KH.The biochemical basis of zinc physiogy.Physiol Rev,1993,73:1993.
10.Yamaquchi M,Matsui T.Stimulatory effect of zinc-chelating dipeptide on deoxyribonucleic acid synthesis in osteoblastic MC3T3-E1 cells.Peptides,1996,17(7):1207~1211.
, http://www.100md.com
11.Yamaguchi M,Ohtaki J.Effect of β-alanyl-L-histidinato zinc on osteoblastic MC3T3-E1 cells:Increase in alkaline phosphatase and proliferation.Pharmacology,1991,43:225~232.
12.Hashizume M,Yamaguchi M.Effect of β-alanyl-L-histidinato zinc on differentiation of osteoblastic MC3T3-E1 cells:Increase in alkaline phosphatase and protein concentration.Mol.Cellu.Biochemic,1994,131:19~24.
13.Joan R.The histological effects of coffer and zinc on chick embryo skeletal tissues in organ culture Br.J.Ntr,1976,36:243.
(修回日期 1998年7月), 百拇医药
单位:华西医科大学公共卫生学院营养与食品卫生教研室 (成都 610044)
关键词:
卫生毒理学杂志990212 锌是维持人和动物正常生命活动不可缺乏的必需微量元素之一,许多实验证明锌缺乏可引起骨骼的生长迟缓,但锌过量对骨的毒性作用报道较少[1~4]。采用小鼠胚胎长骨体外培养,研究锌缺乏和锌过量对骨发育的影响,为阐明锌影响骨发育的机理积累资料,为合理指导使用锌强化食品以及发挥锌的合理营养作用提供依据。
材料与方法
一、材料
1.实验动物:选用昆明种小鼠,雌鼠体重25~35g,雄鼠体重30~40g。由四川抗生素研究所中心提供(合格号为为川实动管0085)。动物喂养在昼夜循环的12/12小时(电子自动控制),温度(24±3)℃,湿度60%~70%的环境条件下,自由饮水进食,选择健康的雌,雄鼠,晚上10:00按雌∶雄为2∶1的比例合笼,次日晨8:00检查阴栓,查见阴栓定为妊娠0天。
, http://www.100md.com
2.主要设备及试剂:隔水式恒温培养箱,旋转装置(微型电动机,铝合金转盘与支架),GBJb培养基、胎牛血清(FBS)、硫酸锌、N-N-N’-N’-4(2-吡啶甲基)乙二胺(TPEN)均为Sigma公司产品。
二、方法
1.试验分组:用原子吸收分光光度法测定培养基中的锌含量,然后加入不同剂量的锌和锌拮抗剂(TPEN),并分为以下各组:(1)对照组(ZC):培养基锌浓度为2.1×10-5mol/L;(2)缺锌组(ZD):TPEN加入培养基的浓度为2.1×10-5mol/L;(3)刺激量组(ZS):培养基锌浓度为1×10-4mol/L;(4)高剂量组(ZH):培养基锌浓度为5×10-4mol/L;(5)极高剂量组(ZVH):培养基锌浓度为1×10-3mol/L;(6)缺锌补锌组(ZDR):培养基TPEN浓度为2.1×10-5mol/L,然后再加入锌使其浓度为2.1×10-5mol/L。
, http://www.100md.com
2.培养方法:取出16天孕龄小鼠的胚胎,在解剖显微镜下剥离肌肉及软组织,游离出尺骨放入旋转装置培养2天、4天,旋转装置的转速为35r/min,每天通混合气体1次,混合气体的比例为氧气45%。二氧化碳5%,氮气50%。
3.指标观察:(1)骨总长度及骨干长度的测量:在带游标标尺的解剖显微镜下测量尺骨总长度、骨干长度。(2)光镜下的病理学观察:将尺骨固定在4%多聚甲醛磷酸缓冲液中,石蜡包埋,切成5μm厚的切片,HE染色后,进行组织学观察。(3)碱性磷酸酶活性的测定:将培养的尺骨打成匀浆,在超声震荡仪震荡30min,用磷酸对硝基苯基质动力学法测定AKP的活性。用考马斯亮蓝法测定蛋白质。
4.数据处理:用SPSS/PC+统计软件进行统计分析。
结果
一、锌对小鼠胚胎尺骨总长度和骨干长度的影响
, http://www.100md.com
由图1,2可见培养2天ZVH组小鼠胚胎尺骨总长度、骨干长度明显低于对照组总长度、骨干长度明显低于对照组(P<0.05)。培养4天后,ZD,ZH,ZVH三组骨总长度、骨干长度明显低于对照组(P<0.05),而ZS组骨总长度、骨干长度明显高于对照组(P<0.05)。

图1 培养2天,锌对小鼠胚胎尺骨总长度、骨干长度的影响 ■骨总长度(mm) □骨干长度(mm)

图2 培养4天,锌对小鼠胚胎尺骨总长度、骨干长度的影响 ■骨总长度(mm) □骨干长度(mm)
二、组织学观察结果
ZH、ZVH组培养2天后小鼠胚胎尺骨出现胞浆肿胀,核淡染,细胞融合形成破骨细胞,培养4天后,出现核固缩、核碎片、细胞死亡现象(图3)。

, http://www.100md.com
图3 ZVH组小鼠胚胎尺骨细胞出现核固缩、核碎片(培养4天,HE染色 400×)
三、锌对骨中AKP活性的影响
从附表中可见,培养2天或4天后,ZD、ZH、ZVH3组的骨中AKP活性与ZC比较均有不同程度的降低(P<0.05),ZS组的骨中AKP活性比ZC明显增高(P<0.01)。
附表 培养2天、4天锌对AKP活性的影响(IU/mg
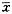 ±s) 培养天数
±s) 培养天数骨(根)
ZC
ZD
ZDR
, 百拇医药
ZS
ZH
ZVH
2
30
110.6±30.8
36.2±9.2a
112.3±39.5b
181.0±26.0a
53.2±10.3a
26.6±8.7ac
, http://www.100md.com
4
30
631.4±50.3
16.4±6.2a
610.2±42.7b
1019.7±84.1a
172.8±34.5a
80.4±11.4ac
a:与ZC相比 b:与ZD相比 c:与ZH相比
讨论
, http://www.100md.com
我国以谷类食品为主食,而植物性食品含锌较低,又存在干扰吸收利用的因素,因此人群中缺锌普遍,使用锌制剂及锌强化食品也相当广泛,但使用不当可造成锌摄入过量,所以,研究锌缺乏、锌过量对机体的危害具有一定的现实意义。本研究在Schwertz建立的小鼠胚胎骨器官培养方法[5,6]的基础上进行改进,系统分析了该方法的可靠性(另文发表),根据正常人血清锌的浓度(1.5×10-5~2.5×10-5mol/L)和文献报道[7]进行分组,设立ZDR组消除TPEN对本实验的干扰。
锌以锌酶和各种锌蛋白的结构方式参与生物体的基因转录,复制及蛋白质的合成。AKP为含锌金属蛋白酶,参与骨的代谢,锌是酶活性中心的重要组成成分,以二硫键与半胱氨酸残基相连,酶的活化依赖于AKP中的锌,同时AKP的活性也依赖于镁的存在[8,9],所以,本实验结果,锌缺乏组AKP活性明显降低,锌的刺激剂量组(1×10-4mol/L)AKP活性达最高,当锌含量达5×10-4mol/L时,过量的锌取代了AKP中的镁,该酶活性降低。锌浓度越高,酶活性抑制越明显。当锌缺乏组再补充一定剂量的锌时,AKP活性提高,说明锌缺乏、锌过量均可影响骨中AKP的活性。Yamaguchi观察到骨组织培养中AKP活性升高与锌有关,当给成年大鼠及断乳鼠口服含锌制剂,骨干的Zn、Ca、DNA含量和AKP活性增高。用大鼠胚胎的颅骨进行体外培养时,当培养基锌浓度为1×10-3mol/L时,AKP活性明显降低[10~12]。而本实验培养基的锌浓度为5×10-4mol/L时,AKP活性开始降低,1×10-3mol/L时降低更明显,5×10-4mol/L时,AKP活性达最高,这种浓度的差异可能与选择的培养物不同有关。
, 百拇医药
Joan[13]采用鸡胚的长骨进行体外培养,当培养基锌浓度高于40μg/ml(6.5×10-4mol/L)时,其组织学观察结果成骨细胞的数量随着培养时间的延长而减少。培养2天出现胞浆肿胀、细胞核扩大和核淡染,有些细胞融合分化成破骨细胞,培养4天后细胞出现核固缩、核碎裂等细胞死亡现象。本实验极高锌剂量组(1×10-3mol/L),细胞出现不同程度的损伤,表现为肿胀,个别出现核固缩、核裂解等细胞死亡现象。过量的锌可对骨细胞产生毒性作用,是否由于过量的锌改变细胞内外钙离子的浓度导致细胞死亡,还有待于进一步探讨。
锌影响骨的正常生理生化过程,当锌缺乏、锌过量时均可影响骨的生长,我们选择小鼠胚胎长骨进行体外培养,准确控制锌的剂量、作用时间,排除了机体的干扰因素,当培养4天时,ZD、ZH、ZVH3组骨干长度、骨总长度均有不同程度的降低,进一步证明锌对骨生长有直接的影响。
国家自然科学基金资助项目(39600122)
, 百拇医药
参考文献
1.Keen CL.Teratogenic effects of essential trace metals:deficiences and excesses in Chang LW(ed):“Toxicology of Metals” New York:CRC Press.Inc,1996,977~1001.
2.Apgar J.Zinc and reproduction.Annu Rev Nutr,1985,5:43~68.
3.Peters JM,Wiley LM,Keen CL.Perioconceptional zinc deficiency affects uterine 3H-estrodiol binding in mice Teratog.Carcinog.Mutagen,1995,15:23~31.
, 百拇医药
4.Kenn CL,Taubeneck MW,Daston GP.Primary and secondary zinc deficiency as factors contributing to abnormal central nervous system development.Dev brain Dysfunct,1995,79~89.
5.Schwartz S,Ornoy A,Soskolne WA.An in vitro assay of bone development using fetal long bones ofmice:morphological studies.Acta Anat,1985,124:197~205.
6.Schwartz S,Soskolne WA, Neubauer J.Direct and sex-specific enhancement of bone formation and calcification by sex steroids in fetal mice in vitro.Endocrinology,1991,129:1166~1174.
, http://www.100md.com
7.Shimokawa N,Yamaguchi M.Characterization of bone protein components with polyacrylamide gel electrophoresis:effects of zinc and hormones in tissue culture.Molecular and Cellular Biochemistry,1992,117:153~158.
8.徐迪雄.锌的主要生物学作用及生物学意义.国外医学医学地理分册,1995,16(1):8~11.
9.Vallee BL,Falchuk KH.The biochemical basis of zinc physiogy.Physiol Rev,1993,73:1993.
10.Yamaquchi M,Matsui T.Stimulatory effect of zinc-chelating dipeptide on deoxyribonucleic acid synthesis in osteoblastic MC3T3-E1 cells.Peptides,1996,17(7):1207~1211.
, http://www.100md.com
11.Yamaguchi M,Ohtaki J.Effect of β-alanyl-L-histidinato zinc on osteoblastic MC3T3-E1 cells:Increase in alkaline phosphatase and proliferation.Pharmacology,1991,43:225~232.
12.Hashizume M,Yamaguchi M.Effect of β-alanyl-L-histidinato zinc on differentiation of osteoblastic MC3T3-E1 cells:Increase in alkaline phosphatase and protein concentration.Mol.Cellu.Biochemic,1994,131:19~24.
13.Joan R.The histological effects of coffer and zinc on chick embryo skeletal tissues in organ culture Br.J.Ntr,1976,36:243.
(修回日期 1998年7月), 百拇医药